Введение
Тиреотоксикоз – синдром, при котором наблюдаются клинические и биохимические проявления избыточного содержания тиреоидных гормонов в крови вне зависимости от причины повышения их уровня [1]. Достоверно о тиреотоксикозе свидетельствует подавление уровня тиреотропного гормона (ТТГ) менее 0,1 мЕД/л (при референсных значениях 0,4–4,0 мЕД/л), при выявлении которого показано дополнительное определение свободных фракций тироксина (Т4) и трийодтиронина (Т3) [1]. Первым этапом ведения пациента с тиреотоксикозом является дифференциальная диагностика его причин.
Наиболее часто используется следующая классификация синдрома тиреотоксикоза [1]:
- Тиреотоксикоз, обусловленный повышенной продукцией гормонов щитовидной железы (ЩЖ):
- диффузный токсический зоб (ДТЗ);
- многоузловой токсический зоб;
- токсическая аденома;
- йодиндуцированный тиреотоксикоз;
- гипертиреоидная фаза аутоиммунного тиреоидита;
- ТТГ-обусловленный тиреотоксикоз: ТТГ-продуцирующая аденома гипофиза и синдром неадекватной секреции ТТГ (резистентность тиреотрофов к тиреоидным гормонам);
- трофобластический тиреотоксикоз.
- Тиреотоксикоз, обусловленный продукцией тиреоидных гормонов вне ЩЖ:
- опухоль яичника, продуцирующая гормоны ЩЖ (Struma ovarii);
- метастазы рака органа, продуцирующего тиреоидные гормоны.
- Тиреотоксикоз, не связанный с гиперпродукцией гормонов ЩЖ:
- медикаментозный (передозировка препаратов гормонов ЩЖ);
- стадия подострого тиреоидита де Кервена, стадия гипертиреоза при аутоиммунном тиреоидите, амиодарон-индуцированный тиреоидит;
- следствие повышенной чувствительности тканей к тиреоидным гормонам.
Мы хотели бы представить разбор истории болезни пациента с амиодарон-индуцированным тиреотоксикозом, установленным лишь в ходе скрупулезного обследования. Данный клинический случай в очередной раз подчеркивает важность тщательного сбора анамнеза на первичном этапе дифференциальной диагностики, а также уточнения течения предшествовавших сердечно-сосудистых заболеваний у пациентов с установленным избытком тиреоидных гормонов в крови.
Клинический пример
На консультацию обратился пациент Т. 60 лет. На момент осмотра (10.01.2019) предъявлял жалобы на нарушение ритма сердца со склонностью к брадикардии, эпизодическое повышение цифр артериального давления (АД) до 160/100 мм рт.ст.
Из анамнеза известно, что нарушение ритма и повышение АД стал отмечать с августа 2018 г. Обратился на консультацию в поликлиническое отделение ГБУЗ МЗ «Кардиологический центр» г. Нальчик. Проведенная в стационарных условиях коронарография (26.09.2018) значимых изменений кровотока миокарда не выявила. По результатам суточного холтеровского мониторирования (27.11.2018) были зарегистрированы следующие нарушения на фоне синусового ритма сердца: одиночная желудочковая экстрасистолия, мономорфная – 19 161 в сутки (физиологическая норма до 700 в сутки) и парная желудочковая мономорфная экстрасистолия – 17 в сутки. На фоне данного ритма с нормальным циркадным индексом средние, максимальные и минимальные значения частоты сердечных сокращений (ЧСС) в дневные и ночные часы в пределах нормальных значений (128–43). Нарушения проводимости и ишемические эпизоды обнаружены не были. Кардиологом была назначена антиаритмическая и антигипертензивная терапия: Аллафорте (лаппаконитина гидробромид) 25 мг 2 раза в сутки, Мезиноприл (лизиноприл) 10 мг 2 раза в сутки, Эгилок (метопролол) 25 мг (1/2 табл.) раза в сутки под контролем АД и ЧСС.
В связи с отсутствием должного эффекта от проводимой терапии для определения дальнейшей тактики ведения больной был направлен на дообследование в ФГБУ ФЦССХ Минздрава России (Астрахань), где 30.11.2018 была проведена эхокардиография, выявившая гипертрофию межжелудочковой перегородки; регургитацию на митральном клапане 1-й степени; регургитацию на трикуспидальном клапане 1-й степени. С учетом всех данных пациенту был установлен следующий диагноз: нарушение ритма сердца: частая мономорфная желудочковая экстрасистолия. Артериальная гипертензия II ст., риск 3. Хроническая сердечная недостаточность (ХСН)-IIA. Рекомендована аблация эктопических очагов миокарда.
В январе 2019 г. больному проведено цветовое дуплексное сканирование внечерепных отделов брахиоцефальных сосудов, выявившее наличие атеросклероза внечерепных отделов брахиоцефальных артерий со стенозированием каротидной бифуркации слева; непрямолинейность хода позвоночных артерий между поперечными отростками шейных позвонков.
Для выявления возможных причин ухудшения течения предшествовавших аритмий на фоне проводимого антиаритмического лечения пациент был обследован эндокринологом. По данным гормонального профиля от 12.12.2018 выявлены гипертиреоз, Т3-токсикоз: тиреотропный гормон (ТТГ)<0,001 мЕД/л (н 0,4–4,0), Т3 свободный – 6,2 пмоль/л (н – 2,6–5,7), Т4 свободный – 21,3 пмоль/л (н – 9,0–19,05), антитела (а/т) к тиреопероксидазе (ТПО) – 2,3 ЕД/мл (н <5,6). При ультразвуковом исследовании (УЗИ) ЩЖ не визуализировалась. Установлен диагноз: диффузный токсический зоб. Назначена тиреостатическая терапия тиамазолом в дозе 30 мг/сут.
Диффузный токсический зоб (ДТЗ) – аутоиммунное заболевание, развивающееся вследствие выработки а/т к рецепторам ТТГ (рТТГ), клинически проявляющееся поражением ЩЖ с развитием синдрома тиреотоксикоза в сочетании с экстратиреоидной патологией [2, 3] По распространенности среди заболеваний ЩЖ, протекающих с гипертиреозом, ДТЗ занимает лидирующее место. Так, по данным литературы, в мире 80–85% случаев синдрома тиреотоксикоза обусловлено ДТЗ [1]. Дифференциальный диагноз проводят с нейроциркуляторной дистонией, тиреотоксической стадией подострого, послеродового или аутоиммунного тиреоидита, тиреотоксической аденомой, многоузловым токсическим зобом, амиодарон-индуцированным тиреотоксикозом (АТ), фолликулярным раком ЩЖ [4].
Дополнительно пациенту были проведены следующие исследования: биохимия крови от 14.01.2019: глюкоза – 6,63 ммоль/л (н – 3,3–6,1), креатинин – 83 мкмоль/л (н – 72–127), мочевина – 7,0 ммоль/л (н – 1,7–8,3), мочевая кислота – 312 мкмоль/л (н – 208–428), билирубин общий – 21,7 мкмоль/л (н – 8,5–20,5), щелочная фосфатаза – 95 МЕ/л (н – 30–120), гомоцистеин – 13,46 мкмоль/л (н – 5,46–16,20), калий – 4,29 ммоль/л, (н – 3,5–5,1), натрий – 145,7 ммоль/л (н – 136–145), хлориды – 108,8 ммоль/л (н – 98–112), медь – 15,9 мкмоль/л (н – 10,99–21,98), магний – 0,94 ммоль/л (н – 0,73–1,06), цинк – 14,3 мкмоль/л (н – 11,1–19,5), фосфор неорганический – 0,86 ммоль/л (н – 0,81–1,45), селен – 144,3 мкг/л (н – 46–143), кальций ионизированный – 1,19 ммоль/л (н – 1,12–1,32), холестерин – 3,86 ммоль/л, триглицериды – 1,26 ммоль/л (н – 0,62–3,51), железо – 22,3 мкмоль/л (н – 12,5–32,2), фолиевая кислота – 4,2 нг/мл (н – 3,1–19,9), витамин В12 – 216 пг/мл (н – 180–914).
25-ОН витамин Д, суммарный (кальциферол) от 14.01.2019: 9,8 нг/мл (н – 30–150), гликозилированный гемоглобин – 5,4% (н – менее 6%), онкомаркеры (РЭА) – 2,95 нг/мл (0–5).
Объективно: рост – 178 см, масса тела – 88 кг. Индекс массы тела – 27,8 кг/м2. Состояние средней степени тяжести. Кожные покровы чистые, смуглые, умеренной влажности. Телосложение гиперстеническое. Подкожная клетчатка развита умеренно, распределена равномерно. ЧСС – 48 в минуту. АД – 130/80 мм рт.ст. Живот мягкий, безболезненный. Стул регулярный, оформленный. Диурез адекватный. ЩЖ не поддается пальпации, клинически эутиреоз. В позе Ромберга устойчив. Периферические лимфоузлы не увеличены. На момент осмотра признаков надпочечниковой недостаточности нет.
Несмотря на проведенную терапию тиамазолом в супрессивной дозе (40 мг/сут), сохранялись лабораторные признаки гипертиреоза. Гормональный профиль от 09.01.2019: ТТГ<0,0025 мЕД/л (н – 0,4–4,0), Т3 свободный – 6,6 пмоль/л (н – 2,6–5,7), Т4 свободный – 15,91 пмоль/л (н – 9,0–19,05), а/т к ТПО<3,0 ЕД/мл (н<5,6), паратиреоидный гормон – 58,8 пг/мл (н – 16,0–87,0), кальцитонин <2,0 пг/мл (н<18,2). Уровень а/т к рТТГ составил 1,22 ЕД/л (н<1,0).
Неэффективность проведенной тиреостатической терапии и сомнительный результат исследования уровня а/т к рТТГ поставили под вопрос имеющийся диагноз «диффузный токсический зоб». Для дообследования и определения дальнейшей тактики ведения пациент был направлен в Медицинский радиологический научный центр им. А.Ф. Цыба (Обнинск). Гормональный профиль от 30.01.2019 на фоне приема 40 мг/сут тиамазола без положительной динамики: ТТГ<0,005 мЕД/л (н – 0,4–4,0), Т3 свободный – 7,76 пмоль/л (н – 3,1–6,8), Т4 свободный – 23,38 пмоль/л (н – 12,0–22,0). Полученный низкий уровень а/т к рТТГ 0,3 ЕД/л (н<1,5) исключил аутоиммунный генез тиреотоксикоза.
Из-за затруднений визуализации ЩЖ при УЗИ (см. рисунок) с целью определения ее расположения и размеров, выявления узлов и последующей дифференциальной диагностики синдрома тиреотоксикоза пациенту была проведена сцинтиграфия (31.01.2019), результаты которой показали наличие значительно увеличенной в размерах ЩЖ, в большей степени за счет левой доли с расположением ее большей части за костными структурами (грудина). Распределение радиофармпрепарата (РФП) относительно равномерное. Дополнительных очагов накопления препарата в проекции шеи выявлено не было. Заключение: «частично загрудинно расположенная, диффузно увеличенная ЩЖ. Многоузловой зоб». Четких данных за функциональную автономию получено не было.

Функциональная автономия (ФА) ЩЖ является йоддефицитным заболеванием, при котором стойкая патологическая гиперпродукция тиреоидных гормонов обусловлена формированием в ЩЖ автономно функционирующих участков. При этом происходит не зависимый от влияния ТТГ гипофиза захват йода тиреоцитами и продукция тироксина. Наибольший риск развития ФА ЩЖ имеют пожилые пациенты с многоузловым зобом, а также лица, проживающие в регионах с йодной недостаточностью. Характерной особенностью данного заболевания являются накопления РФП в очагах гиперфункции ЩЖ при проведении сцинтиграфии [5, 6].
На основании полученных результатов обследования больной был проконсультирован радиологом (31.01.2019) и высказана возможность проведения радиойодтерапии после компенсации тиреотоксикоза на поддерживающей дозе тиамазола 5–10 мг.
При более детальном сборе анамнеза выяснилось, что в октябре 2018 г. пациент попал в реанимационное отделение кардиологического центра по месту жительства с нарушением ритма, где неоднократно внутривенно вводился антиаритмический препарат амиодарон. На основании данных анамнеза и полученных дополнительных результатов обследования эндокринологом был установлен окончательный диагноз «кордарон-индуцированный синдром тиреотоксикоза, стадия медикаментозной субкомпенсации. Многоузловой зоб». Рекомендовано лечение преднизолоном в дозе 40 мг/сут в течение 2 недель на фоне поддерживающей дозы тиамазола (5–10 мг/сут) и последующей отменой обоих препаратов под контролем свободных форм Т4 и Т3 в крови на фоне ранее назначенной антиаритмической терапии.
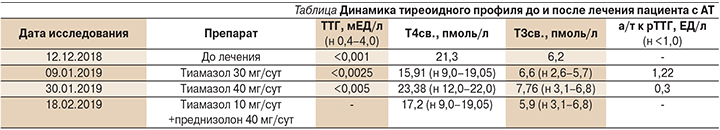
Клинически на фоне проведения терапии и лабораторной компенсации тиреотоксикоза (см. таблицу) пациент отметил улучшение самочувствия: стабилизировались цифры АД и ЧСС. Таким образом, пациенту был установлен диагноз:
Окончательный: «амиодарон-индуцированный синдром тиреотоксикоза, стадия медикаментозной субкомпенсации. Многоузловой зоб частично загрудинно расположенной ЩЖ». Сопутствующий: «нарушение ритма сердца: частая мономорфная желудочковая экстрасистолия. Артериальная гипертензия II ст., риск 3. ХСН-IIA. Нарушение гликемии натощак. Остеохондроз шейного отдела позвоночника. Атеросклероз брахиоцефальных артерий со стенозированием каротидной бифуркации слева. Дефицит витамина D».
В настоящее время больной продолжает получать ранее назначенную антиаритмическую терапию, а также нативный препарат витамина D в дозе 7000 МЕ/сут и остается под динамическим наблюдением с контролем функционального состояния ЩЖ 1 раз в 6 месяцев.
Обсуждение
Амиодарон является йодсодержащим препаратом, оказывающим антиаритмическое и антиангинальное действия. Препарат был разработан в 1961 г. в Бельгии для лечения стенокардии, однако оказался высокоэффективным в лечении жизнеугрожающих аритмий, резистентных к другим лекарственным средствам [7]. Благодаря своей выраженной липофильности препарат имеет высокую концентрацию в тканях и у ряда больных оказывает влияние на функцию ЩЖ [8]. Наиболее тяжелым проявлением амиодарон-индуцированной дисфункции ЩЖ является тиреотоксикоз. В клинической картине, как правило, доминируют сердечно-сосудистые расстройства: ухудшение течения предшествовавших аритмий, учащение приступов стенокардии, появление или усиление признаков сердечной недостаточности [9–11]. В связи с этим пациенты с нарушением ритма сердца нередко становятся пациентами эндокринолога, которому в свою очередь приходится решать вопрос о тактике лечения эндокринных расстройств у тяжелых больных с кардиальной патологией [12].
С чем же связано развитие тиреотоксикоза у пациентов, принимающих амиодарон? Дело в том, что таблетка амиодарона (200 мг) содержит 75 мг йода. Во время метаболизма из каждых 200 мг препарата высвобождается примерно 6–9 мг неорганического йода в сутки, что в 50–100 раз превышает суточную потребность в элементе, составляющую по ВОЗ 150–200 мкг [12, 13].
Частота нарушений функции ЩЖ колеблется от 15 до 20% [14, 15].
У большинства больных, принимающих амиодарон, сохраняется эутиреоз. Тем не менее у некоторых пациентов может развиться гипотиреоз или тиреотоксикоз [16]. Вариант вызванного амиодароном нарушения функции ЩЖ в определенной степени зависит от йодного обеспечения региона проживания пациента. Есть данные, согласно которым у больных, проживающих в областях с высоким потреблением йода, чаще развивается амиодарон-индуцированный гипотиреоз, в регионах с низким потреблением йода – тиреотоксикоз [7]. Следует отметить, что место проживания представленного нами пациента относится к регионам с умеренной йодной недостаточностью, что повышает риск развития у него гипертиреоза на фоне приема амиодарона. Вдобавок у больного имелись предшествовавшие изменения структуры ЩЖ по типу диффузно-узлового зоба.
Тиреотоксикоз может развиться как в первые месяцы лечения, так и через несколько лет после его начала. Благодаря накоплению препарата и его метаболита в тканях, а также медленному выведению из организма развитие АТ может начаться даже через несколько месяцев после отмены препарата [12].
Диагностика тиреотоксикоза, вызванного амиодароном, представляет бóльшие трудности, чем гипотиреоз. Благодаря антиадренергической активности амиодарона и его блокирующего влияния на конверсию Т4 и Т3 классические симптомы тиреотоксикоза – зоб, потливость, тремор рук, потеря массы тела – могут быть выражены незначительно или вовсе отсутствовать. В клинической картине доминируют сердечно-сосудистые и психические расстройства. При нераспознанном и длительно существующем тиреотоксикозе может развиться синдром дилатационной кардиомиопатии, проявляющийся снижением насосной функции сердца и появлением сердечной недостаточности [17].
Для клинициста важно дифференцировать две формы АТ для выбора правильной тактики ведения пациентов. Первый тип развивается на фоне исходно измененной ЩЖ (узловой или диффузно-узловой зоб, диффузный токсический зоб и др.) и формируется по типу йодиндуцированного тиреотоксикоза. Йод, высвобождаемый из препарата, приводит к повышению синтеза тиреоидных гормонов в существующих зонах автономии в железе. Он чаще встречается в зонах йодного дефицита. АТ 1-го типа характеризуется нормальным или повышенным захватом 99mTc при проведении сцинтиграфии. Второй тип представляет собой деструктивный тиреоидит с разрушением клеток железы из-за токсического действия самого амиодарона, а не только содержащегося в нем йода [18]. Деструкция клеток ЩЖ сопровождается выходом в кровь повышенного количества тиреоидных гормонов [19, 20]. Главная клиническая особенность этой формы – тяжесть тиреотоксикоза, в т.ч. развитие болевых форм, клинически похожих на подострый тиреоидит. При исследовании с 99mTc отмечается снижение накопления препарата в ЩЖ. Уровень а/т к рТТГ не превышает нормальных значений [21].
Для лечения АТ применяют тионамиды, глюкокортикостероиды, плазмаферез, радиойодтерапию, оперативное лечение, за рубежом – блокатор поступления йода в ЩЖ перхлорат калия [22]. Отличием терапии АТ 2-го типа от 1-го является то, что лечение проводится не большими дозами антитиреоидных препаратов (тиамазол 40–80 мг), а преднизолоном в дозе 40–50 мг/сут. Курс лечения может продолжаться до 3 месяцев, т.к. описаны случаи возобновления симптомов тиреотоксикоза при попытке снизить дозу препарата [21, 23].
В случае когда невозможно дифференцировать две формы тиреотоксикоза, рекомендуется назначать 40 мг тиамазола (или 400 мг пропилтиоурацила) и 40 мг преднизолона и через 2 недели исследовать уровень Т3св. Если уровень Т3св. снизился на 50% (деструктивный тиреотоксикоз), следует отменить тиамазол и продолжить прием преднизолона, если Т3св. снизился менее чем на 50% (повышенный синтез тиреоидных гормонов) или не изменился – отменить преднизолон, продолжить прием тиамазола (или пропилтиоурацила) [21].
Оперативное лечение обычно проводится в случае невозможности достижения компенсации заболевания после длительного (около 6 месяцев) курса медикаментозной терапии или при сочетании АТ с узловым токсическим зобом. В районах с пограничным йодным дефицитом пациентам с диффузным или узловым зобом, имеющим нормальное или повышенное поглощение радиоизотопа, в отсутствие эффекта от консервативной терапии показано лечение радиоактивным йодом.
Заключение
В приведенном клиническом случае имеет место достаточно редко встречающийся в клинической практике амиодарон-индуцированный синдром тиреотоксикоза. Трудности в первичной диагностике амиодарон-индуцированного синдрома тиреотоксикоза у представленного в статье больного были обусловлены рядом причин. Во-первых, отсутствие в анамнезе информации о приеме амиодарона. Лишь целенаправленный поиск медикаментозных причин гиперфункции ЩЖ позволил уточнить важные анамнестические данные. Во-вторых, затруднения при пальпации и УЗ-визуализации ЩЖ из-за загрудинного ее расположения. В-третьих, отсутствие в регионе проживания возможности проведения сцинтиграфии, высокоинформативного метода исследования, позволяющего с большой точностью проводить дифференциальную диагностику многих причин синдрома тиреотоксикоза. К особенностям тактики ведения представленного пациента отнесится проведение терапии глюкокортикостероидами на фоне продолжения приема тиамазола.
Для успешного ведения больного с синдромом тиреотоксикоза и хорошего исхода заболевания важно уметь своевременно выявлять симптомы гиперфункции ЩЖ, проводить дифференциальную диагностику возможных его причин, оценивать особенности течения заболевания, назначать адекватное патогенетическое и симптоматическое лечение. Для пожилых пациентов серьезную опасность представляют именно кардиальные эффекты избытка тиреоидных гормонов, такие как ухудшение течения сопутствующих форм аритмий, учащение приступов стенокардии и эпизодов синкопальных состояний. Ухудшение течения существующих аритмий у пациентов, принимающих амиодарон, служит показанием для обследования функционального состояния ЩЖ.
Согласие пациента
Пациент Т., представленный в клиническом случае, добровольно дал согласие в устной форме на публикацию персональной медицинской информации. Письменное согласие отсутствует в связи с отдаленностью проживания больного от медицинского центра.


