Введение
Сахарный диабет (СД) – важный фактор риска развития цереброваскулярных заболеваний (ЦВЗ), которые относятся к основным причинам смерти больных СД 2 типа (СД2), занимая второе место после сердечной недостаточности. В условиях глобальной эпидемии СД как во всем мире, так и в нашей стране проблема ЦВЗ у больных СД приобретает все большее медико-социальное значение. Согласно статистическим данным, общая численность пациентов с СД в России на 31.12.2017 составила 4 498 955 (3,06% населения РФ), причем в 12,17% причиной смерти были нарушения мозгового кровообращения [1, 2].
Несмотря на значительные успехи борьбы с острыми нарушениями мозгового кровообращения (НМК) и снижение показателей смертности от них во всем мире, частота инсульта и его последствия значительно увеличились за последние три десятилетия [3]. Общеизвестна ассоциированная с образом жизни заболеваемость СД2, который является хорошо известным независимым фактором риска инсульта с такими потенцирующими его действие факторами риска, как ожирение, гипертензия и дислипидемия [4, 5]. Развитию и течению хронических форм цереброваскулярной патологии у больных СД2 уделялось меньше внимания, вероятно, ввиду их меньшей драматичности. Однако увеличившийся в популяции процент лиц с хроническими ЦВЗ, связанный как с увеличением продолжительности жизни, так и с достижениями ургентной ангионеврологии, а также коморбидные когнитивные нарушения и деменция активировали эту опцию научных исследований [6].
Основная роль в развитии сосудистых поражений при СД2 отводится гипергликемии. Именно с хронической гипергликемией и образованием конечных продуктов гликирования связывают развитие осложнений при СД [7]. Полагается, что избыточное гликирование может быть ключевым фактором в развитии метаболической памяти, поскольку его продукты производятся и накапливаются необратимо в организме больных СД в зависимости от степени и продолжительности гипергликемии и играют центральную роль в патофизиологии диабетических осложнений [8]. Гипергликемия и инсулинорезистентность являются триггером эндотелиальной дисфункции и атеросклеротических процессов [9], лежащих в основе патогенеза ЦВЗ. Клеточный апоптоз, увеличение числа молекул межклеточной адгезии и хроническое сосудистое воспаление способствуют дальнейшему развитию атеросклероза [10]. Прогрессирование атеросклероза играет ведущую роль в реализации острого НМК – ОНМК [11]. Все это приводит к тому, что ЦВЗ развиваются у 21% больных уже в первые 6 лет после выявления СД2 [12]. С другой стороны, с повышением уровня гликозилированного гемоглобина (HbA1c) увеличивается риск нарушений ритма сердца [13], что определяет наличие кардиального источника эмболии и развитие кардиоэмболического ишемического инсульта (ИИ).
Традиционно оценивался уровень гликемии у пациентов на фоне возникновения ОНМК. Как было показано ранее, риск развития инсульта напрямую связан с гипергликемией [14].
В последние годы все больше внимания уделяется не только гипергликемии в острейший период НМК, но и значению HbA1c в увеличении риска развития инсульта [15]. Для пациентов с хроническими ЦВЗ патогенетическая связь СД2, его длительность и качество гликемического контроля с состоянием сосудистой стенки магистральных артерий головы остаются недостаточно изученными.
Цель исследования: оценить роль параметров углеводного обмена в развитии острых и хронических форм ЦВЗ у больных СД2.
Методы
Работа выполнена в дизайне открытого сравнительного исследования.
В исследование были включены 167 пациентов с СД2 и ишемическими ЦВЗ, наблюдавшихся в ФГБНУ «Научный центр неврологии», разделенных на две группы: в первой (n=87) были пациенты с ишемическими ОНМК, во второй (n=80) – пациенты с хроническими ЦВЗ (ХЦВЗ). Настоящее исследование служит продолжением работы по изучению влияния СД2 на течение и исходы ИИ, результаты которой опубликованы ранее [16].
Исследование было проведено на базе ФГБНУ.
Все пациенты группы 1 были госпитализированы в острейший период НМК и получали лечение в соответствии с протоколом медицинской помощи при ИИ. В качестве клинических критериев оценки неврологического дефицита пациентам группы 1 была проведена оценка по шкале инсульта Национального института здоровья (NIHSS) [17]. Во группу 2 были включены пациенты как вне острого периода ИИ (не менее полугода после перенесенного НМК), так и с подостро нарастающей хронической ишемией головного мозга (по типу дисциркуляторной энцефалопатии).
Для верификации диагноза проводилось дуплексное сканирование магистральных артерий головы на ультразвуковом приборе Toshiba Viamo (Корея), а также магнитно-резонансная томография головного мозга на магнитном резонансном томографе Siemens 1,5 Тесла (США).
Пациентам проведены общесоматический и неврологический осмотры, общеклинические и биохимические исследования. Определены следующие показатели всех пациентов: уровень глюкозы для пациентов группы 1 в течение 1 часа от поступления в стационар [18], для больных группы 2 – в первые сутки от поступления в стационар натощак; липидный профиль (общий холестерин – ОХС, липопротеиды высокой плотности – ЛПВП, липопротеиды низкой плотности – ЛПНП, триглицериды), уровень НbA1c. Все биохимические показатели, а также уровень НbA1c определяли на автоматическом биохимическом анализаторе Konelab 30I (Финляндия) с использованием наборов реагентов фирмы Randox (Великобритания). Уровень глюкозы определяли гексокиназным методом, НbA1c – иммунотурбодиметрическим методом.
Дополнительное медицинское вмешательство в рамках исследования не предусматривалось. Пациенты получали сахароснижающую терапию в соответствии с алгоритмами оказания медицинской помощи больным СД [19].
Основными показателями, оцениваемыми в ходе исследования, стали параметры углеводного обмена: уровни гликемии, HbA1c, длительность анамнеза СД2, а также признаки поражения прецеребральных артерий: наличие атеросклероза брахиоцефальных (магистральных) артерий, наличие гемодинамически значимых стенозов внутренней сонной артерии (ВСА).
Соответствие исследования нормам биомедицинской этики подтверждено заключением Локального комитета по этике (протокол № 11/14 от 19.11.2014).
Принципы расчета размера выборки: размер выборки предварительно не рассчитывался. Статистическая обработка проведена на Intel-совместимом персональном компьютере с использованием программ Microsoft Excel 2000, пакета прикладных программ Statistica (StatSoft Inc. версия 6.0, USA). Согласно дизайну исследования, для проверки гипотезы о нормальности распределения применялся критерий Колмогорова–Смирнова. При нормальном распределении признаков результаты описывались в виде среднее значение±стандартное отклонение. При распределении признака, отличного от нормального, данные представлены как медиана значений (значение верхнего и нижнего квартилей). Для проверки гипотезы о различии использованы критерии Манна–Уитни, U-тест, Вилкоксона. Для сравнения пропорций в двух независимых группах применяли критерий Фишера и χ2-критерий. За уровень статистической значимости принимали р<0,05.
Результаты исследования
У пациентов обеих групп основными сосудистыми процессами, лежащими в основе ЦВЗ, оказались артериальная гипертензия и атеросклероз (табл. 1).

При оценке распространенности ИБС отмечена тенденция в большей частоте встречаемости у больных ОНМК (55,2 против 41,25%; р=0,072973). При этом у больных ОНМК значимо чаще отмечены нарушения сердечного ритма (26,8 против 12,5%; р=0,010245). Следует отметить, что при оценке ведущего патогенетического подтипа инсульта обнаружено преобладание атеротромботического генеза (63,2%). Индекс массы тела (ИМТ) в обеих группах был сопоставим: 32,0±5,5 и 30,8±4,15 кг/м2 соответственно в группах 1 и 2 (р=0,0964).
Выраженность неврологической симптоматики у пациентов с ОНМК при оценке с использованием шкалы NIHSS составила 9,0±5,3 балла.
В группе больных хроническими ЦВЗ 38 (47,5%) пациентов имели анамнестические указания на перенесенные ранее НМК, у 42 (52,5%) заболевание имело подострое течение. У всех пациентов группы 2 отмечены клинические проявления в виде вестибуло-атактического, цефалгического, астенического и мнестического синдромов, у пациентов, перенесших НМК ранее, выявлены двигательные и чувствительные нарушения различной степени выраженности.
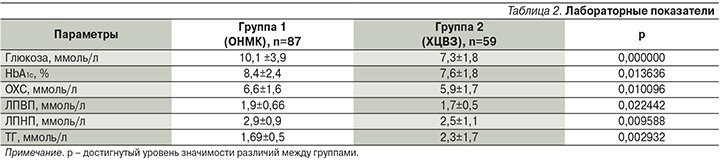
При оценке параметров углеводного и липидного обменов (табл. 2) отмечено, что развитие ИИ у больных СД2 произошло на фоне повышения уровня HbA1c в среднем до 8,4% и сопровождалось гипергликемией 10,1 ммоль/л. У пациентов с хроническими формами ЦВЗ эти показатели были значимо ниже: 7,6±1,8%; р=0,013636 и 7,3±1,8 ммоль/л; р=0,000000 соответственно (рис. 1).
При этом только 22 (25,3%) пациента с ОНМК имели значения HbA1c<7%, тогда как у большинства (65 [74,7%]) больных зарегистрирован уровень HbA1c>7%. В группе пациентов с ХЦВЗ у 29 (36,25%) больных значения HbA1c составили <7% и 51 (63,76%) пациентов имели уровень HbA1c>7%.
Показатели липидного обмена в группах значимо отличались, развитие НМК произошло на фоне повышения уровней ОХС и ЛПНП. Дислипидемия способствует повышению риска инсульта и характерна для пациентов с ИИ [20].
При оценке ассоциации показателей углеводного обмена с клиническими и лабораторными параметрами выявлены следующие взаимосвязи. Обнаружена значимая корреляция уровня HbA1c и глюкозы натощак при поступлении (r=0,5; р=0,000000) больных как ОНМК, так и группы ХЦВЗ (r=0,68; р=0,000000). Кроме того, отмечена связь уровня HbA1c и числа баллов по шкале NIHSS (r=0,3; p= 0,048915) у пациентов с ОНМК.
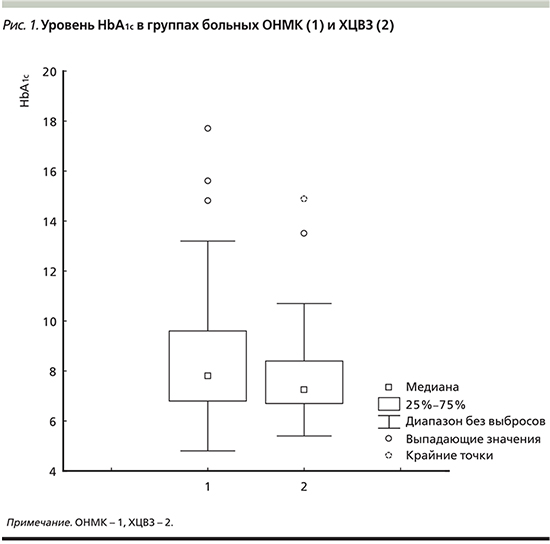
Нами не выявлено связи между уровнем HbA1c и длительностью заболевания СД у больных ХЦВЗ (r=0,09; p=0,414049), тогда как у пациентов с ОНМК обнаружена прямая зависимость между длительностью анамнеза СД и уровнем HbA1c (r=0,36; p=0,000721) (рис. 2). Для гликемии такой взаимосвязи с длительностью заболевания не получено.
Для оценки влияния длительности заболевания СД2 на течение сосудистого поражения был проведен анализ распространенности атеросклеротического поражения МАГ (по результатам ультразвукового дуплексного исследования) у пациентов обеих групп в зависимости от длительности течения СД. Проведенное исследование позволило выявить прямую зависимость между тяжестью поражения МАГ и длительностью СД2 (коэффициент корреляции Спирмена r=0,26; р=0,024213).
Обсуждение
В настоящем исследовании проведена оценка роли параметров углеводного обмена у пациентов с СД2 в реализации ИИ и развитии хронических форм ЦВЗ. Показано, что возникновению ОНМК у больных СД2 способствует неудовлетворительный гликемический контроль. Хроническая гипергликемия ассоциирована с прогрессированием атеросклеротического процесса в магистральных артериях головы. Распространенность атеросклероза брахиоцефальных артерий у больных ОНМК напрямую зависит от длительности СД2, что приводит к реализации ОНМК в основном по атеротромботическому подтипу на фоне более выраженных метаболических изменений: повышения не только гликемии в среднем до 10,1 ммоль/л, но и уровня HbA1c до 8,4%. Эти показатели отличаются у пациентов с хроническим формами ЦВЗ, у которых гликемия и уровень HbA1c повышены в меньшей степени – до 8,4 ммоль/л и 7,6%.
На сегодняшний день четко продемонстрирован вклад гипергликемии в развитие острых церебральных катастроф, однако роль качества гликемического контроля (а точнее, как показали результаты нашей работы, его отсутствия) и длительности хронической гипергликемии в реализации разных форм ЦВЗ изучены не в полной мере.
Вышеупомянутая неопределенность роли выраженности и продолжительности углеводных нарушений в развитии разных форм ишемических ЦВЗ побудила нас провести анализ гликемических и негликемических факторов, отличающих пациентов с острыми и хроническими ЦВЗ.
Как в группе с ОНМК, так и у пациентов с ХЦВЗ отмечена высокая распространенность значимого стеноза ВСА (34 и 37,5% соответственно). Такое выраженное атеросклеротическое поражение брахиоцефальных артерий находит подтверждение в результатах исследования секционных случаев ИИ с летальным исходом пациентов с СД2. Основной причиной нефатальных инфарктов в упомянутой работе стал атеростеноз артерий головного мозга [21].
В условиях длительного воздействия повышенного содержания глюкозы активизируются патогенетические механизмы, определяющие механизм развития ОНМК у больных СД2, что подтверждается выявленным в нашей работе основным патогенетическим подтипом в структуре ИИ. Преобладание атеротромботического подтипа (63%) на фоне значимой взаимосвязи распространенности сосудистого поражения с продолжительностью заболевания СД2 подчеркивает значение хронической гипергликемии для формирования условий и реализации церебральных сосудистых катастроф. Отмеченное в нашей работе развитие ЦВЗ у пациентов с длительностью СД около 5 лет совпадает с данными других источников [17]. Однако если подходить к развитию ЦВЗ как к осложнениям СД2, то следовало бы расценивать и ОНМК, и ХЦВЗ как следствие прогрессирования заболевания СД с течением времени, что очень спорно, т.к. не имеет столь очевидной причинно-следственной связи при развитии специфических диабетических микрососудистых осложнений.
Результаты нашего исследования подчеркивают негативную роль отсутствия адекватного гликемического контроля в формировании условий для как развития хронической ишемии мозга, так и возникновения острой сосудистой мозговой катастрофы. Показано, что развитие ИИ у больных СД2 происходит на фоне повышенных средних значений уровней HbA1c и глюкозы плазмы крови, находящихся в прямой зависимости. Эта взаимосвязь свидетельствует не столько о наличии острой стрессовой реакции в ответ на повреждение вещества мозга, но в большей степени говорит о плохом контроле гликемии до развития инсульта как о факторе, способствующем гипергликемии в острейшем периоде НМК. Наличие прямой зависимости повышения уровня HbA1c от длительности анамнеза СД в группе больных ОНМК говорит о важной роли своевременного достижения и длительного поддержания параметров углеводного обмена в целевом диапазоне.
При оценке таких факторов риска, как ожирение и артериальная гипертензия, отмечено, что в обеих группах больных ЦВЗ развились на фоне повышения ИМТ и при наличии у всех пациентов АГ без значимых отличий между группами, что отражает роль дополнительных факторов риска инсульта у больных СД [9]. Цереброваскулярная патология с достаточно большой частотой (42,3–55%) сочеталась с ИБС, отмеченной в обеих группах с тенденцией к преобладанию у пациентов с ОНМК. Значимо чаще у пациентов с острым инсультом выявлены нарушения ритма сердца (в 26,8 при 12,5% у пациентов с ХЦВЗ), что стало причиной развития для части (21,9%) больных кардиоэмболического инсульта. Многообразие тромбооклюзирующих процессов в церебральных артериях вносит вклад в гетерогенность ИИ [22]. Наличие выраженного атеросклероза МАГ в обеих группах пациентов ставит вопрос об ангиохирургической коррекции, показания к которой имеют пациенты с различными проявлениями ЦВЗ [23].
Заключение
Выраженность нарушений углеводного обмена у больных СД связана со степенью «остроты» ЦВЗ. Недостаточный гликемический контроль с повышением значений глюкозы до 10,1 ммоль/л и уровня HbA1c до 8,4% создает благоприятные условия для прогрессирования атеросклероза с реализацией атеротромбоза – ведущего патогенетического механизма возникновения ишемических НМК у больных СД2.


