Введение
Распространенность сахарного диабета (СД) во всем мире постоянно растет. По данным Международной диабетической федерацией, численность больных СД в мире за последние 10 лет увеличилась более чем в 2 раза.
К концу 2021 г. их число составило 537 млн, а, по прогнозам, к 2030 г. возрастет до 643 млн человек [1]. В Москве на 01.01.2023 зарегистрировано 408 тыс. больных СД. При этом на долю СД 2 типа (СД2) приходится 95% от общего числа больных. Большинство пациентов с СД2 имеют избыточную массу тела или ожирение.
СД2 – заболевание со сложными патогенетическими механизмами развития. В настоящее время выделяют 11 звеньев патогенеза СД2. Основным его компонентом является инсулинорезистентность (ИР) разной степени выраженности, которая ассоциируется с повышенной продукцией глюкозы печенью и ухудшением инсулинозависимой утилизации глюкозы на уровне мышечной и жировой тканей. Однако помимо ИР при СД2 имеется прогрессирующее снижение функциональной активности β-клеток поджелудочной железы. Известно, что уже в момент манифестации СД инсулин-секреторная способность β-клеток снижена на 50–80% и в дальнейшем прогрессивно уменьшается. Также в результате снижения секреции инсулина нарушается контррегуляторная связь на уровне островковой ткани, что приводит к неадекватно высокой секреции глюкагона α-клетками. Повышенный уровень глюкагона потенцирует гиперпродукцию глюкозы печенью.
Инкретины
В последние годы к активно изучаемым механизмам развития СД2 относится снижение секреции инкретиновых гормонов: глюкозозависимого инсулинотропного полипептида (ГИП) и глюкагоноподобного пептида-1 (ГПП-1), а также нарушение инкретинового эффекта. Инкретины отвечают за 50–70% секреции инсулина в постпрандиальном периоде здоровых людей. При СД2 воздействие инкретинов снижается и они отвечают только за 20–35% секреции инсулина после перорального употребления углеводов или смешанной пищи. Основные эффекты ГИП и ГПП-1 представлены на рис. 1.
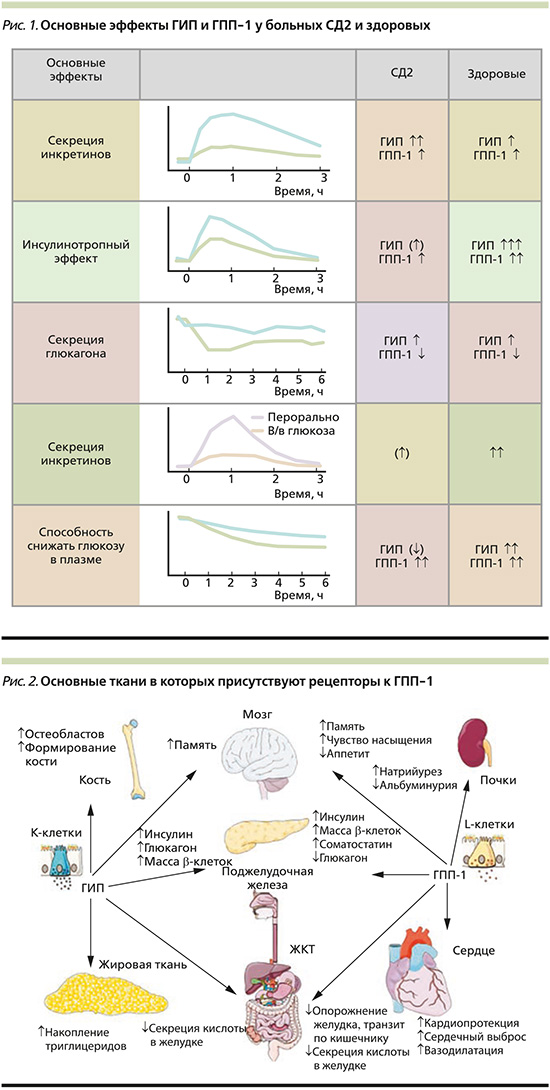
Индуцированная приемом углеводов секреция ГПП-1 зависит от массы тела, уровня глюкагона, свободных жирных кислот натощак, активности дипептидилпептидазы-4 (ДПП-4) и уровня глюкозы плазмы крови. Имеется выраженная межиндивидуальная вариабельность секреции ГИП и ГПП-1. Люди с низким уровнем ГИП также могут иметь низкий уровень ГПП-1, и наоборот. Е. Muscelli et al. впервые отметили снижение секреции ГПП-1 с увеличением индекса массы тела (ИМТ) и окружности талии [2].
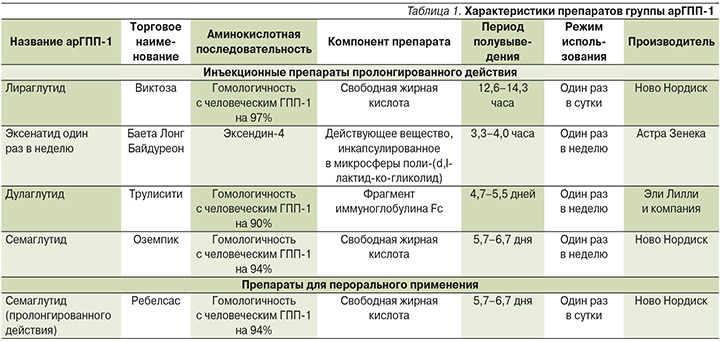
Основной точкой приложения ГПП-1 является островковая ткань поджелудочной железы (рис. 2) [3].
ГПП-1 способствует синтезу инсулина в β-клетках, что опосредуется протеинкиназой A и другими соединениями [4]. На животных моделях показано, что ГПП-1 способствует увеличению массы β-клеток, активируя их регенерацию и пролиферацию и ингибируя апоптоз. Такие результаты пока не подтверждены в исследованиях с участием людей. В исследованиях с применением агонистов рецепторов глюкагонаподобного пептида-1 (арГПП-1) отмечено замедление потери массы β-клеток, что является важным фактором в плане прогрессирующего течения СД2. Помимо β-клеток поджелудочной железы ГПП-1 воздействует на ряд других органов и тканей, где имеются рецепторы к ГПП-1 [5]. К органам-мишеням для ГПП-1 относятся кишечник, желудок, почки, сердце, легкие, периферическая и центральная нервная система, α-клетки поджелудочной железы. Кроме этого рецепторы к ГПП-1 обнаружены на адипоцитах и гепатоцитах [3].
ГПП-1 влияет на α-клетки поджелудочной железы, подавляя секрецию глюкагона.
Это приводит к снижению продукции глюкозы печенью за счет уменьшения распада гликогена и снижения синтеза глюкозы из аминокислот [6]. Секреция глюкагона регулируется непосредственно уровнем глюкозы в плазме крови и косвенно уровнем инсулина. При СД2 недостаточная секреция инсулина в ответ на повышение уровня глюкозы в плазме крови приводит к гиперглюкагонемии [3]. ГПП-1 подавляет секрецию глюкагона как натощак, так и после приема пищи.
Влияние на показатели гликемии оказывают и внепанкреатические эффекты ГПП-1, который способствует замедлению скорости эвакуации пищи из желудка, что приводит к уменьшению постпрандиальной гликемии. Угнетение моторики желудочно-кишечного тракта (ЖКТ) осуществляется через вагусную иннервацию. Действуя непосредственно на центры головного мозга, ГПП-1 усиливает чувство насыщения, а это способствует уменьшению объема потребляемой пищи. Более быстрое насыщение осуществляется также за счет механического растяжения желудка, влияния на сенсорные нейроны верхних отделов ЖКТ, изменения скорости кровотока в печеночно-воротной вене и рецепторного распознания питательных веществ. Рецепторы ГПП-1 присутствуют в центрах гипоталамуса. Гематоэнцефалический барьер в этих центрах достаточно проницаем для циркулирующего ГПП-1. ГПП-1 также синтезируется в стволе головного мозга, хотя его роль в регуляции аппетита и чувства насыщения окончательно неясна. Возможно, существуют и другие механизмы, через которые ГПП-1 влияет на центр насыщения. Эти дополнительные механизмы помогают осуществлять контроль массы тела и оказывают опосредованное действие на поддержание гомеостаза глюкозы.
В клинических исследованиях было оценено влияние ГПП-1 на сердечно-сосудистую систему. ГПП-1 повышает частоту сердечных сокращений, улучшает функцию желудочков после острой ишемии миокарда или при дилатационной кардиомиопатии. Также доказаны кардиопротективные эффекты инкретина [7].
Часть эффектов опосредована модуляцией жировой ткани внутри, вокруг сердца и его сосудов. Эпикардиальный жир приобретает фенотип бурой жировой ткани со значительным снижением синтеза и секреции местных факторов воспаления и атерогенеза [8]. Было показано, что ГПП-1 снижает риск развития сердечно-сосудистых событий [9].
ГПП-1 снижает активность факторов воспаления и модулирует иммунные реакции. Клинические исследования показали, что ГПП-1 и арГПП-1 оказывают противовоспалительное действие, воздействуя либо непосредственно на иммунные клетки, либо косвенно – через влияние на обмен веществ и снижение массы тела [7].
Как было показано в клинических исследованиях, ГПП-1 способствует снижению уровня холестерина (ХС), липопротеидов низкой плотности, повышению уровня липопротеидов высокой плотности и снижению уровня триглицеридов как натощак, так и в постпрандиальном периоде [7].
Таким образом, механизмы, которые приводят к снижению инкретинового эффекта при СД2, различны и до конца не изучены. Выявлено, что выраженность нарушений секреции ГПП-1 зависит от функциональной активности β-клеток и снижения ее чувствительности к ГПП-1, ИР, а также чувствительности периферических тканей к инсулину, является следствием этих нарушений. Установлено, что при СД2 имеется сниженный инкретиновый эффект, а ГПП-1 оказывает влияние на все основные патогенетические механизмы развития заболевания, такие как дисфункция β- и α-клеток поджелудочной железы, ИР на уровне периферических тканей, особенно на уровне печени, ускоренная эвакуация пищи из желудка, повышенный аппетит, избыточная масса тела, прогрессирующее снижение массы β-клеток.
Современные подходы к лечению СД2
Современные подходы к лечению СД2 включают достижение оптимального контроля углеводного обмена, артериального давления (АД) и липидного спектра крови; предупреждение острых осложнений, таких как гипогликемия, кетоацидоз; профилактику или замедление развития микро- и макрососудистых осложнений.
В настоящее время известно, что относительно небольшая потеря массы тела (примерно 3–7% от исходного значения) улучшает показатели гликемии, АД, липидного спектра крови и других факторов риска сердечно-сосудистых заболеваний.
Устойчивая потеря массы тела (10–15% от исходного) достигается при радикальном изменении подходов к питанию, эффективном использовании препаратов, способствующих снижению массы тела. Такие подходы дают возможность достигать улучшения контроля СД2, способствуют улучшению сердечно-сосудистых исходов и снижению смертности [10].
В исследовании Look AHEAD (Action for Health in Diabetes) у 5145 пациентов с СД2 (59% женщин, средний возраст – 58 лет, средний ИМТ – 36 кг/м2) проводилось активное вмешательство в образ жизни путем консультирования по вопросам питания, замены продуктов на более рациональные, увеличения физической активности. Это приводило к потере массы тела в среднем на 8,6%, что сопровождалось снижением уровня гликированного гемоглобина (НbА1с) и АД. Через 5 лет от начала исследования влияние питания и физической активности на массу тела и факторы сердечно-сосудистого риска были минимальным у пациентов с низкой приверженностью программе изменения образа жизни [10]. Снижения массы тела можно достигать путем изменения энергетического баланса и/или использования препаратов для терапии ожирения. Известно, что препараты из группы арГПП-1 и препараты из группы ингибиторов натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2) способствуют снижению массы тела [11, 12]. С учетом дополнительных положительных воздействий арГПП-1 на исходы сердечно-сосудистых заболеваний (ССЗ) при СД2 препараты данной группы должны применяться как средство первой линии в лечении пациентов с СД2 с избыточной массой тела или ожирением и ССЗ. Так как 80–90% пациентов с СД2 имеют избыточную массу тела или ожирение, то снижение массы тела является одним из основополагающих факторов в комплексной терапии заболевания. Ранее снижение массы тела рассматривалось в плане нормализации уровня НbА1с и снижения риска осложнений.
В настоящее время считается, что потеря массы тела на 5–15% должна быть включена в основные цели лечения больных СД2 [13]. Потеря массы тела может приносить пользу в плане не только контроля гликемии, но и снижения риска кардиометаболических заболеваний и улучшения качества жизни.
В консенсусе по ведению пациентов с гипергликемией при СД2 2023 г. уточнены подходы к назначению иНГЛТ-2 и арГПП-1 как препаратов, обладающих органопротективными свойствами (рис. 3) [14].

Выбор препаратов для терапии СД2 зависит от наличия сопутствующих заболеваний и цели лечения. Препаратом первой линии остается метформин, особенно для пациентов с избыточной массой тела. В 2016 г. были внесены изменения в инструкцию по его применению, согласно которой метформин не следует применять при расчетной скорости клубочковой фильтрации (рСКФ)<30 мл/мин 1,73 м². Также рекомендуется рассматривать возможность снижения дозы при рСКФ <45 мл/мин 1,73 м² [14]. Современные алгоритмы ADA (American Diabetes Association)/EASD (European Association for the Study of Diabetes) рекомендуют использовать арГПП-1 при неэффективности метформина или как препараты первой линии у пациентов с установленным атеросклеротическим ССЗ и у пациентов без установленного ССЗ с показателями высокого сердечно-сосудистого риска (возраст – 55 лет, стеноз сонных артерий, нижних конечностей или коронарных артерий >50%, гипертрофия левого желудочка, рСКФ<60 мл/мин 1,73 м² или альбуминурия. АрГПП-1 могут быть назначены для уменьшения риска развития гипогликемии или набора массы тела [14].
Препараты арГПП-1
В настоящее время для лечения СД2 применяют арГПП-1 пролонгированного действия: эксенатид (Баета-Лонг) 2 мг для подкожного (п/к) введения 1 раз в неделю, лираглутид (Виктоза) 0,6 мг; 1,2; 1,8 мг для п/к введения 1 раз в сутки, дулаглутид (Трулисити) 0,75; 1,5 мг 1 раз в неделю, семаглутид (Оземпик) 0,25 мг; 0,5; 1,0 мг п/к 1 раз в неделю. В настоящее время предпочтение отдается препаратам продленного действия.
Более подробная информация о препаратах представлена в табл. 1.
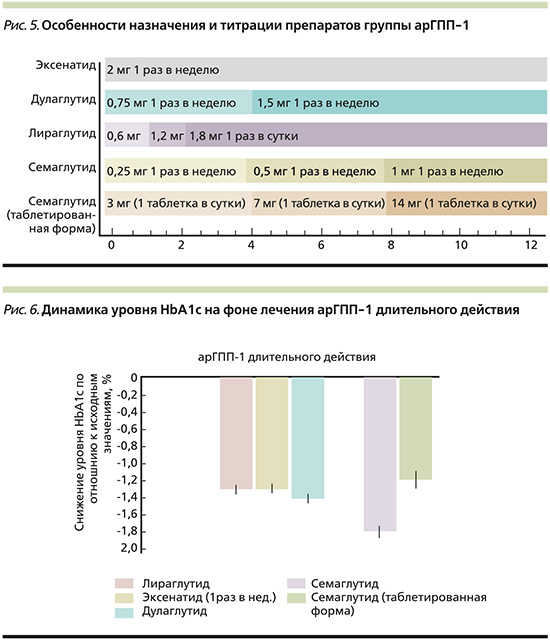
Препараты группы арГПП-1 различаются по времени достижения максимальной концентрации препарата в плазме крови после введения или перорального приема. Среди арГПП-1 пролонгированного действия у семаглутида быстрее достигается пиковая концентрация (Tmax<24 часов по отношению к дулаглутиду Тmax≥48 часов) [15]. (рис. 4).
Успех терапии пациентов СД2 зависит от правильно подобранных сахароснижающих препаратов (ССП) с использованием препаратов из группы арГПП-1. Важно не только назначать препарат, но и правильно производить его титрацию для минимизации побочных эффектов.
Рекомендации по инициации и титрации препаратов группы арГПП-1 представлены на (рис. 5). Рекомендации по титрации дозы препаратов группы арГПП-1 применимы ко всем пациентам с СД2. Терапию дулаглутидом можно начинать с введения 0,75 мг 1 раз в неделю. При достижении цели лечения можно продолжить терапию на данной дозе. Однако у дулаглутида можно инициировать терапию и с максимальной дозы с учетом времени достижения пиковой концентрации. При переходе с одного препарата на другой в пределах группы терапию начинают с максимальной дозы арГПП-1 [16]. Наиболее частыми побочными эффектами при терапии арГПП-1 являются тошнота и рвота, которые в основном возникают после начала терапии или на фоне увеличения дозы препарата. Зная пиковую концентрацию препарата в плазме крови, можно определить время максимального проявления побочных эффектов. В Москве для лечения СД2 преимущественно использовали 2 препарата из группы арГПП-1 – дулаглутид и семаглутид.
АрГПП-1 длительного действия различны между собой не только по химической структуре, но и по фармакологическим эффектам [17]. На фоне терапии арГПП-1 длительного действия отмечается постоянно повышенная концентрация препарата, приводящая к существенной стимуляции рецепторов ГПП-1 и лишь к незначительным колебаниям концентрации препарата в крови между инъекциями (например, 24-часовой период для лираглутида и недельный период для семаглутида) (табл. 2).
Разница в фармакокинетике препаратов оказывает влияние на эффективность снижения гликемии и массы тела (рис. 6) [17].
Эффективность препаратов группы арГПП-1 зависит не только от длительности действия препарата, но и от способности влиять на замедление скорости опорожнения желудка (тахифилаксия). АрГПП-1 длительного действия снижают уровень постпрандиальной гликемии в основном за счет повышения уровня инсулина и подавления синтеза глюкагона.
В настоящее время известно, что арГПП-1 через центральные и периферические механизмы снижают массу тела [17, 19]: уменьшают аппетит, объем потребляемой пищи, способствуют быстрому насыщению, ограничению калорийности рациона. Известно, что снижение массы тела коррелирует с дозой препарата [20, 21].
Были опубликованы результаты исследовании 3-й фазы по оценке эффективности и безопасности однократных еженедельных инъекций дулаглутида в дозе 3,0 и 4,5 мг по сравнению с дулаглутидом в дозе 1,5 мг в течение 52 недель (первичная конечная точка оценивалась на 36-й неделе) у пациентов с СД2 и неадекватным гликемическим контролем на монотерапии метформином. Пациенты были рандомизированы (1:1:1) на дозу 1,5 мг 1 раз в неделю (n=612), 3,0 мг (n=616) и 4,5 мг (n=614).
Исходно всем пациентам назначалась однократная еженедельная доза дулаглутида 0,75 мг с последующим поэтапным повышением дозы каждые 4 недели до рандомизированной дозы 1,5 мг; 3,0 или 4,5 мг. Показатели эффективности были проанализированы на основе полученных данных. Средний возраст пациентов составил 57,1 года, средний исходный уровень НbА1с – 8,6%, а средняя масса тела – 95,7 кг. Терапия дулаглутидом в дозе 1,5 мг; 3,0 и 4,5 мг показала достоверное снижение уровня НbА1с на 1,53%; 1,71 и 1,71% соответственно (р<0,001), массы тела – на 3,5 кг; 4,3 и 5,0 кг соответственно (р<0,001), глюкозы плазмы натощак – на 2,39 ммоль/л, 2,7 и 2,89 ммоль/л соответственно (р<0,001) на 52-й неделе по сравнению с исходным значением.
Суточная доза дулаглутида 3,0 и 4,5 мг превосходила суточную дозу 1,5 мг по первичной конечной точке на 36-й и 52-й неделях. Наиболее частыми побочными эффектами, о которых сообщалось, были тошнота, диарея и рвота. Новых данных о безопасности применения более высоких доз дулаглутида получено не было.
Таким образом, повышение дозы дулаглутида с 1,5 мг до 3,0 или 4,5 мг привело к клинически значимому, дозозависимому улучшению гликемического контроля и снижению массы тела на фоне приемлемой безопасности [22].
На животных моделях показано, что арГПП-1 подавляют активность NPY/агути-ассоциированного пептида (AgRP), продуцируемого нейронами в дугообразном ядре и индуцирующего прекращение приема пищи в латеральном парабрахиальном ядре.
Клинические исследования подтвердили способность арГПП-1 влиять на выбор продуктов питания в сторону выбора менее калорийных и более правильных [23, 24]. С помощью данных магнитно-резонансной томографии показано, что активация рецепторов ГПП-1 снижает получение удовольствия от принимаемой пищи. Таким образом, в регуляции потребления энергии участвует не только гомеостатические механизмы, но и система «вознаграждения» мозга. Это приводит к устойчивому снижению массы тела в среднем на 2–7 кг [25].
В исследованиях отмечено, что на массу тела влияют более высокие дозы препаратов: для лираглутида одобрены суточные дозы до 3,0 мг (1,8 мг – максимальная терапевтическая доза для лечения СД2) [26]. В клинических испытаниях семаглутид тестировался в дозе до 0,4 мг/сут (что соответствует 2,8 мг в отличие от 1,0 мг в неделю при СД2) [27], дулаглутид – в дозе 3,0 и 4,5 мг в неделю [22]. Терапию арГПП-1 нельзя прерывать после достигнутого снижения массы тела. Если лечение прекратить, то масса тела возвращается или приближается к исходным значениям в течение нескольких месяцев [28].
Было отмечено, что индивидуальная реакция на снижение массы тела пациентов с СД2, получавших арГПП-1, более вариабельна, чем снижение уровня НbА1с [29]. Некоторые пациенты вообще не снижают массу тела при лечении арГПП-1, в то время как другие снижают ее значительно.
H. Schlogl et al. [30] исследовали пациентов, ответивших и не ответивших на терапию арГПП-1, и обнаружили гипоталамические эффекты только у ответивших. Авторы предположили, что это может быть результатом генетического полиморфизма в отношении рецепторов ГПП-1 или других компонентов, участвующих в передаче сигнала.
Пациенты с ожирением и СД2 часто пробуют использовать различные диетические подходы, чтобы снизить массу тела, но не достигают результата. Есть когорта пациентов, которые рассчитывают на то, что препарат приведет к снижению массы тела без ограничения потребления калорий и расширения физической активности. Такие подходы не приводят к результату. В связи с этим целесообразно разработать специальную программу обучения пациентов с СД2 и ожирением, направленную на оптимизацию снижения массы тела на терапии арГПП-1 [27].
Побочные эффекты при использовании арГПП-1
К наиболее обсуждаемым побочным эффектам, о которых чаще всего сообщают при использовании арГПП-1, относятся тошнота, рвота и диарея. Они часто возникают в начале лечения препаратами из группы арГПП-1 или после увеличения дозы (например, во время титрования). Вероятно, это связано с прямым взаимодействием с рецепторами центральной нервной системы арГПП-1, которые скорее всего расположены в стволе головного мозга (область постремы). Тошнота обычно отмечается у 25% пациентов, а рвота или диарея – у 10%, получающих арГПП-1 [17, 32]. Для большинства пациентов это короткие, проходящие эпизоды, которые прекращались спонтанно даже при продолжении лечения. Время наступления симптомов, вероятно, связано со временем максимальной концентрации препарата. Использование поэтапной схемы титрации препаратов позволяет избегать данных побочных эффектов. Однако существует определенное число пациентов, которые не переносят арГПП-1 [32]. Чувствительность пациентов к развитию побочных эффектов со стороны ЖКТ неоднородна. Некоторые пациенты плохо переносят низкие дозы арГПП-1, в то время как другие – высокие дозы [26, 27]. Частота тошноты, рвоты и диареи, как правило, ниже у японцев, чем у европеоидов. Это позволяет предположить, что особенности пищевого поведения также могут оказывать свое влияние [33]. В исследовании REWIND показано, что только 9,1% (по отношению к семаглутиду 13,3%) пациентов прекратили прием препарата из-за побочных эффектов [34].
Активно обсуждаются такие побочные эффекты, как острый панкреатит, рак поджелудочной и рак щитовидной желез. Анализ больших баз данных рандомизированных исследований, в которых панкреатит, рак поджелудочной и рак щитовидной желез определялись как «побочные эффекты», не выявил повышенного риска этих побочных эффектов для пациентов на фоне терапии арГПП-1 [35]. В ретроспективом анализе отмечали повышение активности амилазы и/или липазы на фоне терапии арГПП-1, что могло косвенно указывать на панкреатит. Поскольку для постановки диагноза достаточно двух диагностических критериев, панкреатит может быть диагностирован даже в отсутствие результатов визуализации, подтверждающих этот диагноз [36]. Тем не менее С-клетки щитовидной железы экспрессируют рецепторы ГПП-1 и пациенты с очень высоким риском развития медуллярного рака щитовидной железы (например, на основании данных анамнеза или генетического тестирования) не должны получать терапию арГПП-1.
Рекомендации ESC по применению препаратов арГПП-1
Руководство ESC (European Society of Cardiology) рекомендует арГПП-1 в качестве терапии первой линии пациентам с установленным атеросклеротическим ССЗ или лицам с высоким или очень высоким риском (с тремя или более основными факторами риска или длительностью СД 10 лет без повреждения органов-мишеней плюс любые другие дополнительные факторы риска) [37]. Согласно этим международным рекомендациям, от 30 до 60% пациентов с СД2 должны получать арГПП-1. Однако в реальной клинической практике доля пациентов, получающих лечение арГПП-1, остается низкой и колеблется от 1 до 10% в разных странах [38]. Причины этого очевидного разрыва между рекомендациями руководства и реальной клинической практики следующие: 1) стоимость лечения арГПП-1 значительно выше, чем для большинства пероральных ССП, но сопоставима со стоимостью терапии инсулином (включая затраты на мониторинг уровня глюкозы). Различные анализы экономической эффективности показали, что преимущества, связанные с лечением арГПП-1, перевешивают прямые затраты на лечение [39]. Однако цена доступного в настоящее время арГПП-1 остается серьезным препятствием в большинстве стран; 2) необходимость ежедневных или еженедельных инъекций служит определенной преградой для некоторых пациентов с СД2; 3) противопоказания (например, панкреатит в анамнезе, диабетическая ретинопатия или медуллярный рак щитовидной железы) могут ограничивать сферу применения арГПП-1; 4) побочные эффекты со стороны ЖКТ также остаются лимитирующим фактором.
Использование современных ССП в терапии СД2
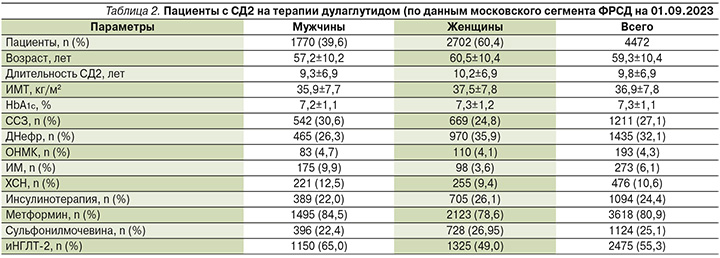
Реальная клиническая практика терапии больных СД2 в Москве демонстрирует значимые изменения в подходах к выбору ССП. По данным московского сегмента Федерального регистра сахарного диабета (ФРСД), с каждым годом все более активно в терапии СД2 применяются современные неинсулиновые препараты: арГПП-1, иДПП-4, иНГЛТ-2. Так, в 2023 г. почти половина больных СД2 в Москве получают как минимум 1 препарат из этих классов (рис. 7). На протяжении длительного времени самой используемой группой новых препаратов были иДПП-4. Но, в начале 2021 г. отмечен значительный рост использования препаратов из класса иНГЛТ-2, которые по числу пациентов опередили препараты из группы иДПП-4 и до настоящего времени сохраняют лидирующие позиции среди всех препаратов новых классов. Одновременно с 2011 г. был отмечен значительный рост использования препаратов из группы арГПП-1. За период с 2020 по II кв. 2023 г. доля использования препаратов данного класса среди больных СД2 выросла более чем в 4 раза (с 0,7 до 3,0%) (рис. 7). Наиболее выраженная динамика прироста числа пациентов, получающих препараты из группы арГПП-1, отмечается среди больных, получающих дулаглутид. Число таких пациентов выросло с 2017 г. по 2 кв. 2023 г. с 6 до 4383 человек (рис. 8).
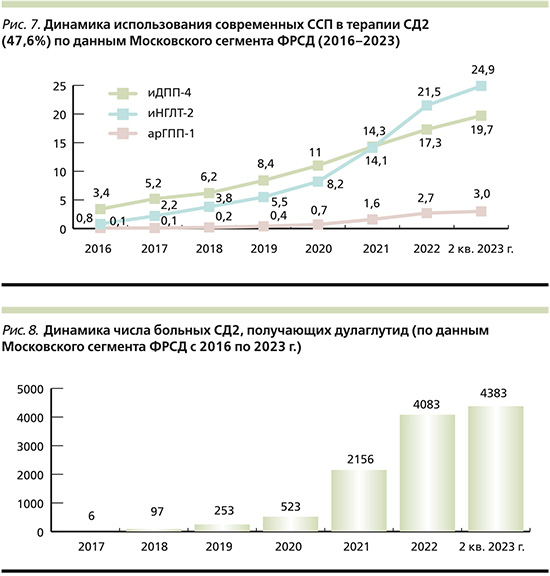
При анализе медицинских данных пациентов с СД2 московского сегмента ФРСД, получающих дулаглутид, на 01.09.2023 продемонстрировано, что препарат чаще использовали женщины (60,4%), а также пациенты моложе 60 лет с длительностью СД2 9–10 лет. На протяжении многих лет использования в терапии московской популяции пациентов с СД2 препаратов из группы арГПП-1 отмечено, что они чаще всего назначаются пациентам с выраженным ожирением. Это подтверждается и результатами проведенного нами анализа. Средний показатель ИМТ у больных СД2, получающих дулаглутид, составил 36,9%. При этом средний уровень НbА1с у данных пациентов составил 7,3%, что говорит о контроле углеводного обмена, близком к целевым показателям для данной возрастной категории пациентов.
При анализе распространенности осложнений СД2 у пациентов, получающих дулаглутид, отмечено, что более 30% мужчин и 25% женщин имели указания в ФРСД на наличие ССЗ. При этом распространенность инфаркта миокарда (ИМ) среди мужчин была в 3 раза выше, чем среди женщин, при сопоставимой распространенности острого нарушения мозгового крово-обращения (ОНМК) (табл. 2).
Анализ сахароснижающей терапии пациентов данной когорты демонстрирует, что более 80% пациентов получают метформин и около 25% – препараты сульфонилмочевины (в целом по группе больных СД2 препараты сульфонилмочевины используются более чем в 40% случаев). Обращает на себя внимание высокая (55,3%) доля использования в комбинации ССП иНГЛТ-2 (табл. 2).
Вызывает большой интерес эффективность использования дулаглутида в контроле показателей углеводного обмена и массы тела в динамике на протяжении длительного периода времени. С целью оценки этого показателя проведен анализ данных больных СД2, начавших терапию дулаглутидом в 2018 г. В выборки из московского сегмента ФРСД включались пациенты, начавшие терапию дулаглутидом в 2018 г., для которых дулаглутид стал первым препаратом из класса арГПП-1, и получавшие данный препарат на протяжении всего периода наблюдения (2018–01.09.2023); пациенты, имевшие информацию об уровне НbА1с и динамике массы тела за период наблюдения (2018–01.09.2023).
Критериям включения в данный анализ соответствовали 49 человек (20 мужчин и 29 женщин). На момент старта терапии дулаглутидом (2018 г.) пациенты имели средний возраст 56,0±9,9 года и длительность СД2 около 10 лет. ИМТ составлял 35,6 кг/м2.
Средний уровень НbА1с на момент старта терапии дулаглутидом составлял 7,3%, АД –130/80 мм рт.ст.
Абсолютное большинство пациентов получали метформин (90,0%), менее 30% – препараты сульфонилмочевины, на инсулинотерапии были 39,0% пациентов. Данная когорта пациентов также характеризовалась высокой частотой использования иНГЛТ-2 (61,0%). У 40,8% больных СД2 данной когорты отмечено наличие ССЗ, из которых чаще всего встречались ишемическая болезнь сердца (20,4%) и хроническая сердечная недостаточность – ХСН (12,2%). ОНМК в анамнезе отмечалось у 6,1%, ИМ – у 4,1% пациентов (табл. 2).
При оценке динамики показателей контроля углеводного обмена более чем за 5-летний период наблюдения (2018–01.09.2023) отмечена тенденция к снижению уровня НbА1с с 7,3 до 7,1% (p>0,05). При этом в подгруппе пациентов, не получавших инсулинотерапии, продемонстрировано статистически значимое снижение уровня НbА1с – с 7,3 до 6,6% (p=0,04). В подгруппе пациентов на инсулинотерапии отмечена тенденция к повышению уровня НbА1с с 7,5 до 7,7% (p>0,05) (рис. 9).
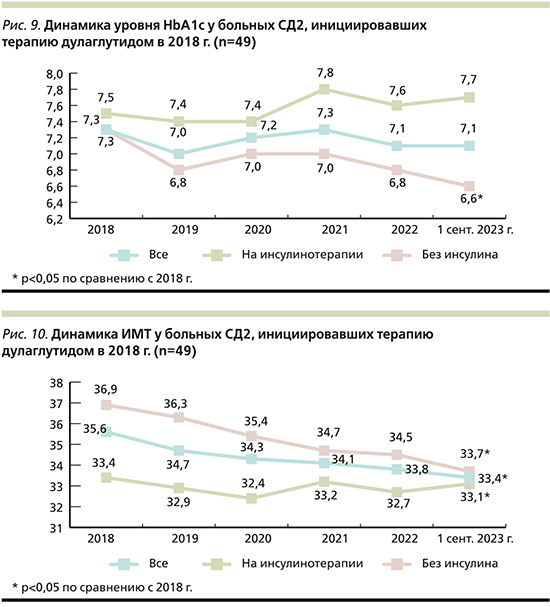
При оценке динамики ИМТ зарегистрировано статистически значимое снижение данного показателя с 35,6 до 33,4 кг/м2 (p<0,05) за период наблюдения (2018–01.09.2023), в первую очередь за счет пациентов, не получавших терапию препаратами инсулина (p<0,05).
Не было отмечено статистически значимых различий в динамике массы тела пациентов на инсулинотерапии (рис. 10).
Заключение
Современные подходы к лечению СД2 рекомендуют использовать арГПП-1 на начальных этапах терапии при наличии у пациентов атеросклеротических ССЗ, сердечной недостаточности, хронической болезни почек или факторов риска атеросклеротических ССЗ, ожирения независимо от уровня НbА1с.
Больные СД2 с высоким риском развития инсульта или хронической болезни почек и выраженной протеинурией, ожирением будут иметь максимальные преимущества при использовании препаратов группы арГПП-1.
Использование дулаглутида в реальной клинической практике демонстрирует длительное удержание показателей гликемического контроля в рамках целевых значений или близко к ним. При этом большая эффективность в достижении показателей гликемического контроля была продемонстрирована в когорте больных СД2, не получавших инсулино-терапии.
При использовании дулаглутида в реальной клинической практике у больных СД2 отмечается выраженная тенденция к снижению массы тела, которая носит статистически значимый характер у пациентов, не получавших инсулинотерапию.
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы Анциферовой Дарьи Михайловны: «Коррекция липотоксичности агонистами рецепторов глюкагоноподобного пептида -1 у пациентов с сахарным диабетом 2 типа».


