Введение
Глобальной проблемой современного здравоохранения является высокое распространение т.н. неинфекционных заболеваний (НИЗ). Ежегодно от них умирают более 40 млн человек. При этом 81% случаев смерти приходится на 4 группы заболеваний:
- Сердечно-сосудистые заболевания (инфаркт миокарда, инсульт и др.) служат основной причиной смерти от НИЗ – 17,7 млн человек ежегодно.
- Онкологические заболевания – 8,8 млн человек.
- Хронические респираторные болезни (хроническая обструктивная болезнь легких и бронхиальная астма) – 3,9 млн человек.
- Сахарный диабет – 1,6 млн человек [1, 2].
Ожирение как фактор риска НИЗ
Выявление модифицируемых факторов риска развития НИЗ и своевременная их коррекция должны лежать в основе комплексного подхода к решению рассматриваемой проблемы. Среди доказанных факторов риска развития НИЗ и смертности от них особую роль занимает ожирение, имеющее хронический рецидивирующий характер течения и высокую распространенность среди всех слоев населения независимо от пола и возраста. По данным многоцентрового (11 регионов РФ) наблюдательного исследования ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации) с участием 25 224 человек в возрасте 25–64 лет, распространенность ожирения в популяции составила 29,7% [3]. Причем с 2011 по 2015 г. заболеваемость ожирением среди взрослого населения возросла в 2,3 раза, а частота впервые поставленного диагноза с 2010 по 2016 г. возросла на 98,1% [4].
Роль ожирения как фактора риска хронических НИЗ рассматривается многими авторами [5–7]. Причинами формирования хронических НИЗ при ожирении являются наблюдаемое преимущественно при висцеральном ожирении хроническое воспаление; повышенное образование свободных жирных кислот, приводящее к липотоксичности; развитие резистентности к инсулину и ассоциированной гиперинсулинемии/глюкозотоксичности; избыток адипокинов и повышенная активность ароматазы, определяющие гормональные нарушения репродуктивной сферы; активация ренин-ангиотензин-альдостероновая системы (РААС) и другие факторы, связанные с накоплением избытка жировой ткани. Перечисленные патологические процессы в организме индуцируют развитие широкого спектра соматических заболеваний и состояний, значительно ухудшающих качество жизни больного и прогноз (рис. 1).
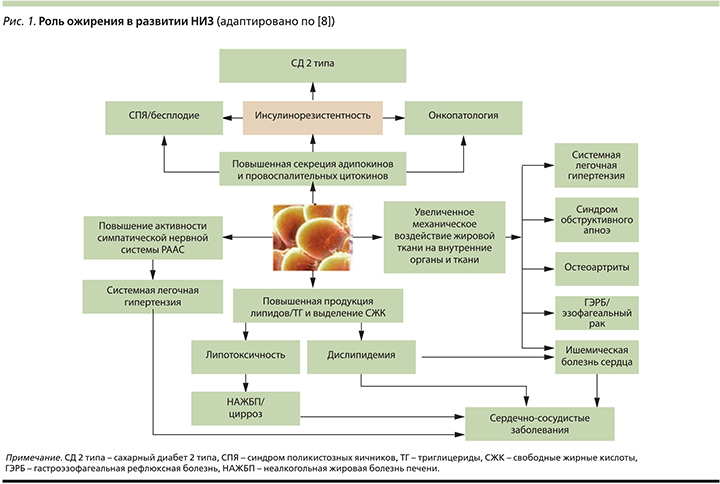
На сегодня к ассоциированным с ожирением заболеваниям относят более 10 нозологий, таких как СД2, сердечно-сосудистые и онкологические заболевания, синдром поликистозных яичников, синдром обструктивного апноэ и многие другие, но, несомненно, лидирующее положение занимают заболевания сердечно-сосудистой системы и СД2 [8].
В ряде исследований была доказана линейная зависимость между возрастанием массы тела и выраженностью артериальной гипертензии (АГ) [9, 10]. По материалам исследования ЭССЕ-РФ, частота АГ у лиц с абдоминальным ожирением в 2 раза превосходит таковую у лиц с нормальной массой тела, а у пациентов с ожирением градиентно возрастает с увеличением степени ожирения [11]. Патогенез развития АГ при ожирении многофакторный, включающий повышение активности РААС, задержку натрия в организме, нарушение эластичности сосудистой в стенке в условиях инсулинорезистентности. Одним из механизмов развития АГ при ожирении является увеличение тонуса симпатической нервной системы.
Lim S. et al. показали, что это достигается воздействием лептина и инсулина на гипоталамус [8, 12]. Связанный с этим повышенный тонус симпатической нервной системы способствует формированию и прогрессированию АГ, что дополнительно осложняет контроль АД [13].
Сахарный диабет 2 типа и ожирение
Хорошо известно, что ожирение и СД2 являются взаимосвязанными эпидемиями. При этом среди пациентов с ожирением повышается риск развития не только ранних нарушений углеводного обмена, но и СД2. В рамках национального эпидемиологического кросс-секционного исследования NATION, которое проводилось в 8 федеральных округах Российской Федерации, 63 регионах и 188 населенных пунктах с сентября 2013 по февраль 2015 г. были полученные данные, указывающие на значительное увеличение распространенности нарушений углеводного обмена у лиц с ожирением по сравнению с лицами с нормальной массой тела (p<0,001). Число участников с предиабетом и СД2 увеличивалось по мере возрастания индекса массы тела (ИМТ): при наличии ожирения по сравнению с лицами с нормальной массой тела доля предиабета возрастала в 4,5, а доля СД2 – в 11 раз [14]. В других исследованиях показано, что повышение ИМТ на 1 кг/м2 увеличивает риски развития СД2 на 12,1% [15].
Наличие СД2 у пациента в свою очередь служит фактором риска развития сердечно-сосудистых осложнений. Так, развитие СД2 способствует повышению риска инфаркта и инсульта в 4–6 раз, в целом более 80% причин смерти при СД2 обусловлены макроангиопатией [16, 17].
Лечение ожирения
В настоящее время доказано, что терапия ожирения может замедлить развитие предиабета [18, 19] и являться одним из ключевых факторов в лечении СД2. Так, некоторые исследования показали, что снижение массы тела на 10% сокращает риск развития СД2 в будущем на 80% [20]. В последних стандартах медицинской помощи больным СД2, подготовленных Американской диабетической ассоциацией, пациентам с предиабетом рекомендуется снижение массы тела на 7%, поскольку этот результат доказанно уменьшает риск развития диабета. Причем этим данным присвоен уровень доказательности А [21].
У пациентов с СД2 и ожирением небольшое и устойчивое снижение массы тела приводит к улучшению гликемического контроля и снижению доз сахароснижающих препаратов [16, 22, 23]. По данным исследования DiRECT, снижение массы тела способствовало достижению ремиссии СД2, которая верифицировалась по уровню гликозилированного гемоглобина (HbA1c) менее 6,5% в течение как минимум 2 месяцев после отмены антидиабетических препаратов, у 46% участников программы. А в группе пациентов, снизивших вес на 15 кг и более, доля лиц, достигших ремиссии, составила 86% [24]. Лечение ожирения также сопровождается улучшением различных метаболических параметров: снижением систолического и диастолического АД, уменьшением уровней общего холестерина, триглицеридов и холестерина липопротеидов низкой плотности; повышением концентрации липопротеидов высокой плотности; снижением выраженности стеатоза (фиброза) печени, гирсутизма; восстановлением менструального цикла и др. Таким образом, снижение массы тела считается критически важным для повышения эффективности терапии и улучшения прогноза течения ассоциированных заболеваний [25].
Наряду с изменением образа жизни фармакотерапия является неотъемлемым этапом программы ведения больных ожирением. Назначение фармакологических препаратов для лечения ожирения рекомендуется при ИМТ≥30 кг/м2 или при наличии ассоциированных с ожирением заболеваний у пациентов с ИМТ 27–29,9 кг/м2 [26].
В настоящее время на территории Российской Федерации зарегистрированы следующие препараты для лечения ожирения:
- Препараты, влияющие на способность организма усваивать из пищи определенные питательные вещества, – орлистат.
- Препараты центрального действия, влияющие на пищевое поведение, – сибутрамин.
- Аналоги человеческого глюкагоноподобного пептида-1 – лираглутид.
На сегодня, как известно, нарушения пищевого поведения занимают лидирующее значение в патогенезе ожирения. По данным нашего эпидемиологического исследования, вклад нарушений пищевого поведения в формирование ожирения составил 47,3% в суммарной доле таких факторов, как низкая физическая активность (30,8%), наследственная предрасположенность (10,5%) и возраст (11,5%) [27].
Отличительной особенностью терапии сибутраминсодержащими препаратами является положительное влияние на модификацию пищевого поведения, что способствует сохранению достигнутых результатов снижения массы тела. Так, показано, что через 8 месяцев после отмены терапии сибутрамином 79% пациентов сохранили сниженную массу тела. Сибутрамин и его метаболиты не влияют на высвобождение моноаминов, не ингибируют моноаминооксидазу (МАО), не обладают сродством к большому числу нейромедиаторных рецепторов, поэтому не вызывают привыкания, лекарственной зависимости и синдрома отмены, а следовательно, сибутрамин не снижает своей терапевтической эффективности на протяжении всего курса лечения [28–30].
Исследования, посвященные проблеме ожирения. Роль сибутраминсодержащих препаратов
В России с 2011 г. было проведено 3 масштабные наблюдательные программы, посвященные проблеме ожирения, с участием более 135 тыс. пациентов, позволивших реализовать принципы активного мониторинга эффективности и безопасности применения сибутрамина (Редуксин®, Редуксин®Мет, ПРОМОМЕД, Россия) в существующей клинической практике и сформировать у врачей навыки обоснованного назначения лекарственных препаратов для снижения массы тела.
В рамках Всероссийской наблюдательной программы «Весна», которая проводилась в 2011–2012 гг. (n=34 719), было показано, что применение препарата в течение 6 месяцев приводит к клинически значимому снижению массы тела и уменьшению окружности талии, что обеспечило положительную динамику показателей липидного обмена и гликемического контроля. Шестимесячный курс приема Редуксина позволил пациентам научиться контролировать объем потребляемой пищи, выработать правильные привычки питания и снизить калорийность суточного рациона [31].
Наблюдательная программа «ПримаВера», проведенная в 2012–2015 гг. под руководством Эндокринологического научного центра и Российской ассоциации эндокринологов, ставила своей целью изучить эффективность и безопасность применения Редуксина у большой разноплановой популяции пациентов в рамках рутинной клинической практики врачей различных специальностей. В итоге в программе приняли участие почти 100 тыс. пациентов, наблюдавшихся у 3095 врачей из 142 городов нашей страны. Среди указанной выборки 13 167 человек страдали СД2. Длительность применения составила от 3 до 12 месяцев. Ответ на терапию, т.е. снижение массы тела на 5% от исходной в течение 3 месяцев терапии, продемонстрировали 92,4% пациентов. Более длительная терапия (в течение 12 месяцев) позволила добиться снижения массы тела более 10% у 94,2% пациентов, включая больных СД2. При тщательном анализе динамики показателей сердечно-сосудистой системы и частоты развития побочных эффектов было показано, что длительная терапия Редуксином характеризуется благоприятным профилем безопасности даже у пациентов с высоким риском развития побочных эффектов (пациенты с СД2, метаболическим синдромом, с контролируемой АГ), но не имевших противопоказаний. Отметим, что частота возникновения побочных эффектов была незначительной и не превысила 3,2% [32].
Таким образом, в рамках широкомасштабного изучения применения Редуксина в рутинной клинической практике врачей различных специальностей было подтверждено, что польза от терапии превышает возможные риски [33].
В рамках терапии пациентов с нарушениями углеводного обмена на фоне ожирения обоснованной считается комбинация сибутрамина с метформином, которая обеспечивает синергетическое действие компонентов и возможность воздействия на различные аспекты нарушений углеводного обмена, способствующая наряду со снижением массы тела (в среднем на 11,5 кг за полгода) улучшению показателей углеводного обмена (снижение уровня HbA1c на 0,5%) и липидного спектра крови [34, 35].
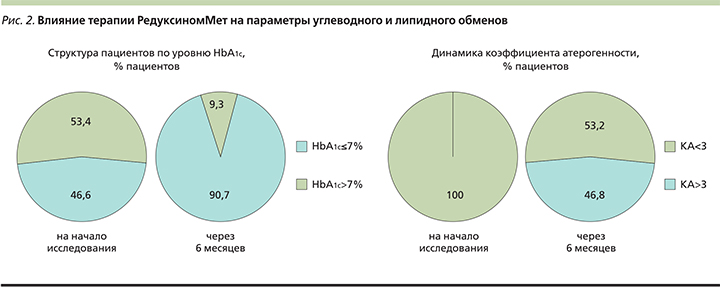
С ноября 2017 г. единственным лекарственным средством, зарегистрированным в Российской Федерации для снижения массы тела у пациентов с алиментарным ожирением и преддиабетом с дополнительными факторами риска развития СД2, которым изменение образа жизни не позволило достичь адекватного контроля гликемии, является препарат Редуксин®Мет. Препарат представляет собой нефиксированную комбинацию Редуксина (дозировка сибутрамина – 10 или 15 мг) и метформина (дозировка – 850 мг) в одной упаковке. Целесообразность использования препарата в комплексной терапии пациентов с СД2 была изучена в рамках наблюдательной программы «АВРОРА», которая проводилась в 2016–2018 гг. и включала 5 812 пациентов. Было показано, что включение препарата Редуксин®Мет в терапию пациентов с СД2 и ожирением помимо эффективного снижения массы тела оказывает положительное влияние на углеводный и липидный обмены, способствуя дополнительному снижению уровня HbA1c вплоть до достижения целевых значений и нормализации коэфициента атерогенности (КА) более чем у 50% пациентов (рис. 2). В целом, по результатам программы «АВРОРА» был сделан вывод, согласно которому Редуксин®Мет обеспечивает длительный метаболический контроль СД2 и способствует снижению риска развития осложнений [36].
Обобщенные результаты применения сибутраминсодержащих препаратов в широкомасштабных наблюдательных исследованиях в реальной клинической практике показывают, что подобная терапия позволяет достигать клинически значимого снижения массы тела и уменьшения окружности талии у пациентов без противопоказаний вне зависимости от пола, возраста и наличия сопутствующих заболеваний. Причем эффективность терапии пропорциональна длительности лечения (рис. 3).

Заключение
Таким образом, убедительно доказано, что применение препаратов Редуксин® и Редуксин®Мет пациентами без противопоказаний является эффективным и безопасным вне зависимости от наличия полиморбидной патологии и приема различной сопутствующей терапии.
Полученные в ходе наблюдательных программ данные должны помочь врачу при реализации персонифицированного подхода к ведению пациентов, что позволит более эффективно бороться с эпидемией ожирения и СД2, снизить бремя ассоциированных с рассматриваемой патологией НИЗ и улучшить качество жизни больных.



