Введение
В настоящее время для достижения компенсации пациентов с сахарным диабетом (СД) имеется полный арсенал лекарственных средств. Однако, несмотря на большое число групп препаратов для лечения диабета, самым эффективным («золотым») остается инсулин. Его открытие – одно из наиболее значимых событий в медицине и фармакологии, что подтверждается тремя нобелевскими премиями, присужденными за работу с молекулой инсулина. Совсем скоро медицинская общественность отметит 100-летний юбилей со дня создания этого уникального препарата.
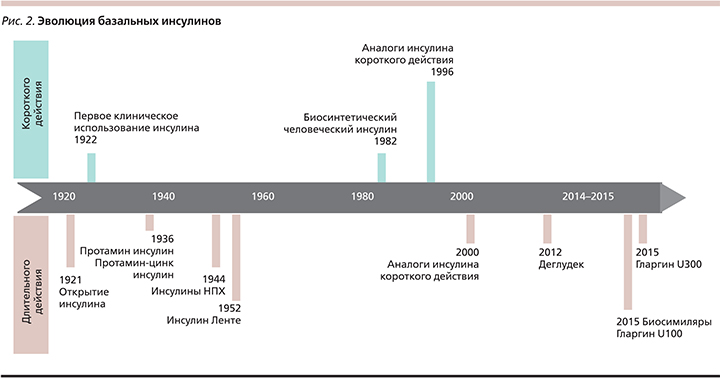
 История инсулина – это история достижений медицины. Открытие инсулина определило кардинально новый подход к лечению СД. От момента открытия препарата до начала его промышленного производства и клинического использования прошло всего 2 года. Первая инъекция инсулина человеку была сделана 11 января 1922 г., им стал 14-летний подросток с СД 1 типа (СД1). С того момента началась грандиозная эра инсулиновой терапии. Можно выделить следующие значимые вехи в развитии инсулинотерапии: выделение инсулина в 1921 г., использование животного (бычьего) инсулина в 1922 г. (рис. 1), создание протамина-цинк-инсулина в 1936 г., нейтрального протамина Хагедорна в 1946 г. и инсулина Ленте в 1952 г., использование рекомбинантных технологий для синтеза генно-инженерных человеческих инсулинов в 1977 г. [1–3]. Появление технологии рекомбинантной ДНК в 1980-х гг. позволило изменить молекулярную структуру инсулина и модифицировать те области взаимодействия лиганд-рецептор, которые оставались неизменными при использовании «человеческих инсулинов» [4]. Первое поколение базальных инсулинов было достаточно далеко от физиологического профиля инсулина. Фармакокинетический профиль инсулина НПХ (нейтральный протамин Хагедорна) достигал максимума через 6–10 часов после инъекции с последующим устойчивым его снижением [5]. Скорость абсорбции инсулина НПХ постоянно изменяется во времени и создает малопредсказуемые фармакокинетические профили, повышая риск развития гипогликемических эпизодов, прежде всего ночных гипогликемий [6]. Новой эрой в инсулинотерапии стала разработка в 1990-е гг. аналогов инсулина быстрого действия и базальных аналогов в начале 2000-х (рис. 2). Первым базальным аналогом стал инсулин гларгин, созданный в 2000 г., вслед за которым в 2005 г. был разработан инсулин детемир. Несмотря на значительный прогресс, достигнутый в понимании фармакокинетики, фармакодинамики и механизмов действия инсулина, до настоящего времени актуальными остаются вопросы, связанные с отсутствием полной имитации профиля эндогенного инсулина. Инсулины длительного действия – наиболее используемые препараты инсулина в клинической практике, что связано с массой пациентов с СД 2 типа (СД2) в популяции и необходимости назначения им инсулинотерапии через несколько лет от момента установления диагноза. Именно базальные инсулины становятся стартовыми при назначении инсулина пациентам с СД2 [7].
История инсулина – это история достижений медицины. Открытие инсулина определило кардинально новый подход к лечению СД. От момента открытия препарата до начала его промышленного производства и клинического использования прошло всего 2 года. Первая инъекция инсулина человеку была сделана 11 января 1922 г., им стал 14-летний подросток с СД 1 типа (СД1). С того момента началась грандиозная эра инсулиновой терапии. Можно выделить следующие значимые вехи в развитии инсулинотерапии: выделение инсулина в 1921 г., использование животного (бычьего) инсулина в 1922 г. (рис. 1), создание протамина-цинк-инсулина в 1936 г., нейтрального протамина Хагедорна в 1946 г. и инсулина Ленте в 1952 г., использование рекомбинантных технологий для синтеза генно-инженерных человеческих инсулинов в 1977 г. [1–3]. Появление технологии рекомбинантной ДНК в 1980-х гг. позволило изменить молекулярную структуру инсулина и модифицировать те области взаимодействия лиганд-рецептор, которые оставались неизменными при использовании «человеческих инсулинов» [4]. Первое поколение базальных инсулинов было достаточно далеко от физиологического профиля инсулина. Фармакокинетический профиль инсулина НПХ (нейтральный протамин Хагедорна) достигал максимума через 6–10 часов после инъекции с последующим устойчивым его снижением [5]. Скорость абсорбции инсулина НПХ постоянно изменяется во времени и создает малопредсказуемые фармакокинетические профили, повышая риск развития гипогликемических эпизодов, прежде всего ночных гипогликемий [6]. Новой эрой в инсулинотерапии стала разработка в 1990-е гг. аналогов инсулина быстрого действия и базальных аналогов в начале 2000-х (рис. 2). Первым базальным аналогом стал инсулин гларгин, созданный в 2000 г., вслед за которым в 2005 г. был разработан инсулин детемир. Несмотря на значительный прогресс, достигнутый в понимании фармакокинетики, фармакодинамики и механизмов действия инсулина, до настоящего времени актуальными остаются вопросы, связанные с отсутствием полной имитации профиля эндогенного инсулина. Инсулины длительного действия – наиболее используемые препараты инсулина в клинической практике, что связано с массой пациентов с СД 2 типа (СД2) в популяции и необходимости назначения им инсулинотерапии через несколько лет от момента установления диагноза. Именно базальные инсулины становятся стартовыми при назначении инсулина пациентам с СД2 [7].
К основным целям терапии СД относятся достижение и поддержание целевых значений гликемии, необходимые для профилактики поздних осложнений диабета и низкого риска гипогликемий [8]. Результаты популяционных исследований свидетельствуют о том, что гипогликемии служат наиболее значимым фактором, препятствующим достижению адекватного гликемического контроля, и значительно ухудшают качество жизни пациентов [9]. Традиционные препараты человеческого инсулина имеют вариабельность абсорбции, значительные различия фармакодинамического эффекта, определяющие отсутствие достижения стабильного и продолжительного уровня инсулина плазмы. Вариабельность действия инсулинов вызывает значительные колебания гликемии и вероятность развития гипогликемических состояний.
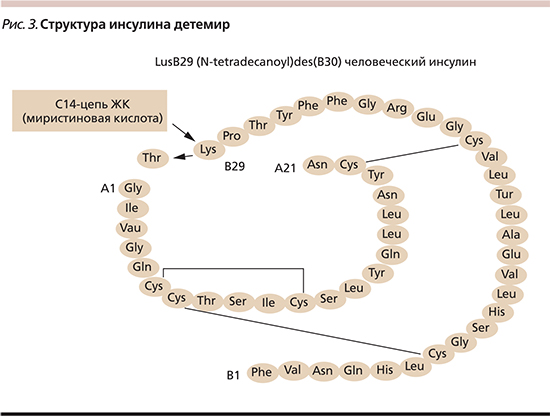
С целью решения указанных проблем создан аналог инсулина длительного действия, обладающий рядом отличительных свойств и имеющий пролонгированный эффект, – инсулин детемир. Инсулин детемир (Левемир®) – нейтральный, растворимый базальный аналог человеческого инсулина пролонгированного действия с плоским профилем действия, который производится методом биотехнологии рекомбинантной ДНК с использованием штамма Saccharomyces cerevisiae. Инсулин детемир обеспечивает воспроизведение, близкое к базальному физиологическому инсулиновому профилю, что дает преимущества в виде более предсказуемого профиля действия по сравнению с инсулином НПХ [10]. Молекулярная структура инсулина детемир отличается от структуры человеческого инсулина отсутствием треонина в положении B30 и присоединением к лизину в положении B29 миристиновой кислоты (жирнокислотного остатка из 14 атомов углерода – С14; рис. 3). Такое строение молекулы позволило получить инсулиновый аналог, который остается в растворенном состоянии после произведенной инъекции. Молекулы инсулина детемир в готовом растворе соединены в гексамеры. При попадании инсулина детемир в интерстициальную жидкость подкожно-жировой клетчатки происходит самоассоциация гексамеров с формированием дигексамеров за счет контакта между цепями жирных кислот молекул инсулина [10], а также связывание гексамеров с альбумином. При дальнейшем разведении происходит распад гексамеров на димеры и мономеры, способные медленно проходить через стенку капилляра. Большинство мономеров (около 98%) быстро связываются с молекулами альбумина сыворотки крови. Свободные мономеры инсулина детемир выходят из циркуляции и достигают тканей-мишеней, в которых инсулин детемир связывается рецептором инсулина на мембране клеток-мишеней, что запускает сигнальный процесс как основной биологический эффект – передачу сигнала в клетки органов-мишеней [11, 12].
Инсулин детемир имеет широкое применение при СД1 и СД2 в комбинации с инсулинами короткого/ультракороткого действия, а также с представителями практически всех других групп неинсулиновых противодиабетических средств: детемир+метформин, детемир+препараты сульфанилмочевины/глиниды, детемир+иДПП-4, детемир+ингибиторы α-глюкозидазы, детемир+аГПП-1, детемир+иНГЛТ-2.
За период более 15 лет от начала использования инсулина Детемир накоплены масса наблюдений и значимый клинический опыт использования данного базального аналога инсулина.
Клиническая эффективность и безопасность инсулина детемир
Представленные данные мета-анализов и рандомизированных клинических исследований показали, что инсулин детемир имеет высокую клиническую эффективность во всех возрастных группах. Значимо я снижение у пациентов риска всех гипогликемических состояний, в т.ч. ночных, вне зависимости от типа СД и его длительности. Результаты всех проведенных клинических исследований подтверждают большую предсказуемость действия инсулина детемир по сравнению с инсулином НПХ. В международном наблюдательном исследовании PREDICTIVE™ 303 (n=5603) проведена оценка эффективности терапии инсулином детемир пациентов с СД2 с использованием упрощенного алгоритма самостоятельной титрации доз (A1) по сравнению со стандартным врачебным алгоритмом титрации (А2) в амбулаторных центрах первичной помощи в течение 6 месяцев [14]. Исследование показало, что у пациентов, переведенных с инсулина гларгин, уровень гликозилированного гемоглобина (HbA1c) снизился через 26 недель с 8,4 до 8,0% в группе титрации А1 и с 8,4 до 8,2% в группе А2 (р=0,052).
У пациентов, переведенных с терапии инсулином НПХ на таковой инсулином детемир, уровень HbA1c снизился с 8,2 до 8,0% в группе А1, с 8,3 до 8,2% в группе А2 (р=0,38). Средние суточные дозы инсулина детемир через 26 недель терапии составили 0,69 и 0,57 ЕД/кг в группах титрации А1 и А2 соответственно у пациентов, переведенных с терапии инсулином гларгин 100. В группе пациентов, получавших исходно инсулин НПХ, дозы составили 0,74 и 0,53 ЕД/кг в группах А1 и А2 соответственно. Оценка частоты гипогликемий (эпизод/пациент/месяц) показала снижение через 26 недель с 0,72 исходно до 0,56 в группе титрации А1, с 0,74 до 0,39 в группе А2 у пациентов, переведенных на терапию инсулином детемир с инсулина гларгин. В группе предшествовавшей терапии инсулином НПХ показано аналогичное снижение частоты гипогликемий. По результатам исследования у пациентов, переведенных с терапии базальным инсулином гларгин±ПССП (пероральные сахароснижающие препараты) или НПХ инсулин на терапию инсулином детемир в амбулаторных центрах первичной помощи, показано значительное улучшение гликемического контроля на фоне умеренного снижения массы тела и достоверного снижения риска гипогликемий [14].
Оценка эффективности и безопасности терапии инсулином детемир в условиях повседневной клинической практики (исследование PREDICTIVE™) 2377 пациентов Европейской когорты с СД2, ранее не получавших инсулин, с плохим гликемическим контролем на пероральной сахароснижающей терапии показала, что через 3 месяца после старта терапии инсулином детемир выявлено достоверное снижение уровня HbA1c и низкая частота развития гипогликемий без тяжелых эпизодов. Было отмечено более выраженное снижение массы тела пациентов, которым отменили предшествовавшую терапию препаратами сульфонилмочевины или тиазолидиндионами по сравнению с теми, кто продолжал пероральную терапию без изменений [15]. У пациентов с СД2 терапия инсулином детемир в сочетании с предшествовавшей терапией ПССП либо в результате замены предшествовавшего базального инсулина обеспечивала быстрое и значимое улучшение гликемического контроля, снижение риска гипогликемий и снижение массы тела [16].
Аналогичные результаты получены в исследовании PREDICTIVE™ у 682 пациентов с СД1 Европейской когорты (38% мужчин, средний возраст – 40,3 года, длительность диабета составила 19,7 года, индекс массы тела [ИМТ] – 25,3±4,1 кг/м2), получавших терапию инсулином детемир в качестве базального компонента базис-болюсного (ББ) режима терапии в течение 6 месяцев. Предшествовавшая терапия представлена инсулином гларгин в ББ-режиме терапии. За 29 недель наблюдения общая частота эпизодов гипогликемии снизилась с 67,3 пациенто-лет до 47,3 (p<0,0001). Было показано снижение частоты тяжелых и ночных эпизодов гипогликемии (до 2,0 и 9,0 пациенто-лет; p<0,0001 для обоих сравнений). Средний уровень HbA1c и интраиндивидуальная вариабельность гликемии натощак также достоверно снизились. У пациентов отмечено достоверное снижение средней массы тела, наиболее выраженное у пациентов с высоким ИМТ (29–31 кг/м2 [-1,7 кг], >31 кг/м2 [-2,0 кг]). Перевод на терапию инсулином детемир в ББ-режимах терапии пациентов, получавших терапию инсулином гларгин в ББ-режиме, обеспечивает улучшение гликемического контроля и снижение частоты гипогликемий с умеренным снижением массы тела [17]. Полученные данные исследования PREDICTIVE™ свидетельствуют: можно получить дополнительные преимущества в плане эффективности и безопасности терапии при замене базального инсулина гларгин на инсулин детемир в ББ-режимах терапии пациентов с СД1.
Однонаправленные изменения углеводного обмена были также получены в нескольких исследованиях пациентов с СД1. В открытом исследовании с параллельными группами (16 недель) 408 пациентов с СД1 были рандомизированы в группы терапии инсулином детемир либо инсулином НПХ [18]. В качестве болюсного инсулина пациенты получали ультракороткий аналог инсулина аспарт. HbA1c и уровень глюкозы плазмы натощак (ГПН) в динамике в группе терапии инсулином детемир были достоверно ниже по сравнению с инсулином НПХ (p=0,027). Вариабельность значений глюкозы плазмы перед завтраком, по данным самостоятельного мониторинга гликемии, была ниже на терапии инсулином детемир, так же как и легких эпизодов гипогликемий (25%; p=0,046; 32%; p=0,002 соответственно), по сравнению с группой пациентов, находящихся на терапии инсулином НПХ. Таким образом, общий гликемический контроль на фоне терапии инсулином детемир был достоверно лучше по сравнению с терапией инсулином НПХ [18].
В 6-месячном сравнительном многонациональном исследовании с параллельными группами 448 пациентов с СД1 были рандомизированы на терапию инсулином детемир или НПХ в сочетании с быстродействующим инсулином аспарт [19]. В то время как показатели контроля гликемии были аналогичными между группами, интраиндивидуальная вариабельность была значительно ниже при терапии инсулином детемир по сравнению с терапией инсулином НПХ (p<0,001). Кроме того, терапия инсулином детемир сопровождалась значительным снижением риска всех гипогликемий, в т.ч. ночных (на 22 и 34% соответственно). К концу исследования масса тела была достоверно ниже у пациентов в группе терапии инсулином детемир.
Таким образом, результаты ряда исследований терапии пациентов с СД1 и СД2 позволяют говорить о том, что можно получить дополнительные преимущества в плане эффективности и безопасности терапии при замене базальных инсулинов НПХ и гларгин на инсулин детемир. Инсулин детемир показал свою наибольшую эффективность и безопасность при введении 2 раза в сутки в дозе 0,4 ЕД/кг массы тела [20, 21].
Длительность действия инсулина детемир и его вариабельность
Важным минусом традиционных препаратов человеческого инсулина является их непредсказуемая активность, что связано с непостоянной всасываемостью препаратов. Период всасывания 50% инсулина детемир из подкожно-жирового депо составляет 10,2±1,2 часа по сравнению с 2,0± 0,1 для мономерного ацилированного инсулина [22]. Пролонгированное действие препарата Левемир® обусловлено выраженной самоассоциацией молекул инсулина в месте инъекции и связыванием молекул препарата с альбумином через соединение с боковой жирнокислотной цепью; 98–99% циркулирующего инсулина детемир связано с альбумином, что позволяет создавать более медленный по сравнению с человеческим инсулином трансэпителиальный транспорт из крови в интерстициальную ткань, т.е. дальнейшее продление действия детемира связано с циркуляцией в кровотоке, где его концентрация поддерживается за счет прочной связи с альбумином сыворотки крови. Указанные механизмы замедленного распределения обеспечивают более прогнозируемый и воспроизводимый профиль абсорбции и действия препарата Левемир® по сравнению с инсулином-изофан [10, 23].
Для оценки сахароснижающих эффектов инсулина детемир обследованы группы здоровых добровольцев, пациенты с СД1 и СД2 методом эугликемического клемпа [24, 25]. Средняя продолжительность действия инсулина детемир составила около 24 часов для пациентов с СД1 и более 24 – для пациентов с СД2 [22], однако имела различия у отдельных больных. Инсулин детемир характеризуется дозозависимой длительностью своего действия, что было продемонстрировано в рандомизированном двойном слепoм перекрестнoм исследовании пациентов с СД1 [26, 27]. С использованием 24-часового эугликемического клэмпа параметры пациентов мониторировали в течение суток в ответ на введение инсулина НПХ (0,3 ЕД/кг) и инсулина детемир (0,1 ЕД/кг; 0,2; 0,4; 0,8; 1,6 ЕД/кг). Исследование показало, что при введении инсулина детемир формируется плоский пролонгированный фармакодинамический профиль с высокой предсказуемостью действия по сравнению с НПХ инсулином.
В настоящем исследовании определена линейная взаимосвязь дозы инсулина детемир и ответной реакции в виде длительности действия: длительность действия инсулина детемир при его дозе 0,4 ЕД/кг составила 20 часов, при увеличении дозы более 0,4 ЕД/кг длительность его действия увеличивалась и достигала 22–24 часов.
В настоящее время оценка эффективности лечения СД не ограничивается уровнем HbA1c, а определяется размахом и частотой колебаний суточной гликемии. В связи с этим другой значимой проблемой инсулинотерапии является значительная вариабельность инсулинов, приводящая к колебаниям уровня глюкозы в крови и повышением частоты гипогликемий, что в свою очередь снижает вероятность достижения целевых показателей гликемии [27]. В конце XX в. предложено около 30 различных критериев, характеризующих вариабельность гликемии, для получения которых используются результаты самоконтроля гликемии и непрерывного суточного мониторинга.
Меньшая вариабельность действия инсулина детемир по сравнению с другими базальными инсулинами (НПХ и гларгин 100) связана с рядом его свойств. Абсорбция инсулина детемир не зависит от ресуспендирования или растворения микропреципитатов. Детемир – растворимый инсулин, ввиду чего не требуется ресуспензирования препарата, а в месте инъекции не образуются преципитаты [4, 5, 10]. Обратимое связывание с альбумином плазмы определяет буферный эффект детемира, при котором не происходит немедленного изменения фармакодинамического ответа. В связи с этим детемир имеет более плоский, более длинный и более предсказуемый профиль действия, чем НПХ инсулин, что способствует снижению риска осложнений диабета [25]. Профиль действия инсулина детемир значительно менее вариабелен по сравнению с инсулином-изофан и инсулином гларгин (AUCGIR, 0–24 ч для инсулина детемир составляет 0,074, 0,466 – для инсулина-изофан и 0,231 – для инсулина гларгин; GIRmax для инсулина детемир составляет 0,053, 0,209 – для инсулина-изофан и 0,130 – для инсулина гларгин) [10].
В рандомизированном двойном слепом исследовании 54 пациентам с СД1 в условиях эугликемического клемпа (целевая концентрация глюкозы в крови 5,5 ммоль/л) вводили однократно дозы 0,4 ЕД/кг инсулина детемир, гларгина 100 или инсулина НПХ [28]. Результаты исследования показали, что инсулин детемир ассоциирован с меньшей интраиндивидуальной изменчивостью в утилизации глюкозы, чем НПХ-инсулин и инсулин гларгин (рис. 4).
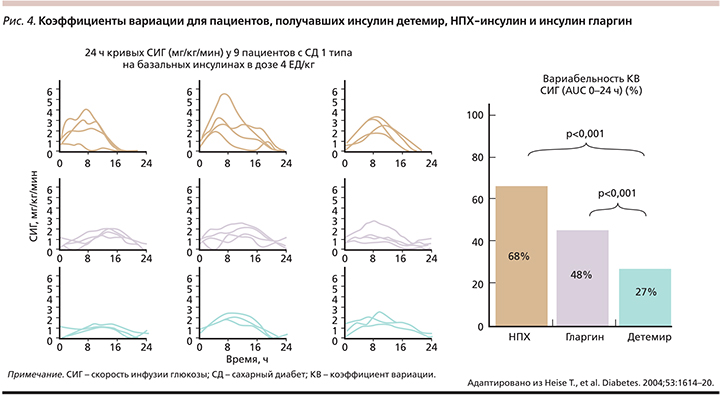
В одноцентровом исследовании параллельных групп (MTB Medizintechnik, Ulm, Germany) ставили цель оценить изменчивость фармакодинамики и фармакокинетики для инсулинов детемир, НПХ и гларгин у 54 пациентов с СД1 (возраст – 38±10 лет, длительность диабета – 18±9 лет). Показано, что при сравнении вариабельности свойств инсулина детемир с двумя базальными инсулинами (НПХ инсулином и инсулином гларгин) детемир имел более предсказуемый глюкозоснижающий профиль со значительно меньшей изменчивостью по сравнению с другими инсулинами [27, 29]. Более низкую вариабельность инсулина детемир демонстрирует 95%-ный интервал прогнозируемой частоты гипер- и гипогликемий при терапии инсулином детемир по сравнению с инсулинами НПХ и гларгин. Риск развития выраженной гипогликемии (на 50% ниже по сравнению с обычным средним уровнем гликемии): примерно 2 раза в год с инсулином детемир, 57 раз в год с инсулином НПХ и 27 в год с инсулином гларгин [29]. Эти результаты показали, что более низкая изменчивость инсулина детемир служит значимым фактором для пациентов на инсулинотерапии, определяя улучшение метаболического контроля с меньшим числом колебаний уровня глюкозы в крови при терапии изо дня в день.
Гипогликемии
Одна из самых важных последствий изменчивости инсулина – увеличение риска гипогликемий, что служит основным барьером к эффективному и безопасному управление диабетом. Для оценки преимуществ инсулина детемир ввиду снижения риска гипогликемий при достижении компенсации СД был проведен мета-анализ четырех открытых рандомизированных многоцентровых клинических исследований 1180 пациентов с СД1. Была дана оценка частоты тяжелых и легких гипогликемий на фоне терапии инсулином Детемир, вводимого 1 или 2 раза в сутки (число эпизодов на 1 пациента в месяц), и на фоне терапии НПХ инсулином (n=810). Оценка показала, что риск гипогликемий был на 22% ниже в группе терапии инсулином детемир по сравнению с группой инсулина НПХ (р<0,001). Более того, при улучшении показателей HbA1c риск развития гипогликемий имел дальнейшую тенденцию к снижению [30]. По данным Кокрейновского обзора (2009), риск симптоматических, а также ночных и тяжелых эпизодов гипогликемии был в среднем на 16 и 18%, 34 и 37%, 30 и 50% ниже при использовании инсулинов гларгина и детемира, чем инсулина НПХ соответственно [8].
В 26-недельном многоцентровом рандомизированном исследовании с участием 322 пациентов с СД1 применение инсулина детемир продемонстрировало снижение риска ночных гипогликемий и тяжелых гипогликемий на 32 и на 72% соответственно по сравнению с инсулином гларгин [31], что доказало меньшую вариабельность действия инсулина детемир по сравнению с другими базальными инсулинами [32].
Эффективность и безопасность инсулина детемир в различных группах пациентов
Доказанные преимущества применения инсулина детемир при лечении СД у беременных пациенток
Сахарный диабет во время беременности приводит к возникновению массы фетальных и материнских осложнений. Инсулин является наиболее эффективным армакологическим средством для контроля гипергликемии во время беременности и может ограничивать неблагоприятные исходы. Инсулин детемир с 2012 г. разрешен к использованию для лечения беременных женщин с диабетом.
Проведена оценка эффективности и безопасности действия инсулина детемир у беременных женщин с СД1 по сравнению с НПХ-инсулином [33]. Доля пациенток, достигших целевого уровня HbA1c (6,0%) на 24-й и 36-й неделях беременности, существенно не различалась от терапии инсулинами детемир и НПХ. В то время как ГПН были значительно ниже в группе беременных, получавших терапию инсулином детемир по сравнению с НПХ- инсулином (см. таблицу). Набор массы тела пациенток, получавших инсулины детемир и НПХ, был идентичен и составил 11,5 и 11,0 кг соответственно.

В исследовании не было получено разницы между исходами беременности у пациенток на терапии инсулинами детемир и НПХ: рождение ребенка с массой тела меньше 10-го процентиля или выше 90-го процентиля для гестационного возраста и пола, преждевременные роды (<37 гестационных недель), ранняя смерть плода (<22 гестационной недели), перинатальная смертность, наличие врожденных пороков развития [34]. Масса тела новорожденных была 3504 и 3571 г соответственно в группах детемира и НПХ-инсулина. В группе женщин, получавших терапию инсулином детемир, 46% детей были крупными для гестационного возраста, 19% имели макросомию, в группе НПХ-инсулина 54% новорожденных были большими для гестационного возраста и 26% – с макросомией.
Перинатальные исходы служат ярким отражением течения беременности. Рандомизированное контролируемое исследование направлено на сравнение эффективности и безопасности инсулина детемир и НПХ- инсулина у беременных женщины с СД1. Две группы пациенток были рандомизированы на инсулины детемир (n=152) и НПХ-инсулин (n=158) либо в период 12 месяцев до наступления беременности, либо на 8–12-й неделях беременности. Результаты исследования: 128 и 136 новорожденных детей в группах с терапией детемир и НПХ- инсулин, 11 и 9 – ранние потери плода, 2 и 1 – перинатальная смерть соответственно [35]. В исходе беременности 16 детей имели пороки развития; детемир – 8 (5,6%), НПХ – 8 (5,5%). Частота побочных эффектов была одинаковой в группах. Терапия инсулином детемир не вызывала проблем с безопасностью со стороны матери и плода, препарат переносился так же хорошо, как и НПХ-инсулин [36, 37].
Инсулин детемир и СД1 у детей и подростков: вопросы эффективности и безопасности
Особую группу пациентов представляют дети и подростки с СД.
В рандомизированном контролируемом 6-недельном исследовании параллельных групп дана сравнительная оценка эффективности и безопасности инсулинов детемир и НПХ в комбинации с инсулином аспарт при СД1 у детей и подростков. 347 детей 6–17 лет были включены в исследование [38]. В обеих группах был достигнут сходный уровень HbA1c при более предсказуемом гликемическом профиле инсулина детемир и меньшей интраиндивидуальной вариабельности гликемии. Отмечен значительно более низкий риск (26%) ночных гипогликемических эпизодов на терапии инсулином детемир по сравнению с инсулином НПХ, значительно более низкий ИМТ у детей и подростков, получавших терапию инсулином детемир. Исследование показало, что сочетание двух аналогов инсулина в условиях ББ-терапии (детемир+аспарт) позволяет реализовать преимущества каждого из указанных препаратов и получить более выраженный клинический эффект: эффективное снижение уровня HbA1c, меньшая вариабельность гликемии, достоверное снижение гипогликемических состояний, прежде всего ночных, и меньшие значения ИМТ [39].
Эффективность и безопасность ББ-терапии инсулинов детемир и НПХ в комбинации с инсулином аспарт у детей 2–16 лет с СД1 [40]
Инсулин детемир показал сходный уровень HbA1c с НПХ-инсулином в контрольных точках 12-й, 26, 38 и 52-й недели в общей когорте пациентов, доказав свою эффективность. При этом определена достоверно меньшая вариабельность во всех точках наблюдения по сравнению с НПХ-инсулином в общей когорте детей и подростков (SD 3,01 против 3,68 ммоль/л; p<0,001). При оценке динамики массы тела (SDS, Z-score) у детей получены достоверные различия: SD-score массы тела составила на терапии инсулином детемир 0,18, в то время как на терапии НПХ-инсулином 0,33 (средняя разница – -0,15, 95% ДИ – -0,23–-0,07; р<0,001).
Наиболее значимым показателем в исследовании была оценка гипогликемических эпизодов на протяжении 52 недель терапии. Было зарегистрировано 3 эпизода гипогликемии в отсутствие ночных гипогликемий в группе инсулина детемир по сравнению с 15 эпизодами в группе НПХ-инсулина, в т.ч. 6 ночных гипогликемий.
В других исследованиях в группах детей в возрасте 6–17 лет с СД1 показатель HbA1c на 26-й неделе наблюдения существенно не различался между реципиентами инсулина детемир и инсулина НПХ [41], при значительной разнице ГПН при проведении собственных измерений пациентами на инсулине детемир по сравнению с НПХ-инсулином (p<0,001). Уровни ГПН были значительно ниже в группе детей в возрасте 6–17 лет, получавших терапию инсулином детемир, по сравнению с инсулином НПХ. Средний ИМТ при Z-оценке был также значительно ниже в группе инсулина детемир, чем у пациентов на НПХ-инсулине (0,08 и 0,26 соответственно; p<0,001) [42].
В другом исследовании изменение среднего стандартного отклонения (SD) массы тела пациентов в возрасте 2–16 лет составило -0,12 против 0,04 (р<0,001) в группах терапии инсулинами детимир и НПХ соответственно [43]. Среднее значение базальной дозы инсулина в группе терапии инсулином детемир составило 32,2 и 31,0 ЕД/сут в группе НПХ-инсулина у детей в возрасте 6–17 лет [44]. По результатам другого исследования, у реципиентов инсулина детемир и НПХ-инулина базальная доза была 0,60 и 0,58 ЕД/кг массы тела/сут в возрастной группе 2–16 лет [45].
Таким образом, инсулин детемир продемонстрировал свою эффективность и безопасность в детской возрастной группе и показан к лечению СД у подростков и детей в возрасте от 1 года и старше.
Роль и место инсулина детемир в терапии пациентов старших возрастных групп
Одним из важнейших принципов терапии СД является баланс гликемического контроля с риском побочных эффектов. Особое внимание представляют пожилые пациенты с учетом целого ряда клинических, лабораторных и психосоциальных особенностей. Это прежде всего наличие сочетанной полиорганной патологии, в т.ч. патологии печени и почек, сердечно-сосудистые риски, неспецифические жалобы и бессимптомное течение, микро- и макроангиопатии уже при выявлении СД, нарушение когнитивных функций. В связи с этим оценка эффективности и безопасности препарата имеет большое значение для лиц пожилого возраста.
В международном открытом неинтервенционном исследовании A1chieve проведена оценка клинической безопасности и эффективности применения инсулина детемир в возрастной группе 65 лет и старше с СД2 при переходе на инсулин детемир с ПССП или НПХ-инсулина. В субанализ 24-недельного исследования был включен 15 241 пациент. Терапия инсулином детемир в течение указанного периода привела к значительному улучшению гликемического контроля и качества жизни в результате снижения частоты тяжелых и ночных гипогликемий по сравнению с исходной частотой (р<0,05) [46]. Интересными были полученные данные по динамике массы тела: 24-недельная терапия привела к значительной потере массы тела у пациентов, переведенных на инсулин детемир с другого инсулина, в то время как те пациенты, которые впервые получали терапию инсулином, имели незначительный прирост массы тела [46].
Пожилые пациенты особенно уязвимы к возникновению гипогликемий. Целью наблюдательного исследования, проведенного в течение 24 недель в реальной клинической практике, была оценка терапии инсулином детемир с участием 3219 исследователей и 2817 проектных площадок из десяти стран [47, 48]. Инсулин детемир вводили однократно пациентам с СД2 в группах старше и младше 75 лет, получавших лечение одним или несколькими пероральными противодиабетическими препаратами. Общая когорта составила 17 374 участника, из которых 2398 (14%) были старше 75 лет. Исходный уровень HbA1c был сходен в группах пациентов старше и младше 75 лет (HbA1c – 8,8±1,5 и 8,9±1,6% соответственно). Оценка эффективности терапии инсулином детемир показала, что после 24 недель лечения также наблюдалось аналогичное снижение уровня HbA1c в двух группах: 7,6±1,1 и 7,5±1,2%. Частота развития тяжелой гипогликемии (пациенто-год) снизилась в исследовании в обеих возрастных группах: от 0,057 до 0,007 у пациентов в возрасте старше 75 лет и от 0,042 до 0,005 у пациентов младше 75 лет. Оценка массы тела показала сходное снижение средних значений в обеих группах: -0,5 кг у пациентов старше 75 лет и -0,6 кг – младше 75 лет. Результатом исследования в реальной клинической практике стало доказательство эффективности и безопасности терапии инсулином детемир в старшей возрастной группе без связи с повышенным риском развития тяжелой гипогликемии или набора массы тела [49].
Заключение
Опыт реальной клинической практики свидетельствует: пациенты с СД часто не достигают компенсации заболевания. Во многом это связано со значительными перепадами гликемии в течение суток, высоким уровнем вариабельности гликемии. Аналог инсулина длительного действия инсулин детемир – эффективная и хорошо переносимая базальная инсулинотерапия пациентов с СД1 и СД2. Применение инсулина детемир в составе ББ-терапии или в виде базальной терапии вместе с ПССП способствует улучшению гликемического контроля, более низкой изменчивости гликемии, снижению риска возникновения гипогликемических состояний, в т.ч. ночных гипогликемий, меньшему увеличению массы тела по сравнению с НПХ-инсулином. Таким образом, современные режимы инсулинотерапии с применением инсулиновых аналогов, в т.ч. инсулина детемир, позволяют достигать компенсации углеводного обмена, предупреждать формирование и прогрессирование осложнений, способствуя улучшению качество жизни пациентов с СД.


