Введение
В отличие от чужеродных для организма человека лекарственных веществ фармакотерапия, основанная на естественных по своей природе микронутриентах (витамины, минеральные вещества и микроэлементы), обладает характерными особенностями [1]. Физиологический уровень витаминов и минералов в организме не нулевой, поддерживается в узком интервале значений; существуют эндогенные регуляторные механизмы его поддержания – гомеостатические механизмы.
К таким гомеостатическими процессам относятся:
- механизмы распределения, связывания со специфическими переносчиками в плазме крови (трансферрин для железа, церулоплазмин для меди);
- депонирование (например, эритроцитами для фолатов, костной тканью для кальция; энтерогепатический пассаж для витамина D и фолатов);
- поддержание плазменного уровня витаминов и минералов по механизму обратной связи за счет изменений активности абсорбции в кишечнике, выделения путем почечной экскреции или выведения с желчью (например, для кальция, магния и витамина D [2]).
Если минералы и микроэлементы не метаболизируются в организме, то по отношению к лекарствам-ксенобиотикам срабатывает ответная защитная реакция – элиминация «как можно раньше», их нормальный физиологический уровень в плазме крови – «нулевой». Эффективные «машины» элиминация ксенобиотика, как правило, ждут его в двух местах – печени и почках, а задача лекарства-ксенобиотика – избежать их, чтобы найти, прочно связать и заблокировать/активировать свою мишень терапевтического действия (например, кальциевые каналы, β-адренорецепторы, ключевые ферменты синтеза холестерина и др.).
Микронутриенты обычно действуют в организме согласованно. Всасывание в кишечнике и последующий метаболизм определенного питательного вещества в значительной степени зависят от наличия других питательных веществ. Эссенциальный характер микронутриентов предполагает их взаимодействие на всех этапах: абсорбции, распределения, внутриклеточного транспорта, почечной экскреции. Дефицит или избыточное потребление микронутриентов с пищей, прием лекарственных средств и БАДов, содержащих отдельные макроэлементы и витамины, могут изменять физиологический баланс кальций/магний/витамин D, способствуя развитию патологических состояний (нефроуролитиаз, кальциноз артерий и мягких тканей) [3].
Баланс поступления кальция и магния, возможные последствия его нарушения
Хотя о магнии известно многое, внимание к его взаимодействию с кальцием и витамином D было привлечено сравнительно недавно. Толчком к этим исследованиям послужили данные о том, что с 1977 по 2012 г. потребление кальция в популяциях, использующих в пищу современные продукты*, увеличилось в 2–2,5 раза по сравнению с потреблением магния. В результате чего соотношение потребления кальция и магния превысило 3,0 [4].
Изменение баланса потребления кальция и магния в сочетании с приемом препаратов кальция и витамина D на фоне субоптимального поступления магния могут иметь неблагоприятные последствия для здоровья [5].
Повышенные уровни фосфата и кальция в плазме крови соответствуют увеличению риска ишемической болезни сердца (ИБС), инсульта и смертности. Исследование ARIC (Atherosclerosis Risk in Communities), проводившееся в течение более 10 лет и включившее наблюдения за когортой из 15 700 человек, подтвердило, что повышенные уровни кальция (отношение шансов [ОШ] – 1,16, 95% доверительный интервал [ДИ] – 1,07–1,26; р=0,0005) и фосфата (ОШ – 1,11, 95% ДИ – 1,02–1,21; р=0,0219) в плазме крови служат фактором риска этих заболеваний [6].
Избыточное содержание кальция в составе пищевых добавок может приводить к дефициту магния, увеличивая риск кальцификации артерий [5].
Основным элементом, содержащимся в кальцинированной атеросклеротической бляшке (АБ), служит гидроксиапатит кальция, который содержит до 40% кальция, а по своему химическому строению идентичен гидроксиапатиту кальция, содержащемуся в костях. Степень кальциноза коронарных артерий может быть количественно отражена с помощью коронарного кальциевого индекса (ККИ). Показано, что ККИ коррелирует с тяжестью коронарного атеросклероза, наличием гемодинамически значимых стенозов коронарных артерий и риском развития коронарных осложнений [7].
Результаты клинических исследований демонстрируют связь между кальцинозом коронарных артерий и их атеросклеротическим поражением, причем площадь кальциноза составляет примерно 1/5 площади коронарных АБ [8]. Другими словами, хотя количество коронарного кальция тесно соотносится с тотальной массой уязвимых АБ, обызвествление представляет всего лишь вершину айсберга. Определяемый объем обызвествленных АБ составляет 20% их тотальной массы.
Большинство АБ содержит кальцинаты, общая тяжесть атеросклеротического поражения артерий (объем АБ) коррелирует с выраженностью кальциноза, частота обызвествлений нарастает с возрастом [9].
Увеличение риска сердечно-сосудистых осложнений у пациентов с ревматическими заболеваниями также связывают с коронарным кальцинозом [10], который ассоциируется с повышением уровня смертности как от кардиоваскулярных, так и от других причин. Кальцификация сердечных тканей и стенок сосудов – это часто развивающийся при хронической болезни почек (ХБП) процесс, который является одной из основных причин развития сердечно-сосудистых заболеваний (ССЗ) и повышения уровня смертности среди данной категории пациентов. Его распространенность наиболее высока среди пациентов с тяжелой ХБП [11].
Одно из самых частых показаний к назначению кальций-содержащих препаратов – профилактика остеопороза различного генеза. При анализе возрастных и гендерных особенностей атеросклеротического поражения сосудов обращает на себя внимание другой важный аспект – взаимосвязь атерокальциноза и изменений минеральной плотности костной ткани. Никого не удивляет ухудшение состояния костной ткани с возрастом, и объясняется это тесными биологическими и патогенетическими связями атеросклеротической кальцификации и остеогенеза [12]. Доказано достоверное увеличение отложения кальция в коронарных артериях при снижении плотности костной ткани и увеличение риска развития инфаркта миокарда.
Е. Schulz et al. обнаружили, что пациенты с выраженной кальцификацией сосудистой стенки часто имеют низкую плотность костной ткани и что значительная потеря костной массы у таких лиц коррелирует с более быстрым прогрессированием кальцификации брюшной аорты, в то время как низкие значения минеральной плотности костей коррелируют с некальцифицированными АБ [13].
Предполагаемый риск ССЗ, связанный с общим потреблением кальция, может зависеть от источника его поступления. Потребление кальция с пищей, как было показано, не увеличивает риск ССЗ, тогда как прием пищевых добавок с кальцием ассоциирован с повышенным риском инфаркта миокарда. Аналогичным образом потребление кальция, содержащегося в пище, может снижать риск возникновения камней в почках, тогда как добавки с кальцием могут увеличивать риск нефролитиаза [14]. Одно из объяснений этого очевидного парадокса может заключаться в том, что одномоментный прием больших нагрузочных доз в виде добавок кальция могут временно повышать концентрацию кальция в плазме крови [15], что в свою очередь способно приводить к кальцификации сосудов и другим неблагоприятным побочным эффектам. Одним из потенциальных механизмов, лежащих в основе ассоциации между потреблением кальция и риском ССЗ, может стать прогрессирование атеросклероза. Оценка кальциноза коронарных артерий является хорошо зарекомендовавшим себя суррогатным маркером тяжести поражения атеросклерозом и является прогностическим фактором риска ССЗ [16].
Чрезмерное содержание кальция в рационе, особенно чрезмерное потребление пищевых добавок кальция, принимаемых для профилактики или лечения остеопороза, может иметь непредсказуемые последствия для здоровья. Об этом свидетельствуют данные исследования Multi-Ethnic Study of Atherosclerosis (MESA), выполненного экспертами из 8 университетов США, результаты которого опубликованы несколькими независимыми группами. В начале исследования все участники (5448 пациентов в возрасте 45−84 лет без клинических признаков ССЗ) сообщили о своих пищевых привычках, чтобы определить, сколько кальция они употребляют в пищу с молочными продуктами, зеленью и зерновыми культурами, какие лекарственные средства и пищевые добавки принимают. Для определения кальцификации коронарных артерий использовали мультиспиральную компьютерную томографию. Через 10 лет она проведена повторно для оценки риска развития ИБС.
На основе опубликованных в Journal of the American Heart Association данных, авторы пришли к выводу, согласно которому избыточное употребление кальция в составе пищевых добавок на 22% увеличивает риск образования АБ и развития ССЗ в течение 10 лет [17]. При этом пациенты, соблюдавшие здоровую диету с преобладанием богатых кальцием продуктов, имели на 27% более низкую вероятность ССЗ.
Результаты 10-летнего наблюдения в исследовании MESA также демонстрируют, что высокий ККИ увеличивает риск не только ССЗ, но и рака, ХБП и хронической обструктивной болезни легких. Выводы по этой части исследования MESA были опубликованы в Journal of the American College of Cardiology: Cardiovascular Imaging [18]. У 68% из 710 пациентов с диагнозом «рак» ККИ был высоким. После корректировки на другие факторы установлено, что у лиц ККИ >400 относительный риск развития рака повышался на 53% (ОШ – 1,53, 95% ДИ – 1,18–1,99). Частота ХБП у лиц с нулевым ККИ составляла 3%, при ККИ > 400 – 13%.
В то же время результаты другого клинического исследования, выполненного ранее, не поддерживают предположения об увеличении риска ССЗ при использовании пищевых добавок с кальцием [19].
На основе мета-анализа существующих данных другая группа исследователей пришла к выводу, согласно которому БАД с кальцием не повышают риска развития ССЗ по сравнению с плацебо при условии их приема здоровыми людьми в суточных дозах, не превышающих 500–2000 мг [20].
Ключевая роль магния в поддержании кальциевого обмена
Одной из возможных причин развития гиперкальцемии и гиперкальциурии служит дефицит магния. Однако до настоящего времени определение уровня магния в плазме крови не стало нормой в условиях реальной клинической практики, т.к. считается, что этот показатель только косвенно и очень приблизительно отражает его содержание внутри клетки.
Около 60% сывороточного магния находится в ионизированном виде, остальная часть связана с протеинами, фосфатами, цитратами. В плазме крови и эритроцитах содержится менее 1% от общего количества магния. На сердце приходится около 20% всего магния, содержащегося в организме человека, что говорит о его большом значении для нормальной сердечной деятельности [21].
Эпидемиологические исследования связывают низкий уровень магния с более высоким риском метаболического синдрома, сахарного диабета 2 типа, ССЗ, остеопороза, хронической обструктивной болезнию легких и, возможно, некоторых видов рака [4].
Магний является вторым по распространенности внутриклеточным катионом и играет ключевую роль в минерализации костной ткани, влияя на синтез активных метаболитов витамина D.
Согласно современным представлениям, любой эффект магния или кальция зависит от соотношения кальций/магний. По образному выражению специалиста-нутрициолога Carolyn Dean, «магний является ключом к правильной ассимиляции и использованию кальция, а также витамина D. Если мы потребляем слишком много кальция без достаточного количества магния, избыток кальция используется неправильно и может фактически стать токсичным, вызывая такие патологические состояния, как нефролитиаз, некоторые формы артрита, остеопороз и кальциноз артерий. Эффективность и преимущества кальция в отношении здоровья костей и профилактики остеопороза значительно ухудшается при отсутствии адекватного уровня магния в организме» [25].
Эффективным инструментом исправления дисбаланса может служить добавление в рацион магния [26, 27]. Более высокое потребление магния ассоциировано с более низким риском повышения ККИ [28], дополнительный прием магния улучшает функцию эндотелия у пациентов с ИБС [29].
Имеющее место в профессиональной среде убеждение, будто всасывание магния снижается в присутствии кальция, вступает в противоречие с современными представлениями о механизмах поступления кальция и магния в организм [30].
Процессы всасывания кальция в желудочно-кишечном тракте и его реабсорбции в почечных канальцах опосредованы двумя представителями суперсемейства TRP (transient receptor potential channels)** – ионными каналами TRPV5 и TRPV6 (рис. 1).
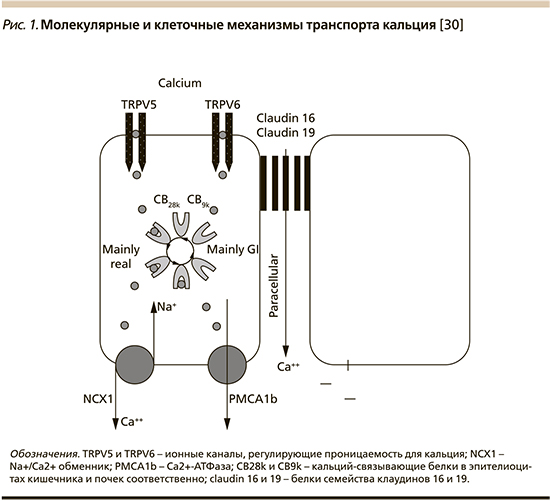
Выход кальция из энтероцитов обеспечивает натрий-кальциевый обменник, являющийся трансмембранным белком цитоплазматической мембраны, транспортирующим ионы кальция из клетки в обмен на ионы натрия, которые поступают в клетку (механизм антипорта). Обменник использует энергию, накопленную в электрохимическом градиенте натрия, пропуская 3 иона Na+ в клетку по градиенту концентрации и выводя один ион Ca2+ из клетки против градиента концентрации.
В эпителии нефрона за реабсорбцию кальция и его возвращение в системный кровоток отвечает Ca2+-АТФаза (PMCA1b), интегрированная в базальную мембрану эпителиоцитов почки.
Параклеточный перенос ионов кальция зависит от активности белков-клаудинов (claudin) 16 и 19, расположенных в зоне межклеточных контактов. Название «клаудин» происходит от латинского слова claudere («закрыть»), что соответствует барьерной роли этих белков. Клаудины (у человека представлены 24 белками) являются наиболее важным компоненом плотных межклеточных контактов – параклеточного барьера, контролирующего транспорт воды и ионов между клетками эпителия.
Клаудины имеют четыре трансмембранных домена, две внеклеточных и одну внутриклеточную петлю, находящихся в цитоплазме N- и С-концы.
В свою очередь экспрессия ключевых участников трансэпителиального переноса кальция – TRPV5 и PMCA1b – находится под контролем витамина D (рис. 2). Поскольку все витамин D-зависимые реакции напрямую зависят от присутствия магния, следствием взаимодействия между магнием и витамином D является нормокальциемия.
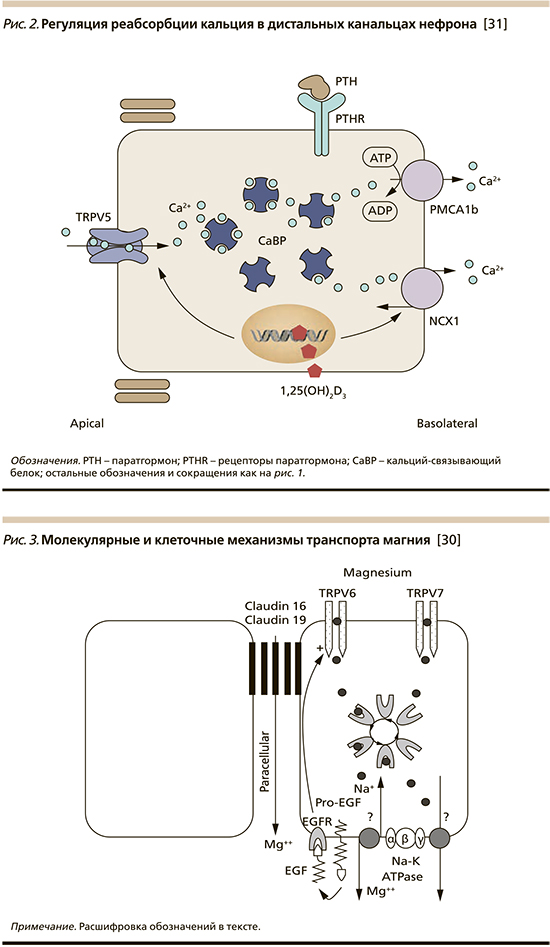
Внутриклеточный транспорт магния в энтероцитах пищеварительного тракта и эпителиоцитах почек осуществляется с помощью каналов подсемейства TRPM – TRPM6 и TRPM7 (рис. 3). Активность этих каналов контролируется эпидермальным фактором роста (EGF), который образуется из предшественника Pro-EGF, локализованного на базолатеральной мембране эпителия. Трансцеллюлярный перенос магния на уровне базальной мембраны регулируется работой Na+/K+-АТФазы.
Магний является кофактором 700–800 ферментных систем в организме человека, среди них – все витамин-D-зависимые процессы/реакции. Активность 3 основных витамин-D-превращающих ферментов и витамин-D-связывающих белков зависит от присутствия магния. К ним относятся 25-гидроксилаза в печени и 1- и 24-гидроксилазы в почках [4]. Таким образом, магний служит кофактором для биосинтеза, транспорта и активации витамина D. В свою очередь 1,25(OH)2D стимулирует всасывание магния в кишечнике [2].
Дефицит магния проявляется на уровне секреции паратгормона и кальцитонина, дополнительный прием магния заметно снижает резистентность к лечению витамина D [33]. Магний снижает уровень паратгормона, работает синергически с витамином D и кальцием, стимулируя специфическую активность кальцитонина [31]. Кальцитонин в свою очередь способствует минерализации костной ткани, снижая плазменные и тканевые уровни кальция, предотвращает развитие остеопороза, кальциевого нефролитиаза и некоторых форм артрита [32].
Кальций-содержащие препараты
В настоящее время фармакологические средства, содержащие кальций, делятся на несколько групп [34]:
- Препараты первого поколения – лекарства, содержащие исключительно соединения кальция.
- Препараты второго поколения – содержат комбинацию кальция с витамином D, отличаются более высокой терапевтической эффективностью по отношению к препаратам первого поколения.
- Препараты третьего поколения – современные комбинированные средства, сочетающие максимально биодоступные соединения кальция, магния и витамина D, способствующие сбалансированному усвоению кальция. Для них характерен пролонгированный терапевтический эффект и снижение риска развития побочных эффектов, ассоциированных с избыточным содержанием кальция в тканях.
Одним из таких препаратов третьего поколения является Остеокеа (Osteocare®) производства компании Витабиотикс (Великобритания). В таблетированной форме Остеокеа является зарегистрированным лекарственным средством, в жидкой форме – биологически активной добавкой и, что важно, единственной жидкой формой кальция. Помимо кальция и витамина D (100 ЕД) препарат содержит магний и цинк (см. таблицу).

Лечение препаратом показано для профилактики и коррекции дефицита минералов и витамина D, профилактики дефицита кальция в периоды жизни, характеризующиеся повышенной потребностью в нем (менопауза, пожилой возраст, период беременности и лактации), а также профилактики системного остеопороза и кариеса. Препарат прошел ряд исследований с успешным результатом, в которых доказано его положительное действие на минеральную плотность кости, кальциевый баланс; было отмечено достоверное снижение костной резорбции и уменьшение болевого синдрома на фоне терапии [41].
Заключение
Обзор литературных данных свидетельствует о возможной ассоциации кальциноза коронарных артерий и повышения риска ССЗ с приемом дополнительного источника кальция в виде БАД к пище. Одним из эффективных инструментов сохранения нормального кальциевого обмена в организме является соблюдение баланса кальций/магний, который может быть достигнут при сочетанном приеме препаратов, содержащих кальций, магний и витамин D. Магний участвует в активации и функционировании витамина D, оказывая нормализующее влияние на гомеостаз кальция в организме. Адекватное поступление кальция и магния является одним из важных условий безопасной профилактики остеопороза и других возраст-ассоциированных заболеваний. Выбирая препарат, следует помнить не только о необходимости сбалансированного сочетания в лекарственном средстве витамина D и соли кальция при его высоком процентном содержанием, но и о дополнительном наличии в таком препарате соединения магния.



