Введение
И ожирение, и сахарный диабет (СД) связывают с избытком углеводов и жиров в диете, гиподинамией, которые считаются факторами риска развития инсулинорезистентности. За последнее время накоплен значительный материал о взаимосвязи дефицита различных микронутриентов с риском развития диабета, прежде всего хрома, магния, цинка, витамина А и витамина D.
Особое внимание следует уделить дефициту витамина D, связанного с ожирением [1], высоким индексом массы тела – ИМТ [2], инсулинорезистентностью [3], неблагоприятным влиянием на секрецию инсулина [4], а также с глюкозотолерантностью [5]. Экспериментальные и клинические исследования подтверждают, что адекватная обеспеченность витамином D может снизить заболеваемость СД1 типа (СД1) и СД2, улучшить метаболический контроль при наличии диабета [6], в т.ч. гестационного, и избыточной прибавки массы тела во время беременности [7–9].
Дефицит витамина D широко распространен даже в относительно обеспеченных европейских странах [10] вследствие «вестернизации» питания. Например, недавнее исследование когорты из 1006 подростков 12–17 лет показало низкую обеспеченность витамином D в 9 странах Европейского Союза. В соответствии с международными критериями статус витамина D оценен как оптимальный (уровни 25-гидроксивитамина D – 25(OH)D более 75 нмоль/л), недостаточный (50–75 нмоль/л), дефицитный (27–50 нмоль/л) и как тяжелый дефицит (менее 27 нмоль/л). Среднее значение уровней 25(OH)D по когорте составило 57 нмоль/л, причем 80% обследованных лиц характеризовались субоптимальными уровнями (39% – недостаточный, 27% – дефицит, 15% – тяжелый дефицит) [11].
Следует подчеркнуть, что объем научных публикаций, указывающий на неопровержимую связь между дефицитом витамина D и СД, возрастает. К 2014 г. опубликовано более 4500 научно-исследовательских статей (причем более 4000 – после 2005 г.), указывающих на многочисленные аспекты связи между потреблением витамина D (по опроснику диеты, дневнику питания), уровнями витамина в плазме, активностью молекулярных каскадов и риском глюкозотолератности и диабета. В настоящей работе приведены результаты систематического анализа имеющихся экспериментальных, эпидемиологических и клинических данных о взаимосвязи дефицита витамина D, риска развития ожирения и диабета. Формулируются наиболее вероятные молекулярные механизмы, посредством которых биологически активные метаболиты витамина D вносят вклад в профилактику и терапию ожирения и диабета.
Дефицит витамина D и патофизиология диабета
Витамин D – витамин-гормон, характеризующийся широким спектром физиологических эффектов. Витамин D и его активные метаболиты не только необходимы для обмена кальция, но и вовлечены в процессы роста и развития клеток. Витамин D способствует всасыванию кальция, необходимого для секреции инсулина [12], оказывает иммуномодуляторное воздействие на панкреатические β-клетки [13]. Кроме того, СД1 и СД2 связаны с воспалением, при этом патофизиология СД1 включает аутоиммунный компонент. Тем не менее точные механизмы, посредством которых витамин D и кальций оказывают защитное метаболическое действие, не вполне ясны и требуют дальнейшего изучения [14].
Исследования указали не только на повышение риска развития СД2 при дефиците витамина D, но и на влияние дефицита витамина D на различные метаболические факторы риска развития СД, такие как уровни глюкозы натощак, чувствительность к инсулину, уровни гликозилированного гемоглобина (HbA1c), показатели метаболического синдрома (МС) и т.д., как у здоровых, так и у пациентов, страдающих СД. Например, в исследовании 126 пациентов с глюкозотолерантностью регрессионный анализ показал достоверные корреляции между уровнями 25(OH)D в плазме крови, чувствительностью к инсулину (р=0,0007) и концентрацией глюкозы натощак (р=0,027) [15].
В исследовании с участием 292 женщин 50–79 лет установлены корреляции между сниженными уровнями 25(OH)D сыворотки с повышением показателей избыточной массы тела: ИМТ (р=0,0002); окружности талии – ОТ (р<0,0001); отношением ОТ и окружности бедер (р<0,0001); повышением уровней триглицеридов (р<0,0001). Риск МС при высоком (52 нмоль/л) по сравнению с самым низким (<35 нмоль/л) уровнем 25(OH)D в сыворотке снижался в 3 раза (относительный риск [ОР]=0,28; 95% доверительный интервал [ДИ] – 0,14–0,56) [16].
Пониженные уровни 25(OH)D в сыворотке крови коррелируют с одновременным присутствием кардиометаболических факторов риска. По данным упомянутого ранее крупномасштабного исследования NHANES (2001–2006) когорты из 5867 подростков (12–19 лет), риск МС был на 70% выше среди пациентов с концентрациями 25(OH)D в сыворотке, соответствующими самой нижней трети (ОР=1,71, 95% ДИ – 1,11–2,65; р<0,01). Недостаточность 25(OH)D также коррелировала с увеличенной ОТ (p<0,0001), повышенным систолическим артериальным давлением (р=0,01) и снижением уровня холестерина липопротеидов высокой плотности – ЛПВП (р<0,0001) [17].
Уровни витамина D в плазме крови влияют на уровни HbA1c – долговременного показателя глюкозотолерантности. В исследовании 668 пожилых (возраст – 70–74 года) уровни 25(OH)D менее 50 нмоль/л в два раза повышали риск вновь диагностированного СД2. Статистическая значимость эффекта сохранялась после поправок на ИМТ, пол, воздействие полихлорированных бифенилов, уровни триглицеридов сыворотки, ЛПВП и курение. При более высоких концентрациях 25(OH)D наблюдалось снижение уровня HbA1c [18].
Связь между уровнями 25(OH)D в сыворотке и уровнями HbA1c была изучена с участием 9773 больных в рамках исследования NHANES. Многопараметрический линейный регресс показал, что уровни 25(OH)D в сыворотке были обратно пропорциональны уровням HbA1c пациентов в возрасте 35–74 лет (р=0,0045) [19].
Исследование группы из 280 пациентов с СД2 (59% мужчин, возраст – 68±10 лет) показало, что дефицит витамина D способствует истощению эндотелиальных клеток-предшественников (-0,12%; р=0,022), снижению поток-опосредованной вазодилатации по данным УЗИ (-1,43%; р=0,001) и повышению уровня HbA1c (р=0,032) [20].
В группе из 147 беременных с гестационным возрастом 35 ± 2 недели недостаточные уровни 25(OH)D (менее 50 нмоль/л) соответствовали повышенным уровням HbA1c (r=-0.32; р<0,001; Lau, 2011). В группе из 307 беременных уровни 25(OH)D были обратно пропорциональны уровням паратгормона (r=-0,24), уровням глюкозы в плазме крови натощак (r=-0,20), инсулина натощак (r=-0,20) и резистентности к инсулину [7].
Протеомный подход к анализу биомеркеров крови установил, что у детей с ожирением и дефицитом витамина D снижены уровни адипонектина. Группа детей с ожирением была разделена на две подгруппы – с выраженным дефицитом витамина 25(OH)D< 15 нг/мл (n=18) или с нормой 25(OH)D> 30 нг/мл (n=24). Анализ протеома плазмы крови указал на 53 белка, которые достоверно различались между подгруппами; среди этих белков был адипонектин, низкие уровни которого связаны с ожирением с диабетом. Курсовой прием витамина (3000 МЕ/сут, 12 месяцев) увеличил уровни адипонектина (р<0,02) [21].
Фундаментальные исследования и молекулярные механизмы воздействия витамина D на физиологию человека
Биологические эффекты витамина D осуществляются через взаимодействие со специфическим одноименным рецептором витамина (VDR – vitamin D receptor). Активированная витамином молекула рецептора VDR взаимодействует с активаторами и репрессорами этого рецептора, оказывая комплексное воздействие на процессы транскрипции генома. Белки генов, транскрипция которых модулируется рецептором VDR, вовлечены в процессы всасывания кальция и фосфора в кишечнике, транспортировку кальция в депо костей, иммуномодуляцию и другие процессы [22].
Существует несколько сотен генов, экспрессию которых регулирует рецептор витамина D и которые кодируют белки, опосредующие сложные молекулярные эффекты витамина D (кальбиндин, субстрат рецептора инсулина, IGF – Insulinlike growth factor-вязывающие белки, регуляторный белок PPAR-δ, белок-хемоатрактант моноцитов и др.).
Например, Са-связывающий белок кальбиндин, посредник транспорта кальция, одновременно играет важную роль и в защите клеток различных тканей от патологического апоптоза (программируемой клеточной смерти).
В частности, кальбиндин способствует защите β-клеток поджелудочной железы, что подтверждается экспериментальными исследованиями на линиях мышей с делециями гена кальбиндина [23].
Среди управляемых витамином D белков регуляции углеводного и жирового метаболизма следует отметить прежде всего субстрат рецептора инсулина (IRS1 – Insulin receptor substrate 1). Рецептор инсулина – трансмембранный рецептор с тирозинкиназной активностью. При связывании инсулина рецептор претерпевает изменение конформации и начинает фосфорилировать определенные аминокислотные остатки тирозина в белках инсулинового сигнального каскада (прежде всего белки IRS – insulin receptor substrate). Сигнальный путь рецептора инсулина довольно сложен и включает десятки белков, опосредующих передачу от активированного рецептора к биохимическим каскадам физиологического метаболизма углеводов и жиров.
IGF – один из важнейших факторов, поддерживающих баланс между жировой и мышечной тканями. При дефиците IGF или снижении его активности жировая ткань начинает преобладать над мышечной. В результате ускоряются процессы атеросклероза и кальцификации сосудов. Витамин D стимулирует синтез IGF-связывающих белков (IGFBP). IGF-связывающие белки продлевают период полураспада IGF, тем самым усиливая антиатеросклеротические эффекты этого фактора роста (рис. 1). Исследования показали, что витамин D усиливает транскрипцию генов IGFBP1, IGFBP3 и IGFBP5. Сывороточные уровни IGF-1 и IGFBP-3 были измерены у 96 пациентов с периферической болезнью артерий и у 89 добровольцев.
У пациентов с периферической болезнью артерий были найдены более низкие уровни белка IGFBP-3 (р<0,01), так что уровни IGFBP-3 действительно отражают активность атеросклеротического процесса [24].
Не менее интересно отметить, что витамин D активирует синтез белка PPAR-δ (активированный рецептор пролифераторов пероксисом, тип δ), способствующего переработке избыточного холестерина [25]. Белок PPAR-δ (рис. 2) активирует процессы β-окисления жирных кислот, т.е. активация синтеза PPAR-δ витамином D3 приводит к снижению интенсивности атеросклеротических процессов.
Исследование 2000 пациентов с ишемической болезнью сердца и здоровых лиц контрольной группы [26] показало, что полиморфизмы гена PPARD определяют уровни липидов в плазме и тяжесть атеросклероза сосудов сердца и, следовательно, влияют на формирование абдоминального ожирения. Таким образом, витамин D3 способствует активации нескольких важнейших факторов углеводного и липидного метаболизма.
Отметим особую роль воспаления в патогенезе ожирения и диабета. Витамин D – иммуномодулятор с широким спектром действия. Дефицит витамина D приводит к увеличению аутоиммунной агрессии вследствие нарушения регуляции Т-лимфоцитов [27]. Одним из механизмов этиопатогенетического воздействия витамина D на МС и диабет несомненно является нормализация процессов воспаления.
В культуре клеток поджелудочной железы 1,25-дигидроксивитамин D (1,25-(OH)2-D) тормозит экспрессию провоспалительных хемокинов и цитокинов в панкреатических островках. Торможение экспрессии хемокинов в β-клетках было связано со снижением заболеваемости диабетом [28]. Сравнение моноцитов у пациентов с СД2 с моноцитами здоровых и пациентов с СД1 показало, что моноциты пациентов с СД2 имели значительно более высокие уровни экспрессии провоспалительных интерлейкинов (ИЛ), фактора некроза опухоли-α, ИЛ-6, -1, -8, фермента циклооксигеназы-2, белков-маркеров воспаления (ICAM-1, B7-1) по сравнению с контрольной и группой пациентов с СД1; 1,25-(OH)2-D способствовал снижению экспрессии вышеназванных провоспалительных ИЛ [29].
Активированный рецептор VDR регулирует уровни белка-хемоаттрактанта моноцитов (MCP-1). Макрофаги скапливаются в клубочках почек пациентов с диабетической нефропатией в ответ на секрецию MCP-1. Метаболит витамина D 1,25-(OH)2-D блокирует гипергликемию, тормозя активацию провоспалительных NF-κB каскадов активации лимфоцитов. В культуре клеток высокий уровень глюкозы индуцирует транскрипцию гена MCP-1 через увеличение транскрипционных факторов p65/p50 сайтами связывания NF-κB в промоторе* гена MCP-1.
Метаболит 1,25-(OH)2-D стабилизирует белок IκBα, что приводит к торможению транслокации сигнального белка p65 из цитозоля в ядро клетки, блокировке транскрипции MCP-1 и, следовательно, торможению процессов воспаления [30].
Таким образом, фундаментальные исследования указали на многочисленные параллельные механизмы, посредством которых дефицит витамина D оказывает воздействие на патофизиологию МС и диабета (нарушения регуляции метаболизма углеводов и жиров, процессов воспаления и др.). Клинико-эпидемиологические исследования косвенно подтверждают эти выводы, сделанные в рамках фундаментальных исследований.
Эпидемиологические исследования связи дефицита витамина D и диабета
Проводимые в течение последних десятилетий эпидемиологические исследования предоставили неоспоримые свидетельства ассоциации между недостаточным потреблением витамина D, риском развития диабета и его осложнений.
Следует отметить, что в эпидемиологических исследованиях оценка нутрициальных факторов достаточно часто производится на основе опросников диеты. Опросники не всегда калибруются по уровням соответствующих метаболитов (например, активных форм витамина D, магния, цинка и др.) в плазме крови пациентов. Соответственно, использование только некалиброванных опросников снижает достоверность исследования.
В случае же эпидемиологических работ по взаимосвязи витамина D с риском диабета большинство исследований включило непосредственные измерения концентраций уровней витамина D, 25(OH)D, 1,25-(OH)2-D в плазме крови. Использование непосредственных измерений уровня метаболитов в плазме крови значительно повышает научную достоверность этих исследований. Заметим, что во всех цитируемых ниже крупномасштабных исследованиях оценивался риск развития СД2.
Важным результатом этих исследований стало и подтверждение низкого уровня витамина D в плазме как независимого фактора риска СД2. Например, в крупномасштабном исследовании NHANES (2003–2006) показано, что недостаточное потребление витамина D связано с повышенным риском такого серьезного осложнения СД2, как периферическая невропатия (ОР=2,12; 95% ДИ – 1,17–3,85). Достоверность ассоциации сохранялась после поправок на демографические факторы, ожирение и сопутствующие заболевания, в т.ч. диабет [31].
В рамках крупномасштабного исследования здоровья медсестер (Nurses’ Health Study, США) было проведено сравнение группы из 608 женщин с впервые выявленным СД2 и контрольной группы из 559 женщин без диабета. После корректировки на другие факторы риска более высокие уровни 25(OH)D в плазме крови были ассоциированы с более низким риском СД2. При сравнении подгруппы с самыми высокими уровнями 25(OH)D (более 33 нг/мл) с подгруппой с самыми низкими уровнями 25(OH)D (менее 14 нг/мл) риск СД2 снизился почти в 2 раза (ОР=0,52, 95% ДИ – 0,33–0,83) [32].
В выборке 1972 участников Фрамингемской когорты установлено 133 впервые выявленных случая СД2 в течение 7 лет наблюдений. По сравнению с лицами с самой низкой обеспеченностью (нижняя треть концентраций 25(OH)D) в начале исследования, риск развития СД2 среди участников в самой высокой трети концентраций 25(OH)D был на 40% выше после поправок на возраст, пол, ОТ, семейную историю СД2, артериальную гипертензию, низкий уровень ЛПВП, повышение уровня триглицеридов и повышенный уровень глюкозы натощак: р=0,60; 95% ДИ – 0,37–0,97; р=0,03) [33].
В популяционной когорте 2465 европейцев уровни 25(OH)D в сыворотке были низкими (<50 нмоль/л) у 29% и очень низкими (<37 нмоль/л) у 11% обследованных. После внесения поправок на пол, возраст, географический регион проживания, уровень образования, курение, ИМТ, физическую активность, общую калорийность питания, риск СД был значимо связан с более низкими уровнями 25(OH)D в плазме крови. Участники с уровнями 25(OH)D более 80 нмоль/л в два раза реже страдали СД (ОР=0,5; 95% ДИ – 0,3–0,9) по сравнению с участниками, имевшими низкие уровни 25(OH)D (менее 37 нмоль/л) [34].
В кросс-секционном исследовании когорты из 5787 корейцев (старше 20 лет, 2453 мужчины) диагноз СД2 ставился при уровнях глюкозы в плазме натощак более 7 ммоль/л; многие пациенты получали пероральные гипогликемические препараты или инсулин. По сравнению с лицами с достаточными уровнями 25(OH)D в сыворотке (более 75 нмоль/л) риск СД2 у обследованных с уровнями менее 25 нмоль/л был выше на 70% (ОР=1,73; 95% ДИ – 1,09–2,74), при этом наблюдалось дозозависимое изменение риска СД2 (р тренда<0,0001) [35].
В крупномасштабном австралийском исследовании когорта из 5200 участников наблюдалась в течение 5 лет. За тот период было установлено 199 новых случаев СД2. Пациенты с диабетом имели более низкие концентрации 25(OH)D в сыворотке (58 и 65 нмоль/л, р<0,001), а также более низкое суточное потребление кальция по диетарному опроснику (881 и 923 мг/сут, р=0,03). Увеличение уровня 25(OH)D на каждые 25 нмоль/л было связано с 24%-ным снижением риска развития диабета (ОР=0,76; 95% ДИ – 0,63–0,92) после поправок на возраст, ОТ, географический регион проживания, курение, физическую активность, семейную историю диабета, диетарное потребление магния, артериальную гипертензию и уровни триглицеридов [36].
Результаты мета-анализов эпидемиологических исследований
Выше были приведены результаты отдельных крупномасштабных клинико-эпидемиологических исследований. В то же время накопленный объем исследований приемлемого качества настолько высок, что, позволило провести ряд мета-анализов ассоциации между дефицитом витамина D в организме и риском метаболических нарушений (к которым относятся МС и СД1 и СД2).
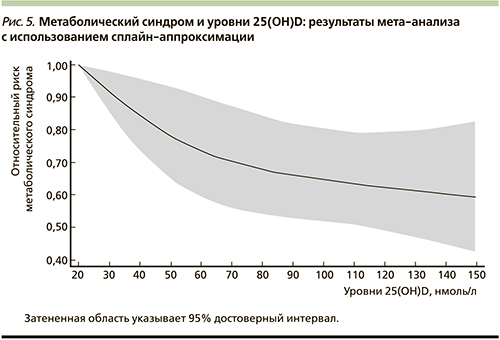
Мета-анализ 28 исследований (n=99 745) показал, что среди участников в квартиле с самыми высокими уровнями 25(OH)D в сыворотке отмечено снижение риска кардиометаболических расстройств (СД2 и МС) на 43% (ОР=0,57, 95% ДИ – 0,48–0,68; рис. 3) [37].
Мета-анализ 11 наблюдательных исследований (3612 случаев СД2, всего 59 325 участников) показал, что уровни 25(OH)D в самом высоком квартиле соответствовали снижению риска СД2 на 41% (ОР=0,59; 95% ДИ – 0,52–0,67) [38].
Более высокие уровни 25(OH)D в крови были ассоциированы со сниженным риском СД2. Мета-анализ 21 проспективного исследования в общей сложности включил 76 220 участников (4996 случаев СД2). В квартиле пациентов с самыми высокими уровнями 25(OH)D ОР СД2 составил 0,62 (95% ДИ – 0,54–0,70). Более высокие уровни 25(OH)D были ассоциированы с более низким риском развития СД вне зависимости от пола, продолжительности наблюдений, размера выборки или метода измерения концентраций 25(OH)D.
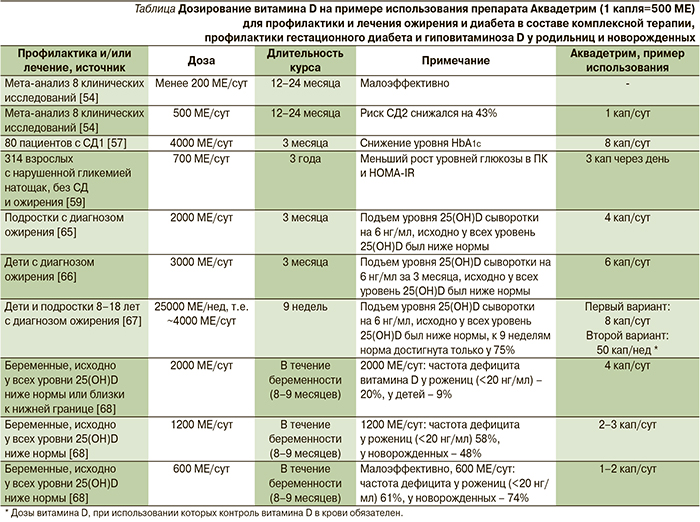
Увеличение уровней 25(OH)D на каждые 10 нмоль/л соответствовало снижению риска развития СД2 на 4% (95% ДИ – 3–6; р<0,0001; рис. 4) [39].
Мета-анализ 16 кросс-секционных исследований показал, что при увеличении уровней 25(OH)D в сыворотке/плазме крови на каждые 25 нмоль/л риск МС снижался на 13% (ОР = 0,87; 95% ДИ – 0,83–0,92, p<0,001; рис. 5) [40].
Мета-анализ 18 проспективных исследований суммарно включил 210 107 участников (15 899 пациентов с метаболическими расстройствами), наблюдаемых в среднем в течение 10 лет (95% ДИ – 3–22 года). Уровни 25(OH)D в верхней трети соответствовали снижению риска СД2 на 19% (ОР=0,81; 95% ДИ – 0,71–0,92), МС – на 14% (ОР = 0,86, 95% ДИ – 0,80–0,92) [41].
Низкие уровни витамина D во время беременности также были ассоциированы с повышенным риском гестационного диабета (ГСД). Мета-анализ 7 наблюдательных исследований (2146 участниц, 433 были диагностированы с ГСД) показал, что уровни 25(OH)D в сыворотке были значительно ниже у участников с ГСД (-5,33 нмоль/л; р=0,018). Сниженные уровни 25(OH)D<50 нмоль/л во время беременности достоверно ассоциированы с повышением риска ГСД на 61% (ОР=1,61; 95% ДИ – 1,19–2,17; р=0,002) [42].
О соответствии результатов доказательной и фундаментальной медицины
Принимая во внимание цитированные выше клинико-эпидемиологические данные, указывающие на неоспоримую связь между потреблением витамина D с пищей и уровнями витамина D в крови с риском развития диабета, следует подчеркнуть необходимость использования адекватного дизайна при проведении крупномасштабных исследований. Отсутствие правильного планирования и аккуратного выполнения исследования, как правило, приводит к т.н. нулевым и, естественно, недостоверным результатам. Часто исследования могут содержать грубейшие нарушения в их планировании, указывающие на очевидные пробелы в знании простейших фактов из области биологии (например, очевидная невозможность снижения уровней витамина D в крови при приеме препарата [43] и др.).
Например, в публикации [44] сообщается о предполагаемом отсутствии взаимосвязи между уровнями 25(OH)D в плазме крови и инцидентностью диабета 2 типа [44]. «Нулевой» результат данного исследования противоречит основному корпусу цитированных выше адекватных эпидемиологических исследований вследствие того, что исследование [44] отличается рядом пробелов дизайна, приведших к заявленному авторами ложнонегативному результату. Во-первых, данную работу отличает крайне неоднородная выборка пациентов. Во многом это обусловлено тем, что публикация [44] является побочным результатом т.н. Women’s Health Initiative (WHI), к основным задачам которого относятся изучение заболеваемости раком толстой кишки и молочной железы. Авторы также пренебрегли значительными расовыми и этническими различиями в исследованной когорте 5140 пожилых женщин (средний возраст – 66 лет).
Во-вторых, диагноз «диабет» не являлся верифицированным по медицинской карте, а был «диагностирован» по опроснику пациенток как положительный ответ на любой из трех вопросов: «Был ли Вам поставлен диагноз диабет?», «Используете ли Вы препараты инсулина?», «Используете ли Вы пероральные сахароснижающие средства?». Такого рода «облегченный» подход к верификации диагноза, конечно же, научно не обоснован.
В-третьих, что наиболее важно, в той же публикации [44] умалчивается о взаимосвязи таких общеизвестных факторов риска диабета, как избыточная масса тела, гиподинамия и т.д., с риском диабета. Принимая во внимание весьма неточную постановку «диагноза» в данном исследовании, отрицательный его результат [44] закономерен и еще раз подчеркивает необходимость ответственного отношения к дизайну и анализу биомедицинских данных [43, 45].
Витамин D, диабет и коморбидные патологии
Дефицит витамина D влияет не только на инцидентность диабета, но и на тяжесть протекания заболевания, и на риск летального исхода, и на сопутствующие патологии. У пациентов с СД2 тяжелая недостаточность витамина D соответствует повышению смертности. Наблюдения за группой из 289 пациентов (54±9 лет) в течение 15 лет показали, что смертность от всех причин была в 2 раза выше у пациентов с тяжелым дефицитом витамина D (ОР=2,03; 95% ДИ – 1,31–3,13) после поправок на длительность СД2 и общепринятые факторы сердечно-сосудистого риска [46].
Измерения 25(OH)D в группе из 1108 пациентов с СД2 на гемодиализе (66±8 лет, 54% мужчин, средний 25(OH)D в 39 нмоль/л) в течение 4 лет показали, что пациенты с тяжелым дефицитом витамина D (25(OH)D≤25 нмоль/л) характеризовались в 3 раза более высоким риском внезапной смерти (ОР=2,99; 95% ДИ – 1,39–6,40) по сравнению с пациентами, обеспеченными витамином D (уровни 25(OH)D – более 75 нмоль/л) [47].
Диабет и дефицит витамина D ассоциированы с развитием патологии почек. Альбуминурия указывает на прогрессирование диабетической нефропатии, сердечно-сосудистые осложнения диабета и соответствует повышению смертности. В когорте из 15 068 взрослых, участвовавших в исследовании NHANES, был установлен дозозависимый риск альбуминурии с уменьшением концентрации витамина D по квартилям: 8,9%, 11,5, 13,7 и 15,8% (от квартиля с самым высоким содержанием к квартилю с самым низким, р<0,001). С поправками на возраст, пол, расу/этническую принадлежность, регион, сезон измерения, курение, ИМТ, артериальное давление (АД), СД1 и СД2, ОР альбуминурии был почти на 40% выше в квартиле с самым низким содержанием витамина (ОР=1,37, 95% ДИ – 1,10–1,71; р=0,006) [48].
В когорте из 1705 взрослых с нормальной функцией почек на момент начала исследования производились измерения скорости клубочковой фильтрации (СКФ) в начале исследования и спустя 4 года. Быстрое падение СКФ (12 мл/мин на 1,73 м2 и более) наблюдалось у 207 (12%) участников. Снижение уровней 25(OH)D на каждые 10 нг/мл было ассоциировано с бо́льшим на 25% риском быстрого падения СКФ (95% ДИ – 5–49%; р=0,01) [49].
Отметим, что вследствие нарушения функционирования почек при диабете наблюдаются многочисленные нарушения минерального баланса. В частности, СД является фактором риска развития переломов костей [50], причем СД1 связан с уменьшением минеральной плотности кости, в то время как в случае СД2 наблюдается снижение качества костной ткани из-за снижения сывороточных уровней IGF-1, гиперкальциурии, нарушений функции почек, микроангиопатии и воспаления [51]. Клинические испытания подтверждают тот факт, что формирование и архитектоника кости значительно ухудшаются при обоих типах диабета [52].
В рамках известного исследования здоровья медсестер (Nurses’ Health Study) 109 983 женщины в возрасте 34–59 лет наблюдались в течение 12 лет. За время наблюдений у 1398 женщин произошел перелом бедренной кости. После внесения поправок на ИМТ, курение, физическую активность, менопаузальный статус, ежедневное потребление кальция, витамина D, белка и др. риск перелома у лиц с СД1 возрастал в 6 раз (ОР=6,4; 95% ДИ – 3,9–10,3), с СД2 – в 2 раза (ОР=2,2; 95% ДИ – 1,8–2,7) [53].
Клинические исследования препаратов витамина D для профилактики и лечения диабета
Эпидемиологические исследования, в которых производилась оценка суточного потребления пациентами витамина D, представляют собой косвенную доказательную базу эффективности использования витамина при диабете. К сожалению, к настоящему времени проведено всего лишь несколько адекватно спланированных рандомизированных исследований по использованию препаратов витамина D в профилактике и терапии СД1 и СД2.
В мета-анализе 8 клинических исследований потребление витамина D в дозе 500 МЕ/сут и более соответствовало снижению риска развития СД2 на 13% по сравнению с потреблением витамина D менее 200 МЕ/сут. Участники, имевшие уровни витамина D более 25 нг/мл, характеризовались на 43% меньшим риском развития СД2 по сравнению с участниками с низкими уровнями витамина (<14 нг/мл) [54].
В исследовании Nurses’ Health Study с участием 83 779 женщин без истории диабета, сердечно-сосудистых заболеваний или рака в течение 20 лет наблюдений было зарегистрировано 4843 случая СД2. При оценке опросника диеты было установлено, что комбинированный прием >1200 мг/сут кальция и >800 МЕ/сут витамина D был на 33% связан с более низким риском развития СД2 по сравнению с потреблением <600 мг/сут кальция и <400 МЕ/сут витамина D [55].
В группе из 92 обследованных с высоким риском развития СД2 (средний возраст – 57 лет, ИМТ – 32 кг/м2, HbA1c – 5,9%), краткосрочное (в течение 16 недель) применение холекальциферола приводило к достоверному увеличению секреции инсулина (62±39 по сравнению с -36±37 мЕД/л/мин в контрольной группе; р=0,05) [56]. Восемьдесят пациентов с СД1, имевших уровни 25(OH)D на уровне менее 50 нмоль/л, получали 4000 МЕ/сут витамина D3 и 1200 мг/сут кальция в течение 12 недель. Наблюдалась положительная динамика по снижению уровней HbA1c (р=0,001) [57].
Несмотря на проведение терапии ингибиторами ренин-ангиотензин-альдостероновой системы, пациенты с СД характеризуются повышенным риском развития прогрессирующей почечной недостаточности, приводящей к повышению альбуминурии.
В исследовании 281 пациента с диабетической нефропатией показано, что использование одного из производных витамина D (парикальцитола, 1–2 мкг/сут) способствует снижению альбуминурии. Пациенты были рандомизированы на получение плацебо (n=93), 1 мкг парикальцитола (n=93) или 2 мкг парикальцитола (n=95) в течение 24 недель. Прием 2 мкг парикальцитола способствовал снижению отношения альбумина к креатинину на -28% (р=0,014 по сравнению с плацебо) [58].
В двойном слепом рандомизированном исследовании группы из 314 взрослых пациентов, не страдавших диабетом, участники получали либо 500 мг/сут цитрата кальция и 700 МЕ/сут витамина D, или плацебо ежедневно в течение 3 лет. Среди участников с нарушенной гликемией натощак на момент начала исследования те, кто принимал кальций и витамин D, характеризовались меньшим ростом уровней глюкозы в плазме крови натощак (+0,02 ммоль/л, т.е. +0,4 мг/дл) по сравнению с группой плацебо (+0,34 ммоль/л, а в группе плацебо +6,1 мг/дл, p=0,042) и менее интенсивным ростом гликемического индекса HOMA-IR (+0,05 и +0,91 в группе плацебо, р=0,031) [59].
Даже сравнительно низкие дозы витамина, принимаемые в течение длительного времени, могут способствовать нормализации липидного профиля. Прием 400 МЕ/сут витамина D +1000 мг Са в течение 2 лет женщинами в постменопаузе (n=600) приводил к увеличению уровней 25(OH)D3 в сыворотке крови – 24,3 нг/мл, а в группе плацебо – 18,2 нг/мл. Отмечено снижение уровня липопротеидов низкой плотности на -4,46 мг/дл (р=0,03), повышение уровней ЛПВП (р=0,003), более низкие уровни триглицеридов (р<0,001) [60].
Сравнение 170 детей (5–16 лет) с СД1 с контрольной группой из 170 здоровых детей указало на значительное снижение уровней витамина D у пациентов с СД1 (р = 0.009; Bener, 2008). Мета-анализ данных 5 исследований случай–контроль показал, что риск СД1 был значительно уменьшен у грудных детей, получавших добавки с витамином D, по сравнению с таковыми, не получавшими добавок витамина D (ОР=0,71; 95% ДИ – 0,60–0,84). В исследовании был отмечен отчетливый дозозависимый эффект [61].
Когорта из 10 366 новорожденных наблюдалась в течение года, за это время был зарегистрирован 81 случай диабета. Регулярные дотации витамина D соответствовали снижению риска развития СД1 даже после введения поправок на ряд антропометрических и социальных факторов. Дети, потреблявшие рекомендованную дозу витамина D (2000 МЕ/сут), характеризовались 5-кратным снижением риска заболевания (ОР=0,22; 95% ДИ – 0,05–0,89) [62].
Прием витамина D в раннем детстве связан с риском развития СД1. Мета-анализ 5 наблюдательных исследований показал, что риск СД1 достоверно был снижен на 29% у пациентов, получавших витамин D в младенческом возрасте (ОР=0,71; 95% ДИ – 0,60–0,84) [63]. Последующий мета-анализ 8 наблюдательных исследований эффектов потребления витамина D в раннем возрасте подтвердил полученные результаты [64].
О дозировке витамина D для профилактики и терапии ожирения, глюкозотолерантности, диабета
В различных странах рекомендуемое суточное потребление витамина D составляет 400, 600 МЕ/сут для взрослых. В настоящее время ведется активное обсуждение необходимости повышения суточной дозировки витамина D. В частности, клинические исследования показывают, что для терапии ожирения и диабета могут быть эффективными дозы не менее 2000, 4000 МЕ/сут.
Прием витамина D3 (2000 МЕ/сут, 12 недель) или плацебо в группе подростков с ожирением приводило к достоверному повышению 25(OH)D сыворотки на +6 нг/мл (р<0,001) [65]. Курсовой прием витамина (3000 МЕ/сут, 12 месяцев) увеличивал уровни адипонектина (р<0,02) в группе детей с ожирением и дефицитом витамина D (<15 нг/мл). [66]. Прием добавок витамин D3 (25000 МЕ/нед, 9 недель, т.е. ~4000 МЕ/сут) в группе детей 8–18 лет, страдающих ожирением (n=109) и с дефицитом витамина D (<50 нмоль/л). После 9 недель приема дефицит витамина был установлен только для 25% пациентов, терапия не имела никаких побочных эффектов [67].
Сравнение эффектов ежедневного приема 600 МЕ/сут (группа 1), 1200 (группа 2) и 2000 МЕ/сут (группа 3) в группе 91 беременной женщины в течение всей беременности показало существенно более высокую эффективность дозировки – в 2000 МЕ/сут. Частота дефицита витамина D (<20 нг/мл) составила 20% в группе 3, 58% – в группе 1 и 61% – в группе 2 (р=0,03). Среди новорожденных дефицит был установлен только у 9% участников в группе 3, у 74% – в группе 1 и у 48% – в группе 2 (р=0,006). Таким образом, по крайней мере 2000 МЕ/сут витамина D необходимо для обеспечения надлежащего статуса витамина D во время беременности и раннего младенчества [68].
Пациенты с повышенным риском диабета (HbA1c – 5,8–6,9%) и недостаточностью витамина D (25(OH)D<30 нг/мл) были рандомизированы для еженедельного получения витамина D (88 865 МЕ/нед, n=56) или плацебо (n=53) в течение 12 месяцев. Средние уровни 25(OH)D возросли с 22 до 70 нг/мл уже через 3 месяца после начала приема витамина D. Через 12 месяцев уровни HbA1c были достоверно меньше (-0,2%) в группе пациентов, принимавших витамин D [69].
Следует подчеркнуть, что использование однократных мегадоз витаминов является опасной практикой, которая к тому же не всегда эффективна.
В рандомизированном исследовании 61 участник с СД2 получал однократную дозу витамина D в количестве 100 тыс. или 200 тыс. МЕ [70]. Помимо того что использование столь высоких доз витаминов считается с этической точки зрения «экспериментированием на людях» (Громова, Торшин, 2011, «Между Сциллой и Харибдой») [71], в исследовании [72] не наблюдалось никаких улучшений состояния пациентов: ни функции эндотелия, ни резистентности к инсулину, ни уровней HbA1c. Долговременное поддержание оптимальной физиологической дозы витамина D – наилучшая физиологическая стратегия.
Заключение
В расплату за вестернизацию питания и малоподвижный нездоровый образ жизни возрастает груз т.н. болезней цивилизации. Распространенность СД и ожирения продолжает расти во всем мире, захватывая лиц все более молодого возраста. Хотя избыточная масса тела служит преобладающим фактором в патогенезе СД, другие модифицируемые факторы риска (избыточное потребление углеводов и насыщенных жиров, дефициты микронутриентов, гиподинамия, употребление алкоголя, курение и др.) не менее важны. Среди микронутриентных факторов, значительно влияющих на риск развития диабета, следует особо выделить дефицит витамина D [71].
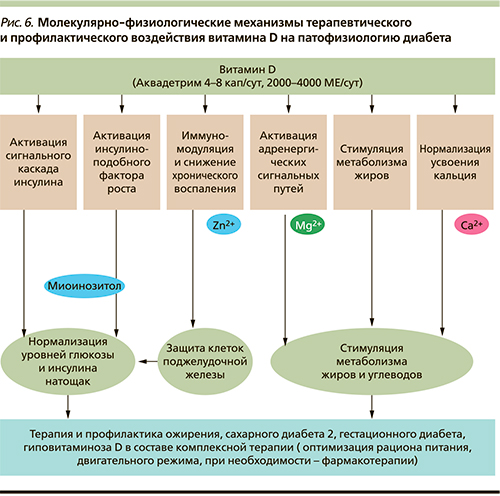
В заключение процитируем высказывание одного французского педиатра (Arch Pediatr 2010; 17(6):810): «Мы думали, что все уже было сказано о витамине D, но дефицит все еще существует и влияет не только на рост костей» [72]. Действительно, витамин D характеризуется широким спектром воздействия на молекулярную физиологию клеток и тканей. Приведенные в настоящей работе данные биоинформационного анализа указывают на многочисленные свидетельства из различных смежных областей современных биологии и медицины, подтверждающие целесообразность использования витамина D для терапии и в профилактике диабета (рис. 6). Результаты настоящего исследования также показывают, что целесообразно исследовать микронутриентные синергисты витамина D (например, магний, цинк и др.) в отношении регуляции уровней глюкозы и риска возникновения СД.
Для профилактики ожирения и СД витамин D следует принимать в дозах 2000, 4000 МЕ/сут от 3 месяцев. Возможен вариант использования эффективной и безопасной водорастворимой формы витамина D3 Аквадетрим по 4, 8 капель (1 капля=500 МЕ; 2=1000 МЕ, 4=2000 МЕ, 6=3000 МЕ, 8 капель=4000 МЕ) ежедневно (см. таблицу).
Данный препарат характеризуется безупречной фармакологической историей применения детьми и подростками, беременными и кормящими, а также взрослыми. Аквадетрим является препаратом выбора для компенсации гиповитаминоза D у пациентов с нарушениями всасывания витамина D (пациентов с болезнью Крона, муковисцидозом), нарушениями жирового обмена (стеатогепатитом). Препарат рекомендуется употреблять во время завтрака или обеда по 4–8 капель с водой. При лечении ожирения препарат Аквадетрим следует принимать с достаточным количеством питьевой водой (150, 250 мл), т.к. достаточная нагрузка чистой питьевой водой – обязательное условие нормализации массы тела.



