Введение
Дилатационная кардиомиопатия, как и миокардиты, относится к числу сложных с диагностической точки зрения заболеваний, окончательная верификация которых базируется на эндомиокардиальной биопсии и магнитно-резонансной томографии, пока еще недоступных для обычных кардиологических клиник [1, 2], поэтому накопленный клинический опыт ведения таких пациентов представляется интересным и может быть полезным для кардиологов и врачей других специальностей в их практической деятельности.
Перипартальная кардиомиопатия (ПКМ) как один из вариантов дилатационной кардиомиопатии развивается у женщин в последние месяцы беременности либо в течение 5 месяцев после родоразрешения. С момента появления в кардиологии понятия ПКМ, описанной впервые в 1971 г. Demakis et al. [3], произошло накопление достаточно большого объема информации. Определены диагностические критерии ПКМ [4, 5], получены результаты отдаленного наблюдения за пациентками и выработаны рекомендации по эффективной и безопасной терапии [5]. Статистические данные по ПКМ в России отсутствуют. Согласно мировой статистике, патология встречается менее чем у 0,1% беременных женщин [6], однако частота неблагоприятных исходов при ПКМ достаточно высока (5–32%) [6]. Прогноз заболевания предсказать достаточно сложно – от полного выздоровления с восстановлением сократительной способности миокарда до летальных исходов на фоне прогрессирующей сердечной недостаточности [7], противоречивыми остаются сведения об этиологии и патогенезе ПКМ.
Ниже представлен клинический случай пациентки П. 37 лет, которая наблюдается в отделении кардиологии № 1 Областной клинической больницы (ОКБ) города Саратова в течение 10 лет.
Клинический случай
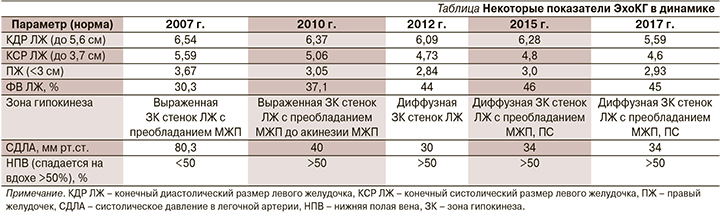
В декабре 2007 г. на 20-й неделе беременности пациентка П. (на тот момент 28 лет) отметила появление одышки смешанного характера при ходьбе до 20 м, сердцебиение, утомляемость. Данные симптомы связала с присоединением ОРВИ (отмечала субфебрилитет, гриппоподобный синдром). Лечилась самостоятельно (по образованию врач-лаборант), в основном народными средствами. Однако впоследствии, несмотря на нормализацию температуры тела, симптомы сохранились, а к 34-й неделе беременности одышка стала беспокоить уже в покое, ночью и в горизонтальном положении, усиливалась при незначительной физической активности, появились сухой кашель, отеки нижних конечностей, продолжалось сердцебиение. Госпитализирована в перинатальный центр Саратова, где проведено родоразрешение путем кесарева сечения. Данные трансторакальной эхокардиографии (ЭхоКГ), выполненной в перинатальном центре, представлены в первом столбце таблицы. Через 13 суток после кесарева сечения пациентка переведена для дальнейшей диагностики и лечения в кардиологическое отделение № 1 ОКБ Саратова, где и продолжает наблюдаться в динамике.
Данные объективного осмотра пациентки: рост – 163 см, вес – 68 кг, индекс масса тела – 26 кг/м2. Температура тела – 36,6°C. Отеков на нижних конечностях нет. Одышка смешанного характера при ходьбе на 20 метров. Перкуторно определялось смещение левой границы сердца на 1,5 см кнаружи от срединно-ключичной линии. При аускультации тоны сердца ослабленные, систолический шум на верхушке, связанный с I тоном, убывающий, занимает 2/3 систолы, усиливается на выдохе, проводится в подмышечную область, акцент II тона над легочной артерией. Частота сердечных сокращений – 120 в минуту. Арте-риальное давление – 100 и 80 мм рт.ст.
Оценка клинических проявлений и результатов ЭхоКГ, а также хронология развития выявленных гемодинамических нарушений на фоне беременности отчетливо продемонстрировали, что, согласно полученным данным, соответствовавшим диагностическим критериям ПКМ [4, 5], у пациентки выявлена именно эта патология. Внимание кардиологов привлекали высокие величины некоторых острофазовых показателей (ревматоидный фактор – РФ, С-реактивный белок – СРБ), при этом маркеры некроза миокарда были в норме (КФК – 18,3 ЕД/л, КФК-МВ – 8,1 ЕД/л, тропонины – I,T отрицательные). Повышение показателей СРБ и РФ вызывало сомнение в правильности постановки диагноза, т.к. могло свидетельствовать об инфекционном либо ревматическом процессе. При этом отрицательные маркеры некроза миокарда, повышение уровня которых в большинстве случаев сопровождает миокардиты, вызывали сомнения в плане воспалительного характера поражения миокарда и в большей степени свидетельствовали в пользу наличия кардиомиопатии. Для исключения ревматического процесса дополнительно были исследованы следующие показатели: антистрептолизин О, LE-клетки, антитела к ДНК (класс IgG), циркулирующие иммунные комплексы (ЦИК), результаты оценки которых были отрицательными. В ходе консилиума в составе ревматологов диагноз ревматического поражения сердца был исключен.
Следует отметить, что, по данным, накопленным в литературе к настоящему времени, значительная роль в патогенезе ПКМ у пациенток с данной патологией отводится воспалительному компоненту, что подтверждается повышением таких показателей, как фактор некроза опухоли α, интерферон γ, интерлейкин-6, apo-1, СРБ [8]. Таким образом, в нашем клиническом случае повышение ряда острофазовых показателей укладывалось в клиническую картину ПКМ.
Определенный интерес представляют взаимоотношения ПКМ и миокардита. После исключения у пациентки ревматического процесса у кардиологов оставалась версия об инфекционном миокардите, который мог развиться на фоне ОРВИ, указание на которую имеется в анамнезе пациентки.
Клинические и патогенетические взаимоотношения ПКМ и миокардита не до конца ясны и служат предметом дальнейшего изучения. С одной стороны, у больных ПКМ описана патоморфологическая картина некроза кардиомио-цитов на фоне интерстициального и периваскулярного воспаления [9]. Есть данные, что миокардит часто предшествует развитию ПКМ [10] и имеет высокую распространенность среди пациенток на фоне этого заболевания (от 29 до 100%) [11]. Другие авторы указывают на достаточно редкое сочетание ПКМ и миокардита [12, 13]. В случае нашей пациентки судить о первичном развитии миокардита, предшествовавшего ПКМ, сложно, для этого необходимы высокоинформативные визуализирующие методы обследования.
В любом случае наблюдение пациентки П. в динамике демонстрирует сохранение стойкой дисфункции миокарда левого желудочка и в развитии хронической сердечной недостаточности, требующей соответствующей симптоматической терапии.
Объем терапии, проведенной пациентке в стационаре: торасемид 10 мг в сутки, спиронолактон 100 мг в сутки, периндоприл 4 мг в сутки, карведилол 12,5 мг в сутки, ивабрадин 10 мг в сутки. На амбулаторный этап больная была выписана с рекомендациями продолжить данную терапию в полном объеме.
Спустя 3 месяца (март 2008 г.) пациентка поступила в отделение кардиологии № 1 повторно. Отмечена нормализация всех острофазовых показателей, которые оставались в пределах нормы и при последующих госпитализациях, при этом сохранялась систолическая дисфункция миокарда по данным ЭхоКГ.
С 2009 по 2017 г. пациентка ежегодно проходила обследование и лечение в кардиологическом отделении № 1 ОКБ Саратова. На рисунке представлен анализ жалоб и симптомов пациентки по некоторым годам госпитализаций. Остановиться следует на присоединении с 2008 г. перебоев в работе сердца, которые, по результатам ЭКГ и холтеровского мониторирования ЭКГ, были обусловлены частыми полиморфными желудочковыми экстрасистолами. Сохранение экстрасистолии в динамике на фоне постоянного приема β-адреноблокаторов потребовало усиления антиаритмической терапии, назначался амиодарон, эффект от которого был положительным, однако у пациентки были выявлены его побочные эффекты в виде фотосенсибилизации, кожной сыпи, в связи с чем в дальнейшем пациентке был назначен этацизин 100 мг/сут. С 2011 г. у больной регистрируется дислипидемия (общий холестерин до 5,5 ммоль/л, липопротеиды низкой плотности 4,0 ммоль/л, липопротеиды высокой плотности – 1,8 ммоль/л, триглицериды – 0,7 ммоль/л, индекс атерогенности – 3,4). Рекомендована гипохолестериновая диета, которой пациентка старалась придерживаться около 5 лет, в настоящее время рассматривается вопрос о назначении статинов. Динамика данных ЭхоКГ представлена в таблице.
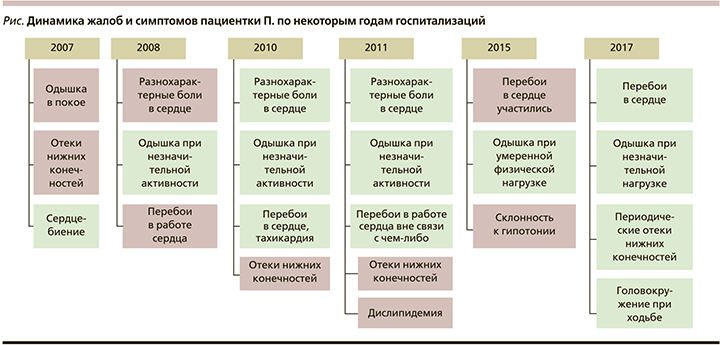
Основные симптомы и данные ЭхоКГ на момент последней плановой госпитализации пациентки П. (37 лет) в августе 2017 г. представлены в таблице и на рисунке. Пациентка продолжает постоянный прием ингибиторов ангиотензинпревращающего фермента (периндоприл 2,5 мг в сутки), β-адреноблокаторов (карведилол 25 мг в сутки), спиронолактона 50 мг в сутки, этацизина 100 мг в сутки. Продолжает свою трудовую деятельность. Инвалид 3-й группы. Одышка беспокоит только при ходьбе на 300–400 метров. Перебои в работе сердца беспокоят значительно реже (по данным холтеровского мониторирования ЭКГ: редкие наджелудочковые и желудочковые экстрасистолы). Госпитализируется в отделение кардиологии 1 раз в год. Следует отметить, что, будучи медицинским работником, пациентка демонстрирует высокую приверженность проводимой терапии, что является немаловажным фактором в достижении определенных положительных результатов лечения.
Обсуждение
ПКМ остается редкой, но вызывающей серьезные опасения экстрагенитальной патологией. Выздоровление при ПК, согласно данным литературы, определяется как восстановление фракции выброса левого желудочка (ФВ ЛЖ), по данным ЭхоКГ – до ≥50%, или повышение ее более чем на 20% по сравнению с исходным значением [14]. Восстановление сократительной способности миокарда у пациенток с ПКМ обычно происходит в сроки от 3 до 6 месяцев, но может затянуться на несколько лет [15]. Ряд факторов обусловливает задержку восстановления миокарда при ПКМ: отсроченная диагностика, высокий класс недостаточности кровообращения по NYHA, принадлежность к негроидной расе, тромбы в полости левого желудочка, мультипаритет, сопутствующая патология [16–18].
В двухлетнем когортном исследовании 123 пациенток с ПКМ ФВ ЛЖ возросла с 28 до 46%, около половины больных достигли значений >50,5% [19]. Прирост сократительной способности миокарда был наибольшим при базовом уровне ФВ ЛЖ >30%, и наименьшим при конечном диастолическом размере ЛЖ (КДР ЛЖ) >5,6 см [19]. Худший прогноз в плане восстановления миокарда отмечен у пациенток с исходным повышением уровней тропонинов и СРБ [8]. Пациенткам с ПКМ не рекомендована повторная беременность даже при полном восстановлении миокарда, т.к. патология имеет тенденцию к рецидивам [14].
Исходное значение КДР ЛЖ, составившее у нашей пациентки 6,54 см, высокий уровень СРБ, одышка в покое в дебюте заболевания ассоциированы с худшим прогнозом в плане восстановления насосной функции миокарда. Действительно, в приведенном нами клиническом наблюдении прирост сократительной способности миокарда левого желудочка происходил медленно – в течение 5–8 лет (см. рисунок). Не исключено, что определенное негативное влияние на темпы восстановления сердечной мышцы оказало развитие нарушения ритма – полиморфной желудочковой экстрасистолии и последующее присоединение гипотонии, приведшее к снижению эффективных доз препаратов, влияющих на ремоделирование миокарда.
Пациентку П. невозможно отнести к категории полностью выздоровевших от ПКМ, т.к. ФВ ЛЖ не достигла 50%, а прирост ее в динамике составил 15%. Однако, несмотря на предикторы неблагоприятного исхода, развитие нарушения ритма и гипотонии, приведенный клинический случай можно считать примером успешного ведения больной с данной патологией. На фоне проведенной медикаментозной терапии достигнуты стабилизация гемодинамики, существенное увеличение ФВ ЛЖ, уменьшение размеров полостей сердца.
Заключение
В настоящее время некоронарогенные заболевания миокарда продолжают привлекать внимание исследователей и остаются одними из наиболее сложно диагностируемых патологий в кардиологии. Дальнейшее изучение и накопление данных о ПКМ должно способствовать разработке унифицированных, доступных для большинства клиник стратегий диагностики и лечения этого заболевания и поможет спасти жизни многим пациенткам.


