Несмотря на достигнутые в последние десятилетия успехи в профилактике и лечении ишемической болезни сердца (ИБС), оптимизация терапии этого заболевания и его осложнений остается одной из наиболее актуальных проблем современной кардиологии [1]. Распространенность ИБС высока и достигает 10 % среди взрослого населения, а у лиц пожилого возраста – 20 % и более [2]. Существенная медикосоциальная значимость проблемы связана с жизнеопасными осложнениями ИБС – инфарктом миокарда (ИМ), внезапной коронарной смертью, сердечной недостаточностью и аритмиями. Частота их развития значительно превышает ожидаемую от внедрения современных схем медикаментозного и кардиохирургического лечения [1]. В связи с этим не прекращается поиск способов улучшения продолжительности и качества жизни больных ИБС, в т. ч. направленных на оптимизацию метаболических процессов в миокарде [1]. В последние годы применение фармакологических препаратов с метаболическим механизмом действия становится важной составляющей терапии острой и хронической форм ИБС. Проводятся попытки стандартизированного внедрения в медицинскую практику препаратов кардиопротекторов – средств, в условиях ишемии призванных устранять нарушения клеточного метаболизма, способствовать восстановлению ионного гемостаза и функции мембран кардиомиоцитов (КМЦ), предупреждать развитие необратимых процессов в клетках миокарда [3]. Эта группа препаратов еще активно изучается, однако уже сейчас занимает определенное место в схемах лечения сердечно-сосудистых заболеваний. Одними из важных преимуществ использования метаболических препаратов являются малая частота нежелательных гемодинамических реакций, хорошая переносимость пациентами всех возрастных групп, что делает их применение особо привлекательным для больных пожилого и старческого возраста. Такие пациенты более чувствительны к возникновению серьезных нежелательных явлений и негативных лекарственных взаимодействий [4], часто приводящих к «гемодинамической нестабильности». Развитие хронической сердечной недостаточности (ХСН) у пожилых и стариков на полиморбидном фоне носит мультифакториальный характер [5] и связано не только с ИБС, но и с наличием артериальной гипертензии (АГ), кардиомиопатий дисметаболического, дисгормонального генеза, сочетаясь с другими сосудистыми заболеваниями.
Президент Европейского общества кардиологов (ЕОК) Р. Феррари сформулировал критерии применения метаболической (кардиопротектороной или кардиоцитопротекторной) терапии, согласно которым это лечение способствует “выживаемости” КМЦ в условиях ишемии (гипоксии) [6]. Такой терапевтический эффект не связан с гемодинамической разгрузкой миокарда (как при применении нитратов) или с перестройкой нейроэндокринной системы (как при действии β-адреноблокаторов, ингибиторов ангиотензинпревращающего фермента и ряда других препаратов).
В нормальных условиях основными субстратами для выработки энергии в КМЦ служат свободные жирные кислоты, окисление которых обеспечивает 60–80 % синтеза АТФ, а также глюкоза, обеспечивающая 20–40 % синтеза АТФ. При развитии миокардиальной ишемии недостаток кислорода приводит к изменению метаболизма КМЦ, сопровождается существенным нарушением образования, транспортирования и потребления АТФ с сопутствующим повреждением молекулярных структур клетки [7]. Гипоксия в миокарде нарушает утилизацию жирных кислот, в митохондриях накапливаются ацетил-КоA и ацилированный карнитин, угнетающие функцию внутриклеточных структур. Возникающий клеточный ацидоз, локальное воспаление и пероксидация, нарушение ионного равновесия, уменьшение синтеза АТФ приводят к развитию электрофизиологических и функциональных нарушений в миокарде [1, 8]. Коррекцию этих нарушений посредством более эффективного расходования кислорода КМЦ в условиях ишемии считают оптимальным эффектом метаболической терапии [7].
В отечественной медицине успешно применяют несколько препаратов с кардиопротекторными свойствами, на практике успешно доказавших свою клиническую эффективность. Наиболее часто применяемыми препаратами в России являются этилметилгидроксипиридина сукцинат, мельдоний, Актовегин, Цитохром С, триметазидин, фосфокреатин. Однако в связи с отсутствием доказательной базы, полученной путем принятых международными медицинскими сообществами правил проведения клинических испытаний (GCP – Good Clinical Practice), их использование не включено в стандарты лечения пациентов с ХСН и аритмиями. Следует отметить, что из корректоров метаболизма только триметазидин фирмы “Сервье” рекомендован ЕОК и Комитетом экспертов Всероссийского научного общества кардиологов (ВНОК) в качестве средства лечения ХСН. Убедительных доказательств эффективности применения метаболических препаратов в лечении ХСН до сих пор не получено, впрочем как и свидетельств их негативных влияний, поэтому в настоящее время триметазидин рекомендуют назначать только дополнительно к основным средствам лечения декомпенсации ХСН [9]. Большой интерес в лечении ХСН, по мнению экспертов ВНОК, вызывают также перспективы применения препарата коэнзима Q10 (кофермент Q10), показавшего свою эффективность в уже проведенных исследованиях [9]. Однако убедительные доказательства применения любых препаратов метаболической группы будет возможно получить только после проведения широкомасштабных клинических испытаний.
Единой классификации средств с метаболическими свойствами нет, и в настоящее время она является условной. Одна из наиболее используемых классификаций разделяет препараты по механизму действия на средства прямого (уменьшают выраженность влияния патогенных факторов на КМЦ) и непрямого действий (уменьшают нагрузку на миокард) [7].
По механизму действия метаболических препаратов выделяют следующие группы:
- антиоксиданты – защищают клетки организма от токсических воздействий, в частности в КМЦ предотвращают или замедляют перекисное окисление липидов. Представителями этой группы являются кофермент Q10, метилэтилпиридинол, этилметилгидроксипиридина сукцинат;
- цитопротекторы – препараты, улучшающие утилизацию кислорода миокардом в условиях ишемии. Представителем данной группы является триметазидин;
- антигипоксанты — препараты, которые повышают устойчивость органов и тканей к гипоксии, а также улучшают утилизацию организмом кислорода. Представителями являются Актовегин, полидигидроксифенилентиосульфонат натрия, а также препарат Цитохром С. Цитохром С (ЦХ-С) – метаболическое средство, мембранопротектор оказывает антигипоксическое, энерготропное действия, стимулирует пластические процессы в организме, является катализатором клеточного дыхания, стимулирует окислительные реакции и тем самым активирует обменные процессы, уменьшает гипоксию тканей [10]. ЦХ-С с 1990-х гг. успешно используется в отечественной клинической практике при лечении кардиологических больных, однако доказательная база его применения при ХСН и нарушениях ритма сердца до настоящего времени недостаточна.
Большим недостатком начала стандартизированного применения разнообразных средств групп метаболических препаратов, в т. ч. ЦХ-С, является также отсутствие сравнительных исследований по рациональному выбору того или иного средства при той или иной клинической ситуации.
Цель исследования: изучить клиническую, антиаритмическую и противоишемическую эффективность препарата ЦХ-С в отношении пациентов с нарушениями ритма при ХСН на госпитальном этапе лечения и в течение полугода постгоспитального периода в отношении развития у них сердечно-сосудистых событий (повторная госпитализация, острый ИМ, острое нарушение мозгового кровообращения – ОНМК, смерть).
Материал и методы
Исследование проводилось с 2010 по 2013 г. на базе кардиологического отделения Санкт-Петербургской клинической больницы РАН.
Критерии включения: перенесенный в прошлом ИМ, процедуры реваскуляризации (не ранее чем 4 месяца до рандомизации), острый коронарный синдром, нестабильная стенокардия (не менее чем за 2 месяца до начала лечения), ишемия миокарда, подтвержденная хотя бы одним достоверным положительным тестом с физической нагрузкой (стресс-ЭХО, однофотонная эмиссионная компьютерная томография, позитронно-эмиссионная томография), гемодинамически значимые стенозы венечных сосудов, по данным коронароангиографии, наличие аритмий (пароксизмальная и персистирующая формы фибрилляции предсердий, желудочковая экстрасистолия 3–4-й градаций по Ryan), сердечная недостаточность (СН) I–II функциональных классов (ФК).
Критерии исключения: застойная сердечная недостаточность III и IV ФК (по классификации NYHA), выраженное гемодинамически значимое поражение митрального и аортального клапанов ревматической этиологии, величина скорости клубочковой фильтрации (СКФ) менее 30 мл/мин/1,73 м2.
Были рандомизированы 60 пациентов в возрасте 52–87 лет (средний возраст – 69,5 года). Перед включением в исследование всеми пациентами была достигнута стабилизация клинического состояния на фоне терапии β-адреноблокаторами, ингибиторами АПФ, диуретиками, антагонистами кальциевых каналов, сердечными гликозидами в индивидуально подобранных дозах. В процессе стационарного исследования данная терапия была стабильной. Пациенты методом слепой выборки были разделены на две группы – основную и контрольную.

К основной группе был отнесен 31 человек, получавший ЦХ-С в дозе 20 мг/сут; препарат вводили внутривенно капельно в 200 мл изотонического раствора натрия хлорида ежедневно по 20 мг, курс лечения составил 10 дней. В контрольную группу вошли 29 человек, получавших внутривенно капельно 10 мл 10 %-ного калия хлорида и 5 мл 25 %-ного раствора магния сульфата в 200 мл изотонического раствора хлорида натрия.
Всем пациентам проведено комплексное клинико-лабораторное обследование, которое включало оценку жалоб, сбор анамнеза, изучение объективного статуса, оценку антропометрических данных (рост, масса тела, окружность талии, индекс массы тела – ИМТ).
Пациентам были проведены следующие исследования: клинический и биохимический анализы крови (определение концентрации в сыворотке крови глюкозы, билирубина, калия, натрия, хлора, отдельных показателей липидограммы, креатинина с последующим расчетом величины СКФ по формуле Кокрофта–Голта, активности аланинаминотрансферазы – АЛТ, аспартатаминотрансферазы – АСТ, креатинфосфокиназы – КФК, γ-глутамилтранспептидазы – ГГТП, щелочной фосфатазы). Биохимические исследования сыворотки крови проведены утром натощак после 12-часового голодания.
Для определения функционального состояния сердечно-сосудистой системы пациентов и оценки толерантности к физической нагрузке проведен тест 6-минутной ходьбы (дистанция пройденной ходьбы в метрах).
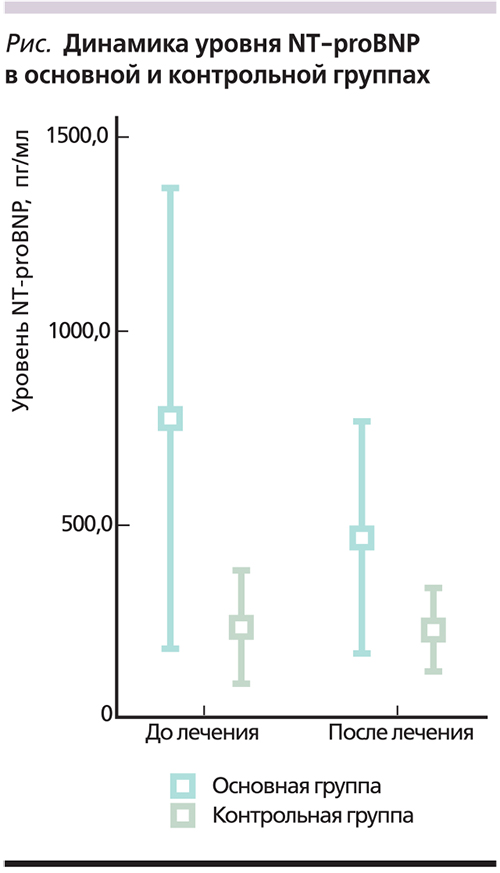 Качество жизни больных ХСН определено по специализированному опроснику здоровья SF (The Short Form)-36 (версия, созданная и рекомендованная международным центром исследования качества жизни). Всем пациентам выполнена трансторакальная эхокардиограмма (ЭХОКГ) с определением фракции выброса (ФВ) левого желудочка (ЛЖ) в процентах по Симпсону и объемов ЛЖ, а также выделением типов ХСН – с сохраненной систолической функцией ЛЖ (СН ССФ) и систолической дисфункцией. Для оценки нарушений ритма и ишемических изменений электрокардиограммы (ЭКГ) всем пациентам выполнено 24-часовое мониторирование ЭКГ (ХМЭКГ) с помощью 12-канальных кардиорегистраторов модели “Кардиотехника” (Институт кардиологической техники, “Инкарт”, Санкт-Петербург). Для подтверждения диагноза СН (прежде всего дисфункции ЛЖ) и оценки состояния пациентов с СН произведено определение уровня мозгового натрийуретического пептида (NT-proBNP).
Качество жизни больных ХСН определено по специализированному опроснику здоровья SF (The Short Form)-36 (версия, созданная и рекомендованная международным центром исследования качества жизни). Всем пациентам выполнена трансторакальная эхокардиограмма (ЭХОКГ) с определением фракции выброса (ФВ) левого желудочка (ЛЖ) в процентах по Симпсону и объемов ЛЖ, а также выделением типов ХСН – с сохраненной систолической функцией ЛЖ (СН ССФ) и систолической дисфункцией. Для оценки нарушений ритма и ишемических изменений электрокардиограммы (ЭКГ) всем пациентам выполнено 24-часовое мониторирование ЭКГ (ХМЭКГ) с помощью 12-канальных кардиорегистраторов модели “Кардиотехника” (Институт кардиологической техники, “Инкарт”, Санкт-Петербург). Для подтверждения диагноза СН (прежде всего дисфункции ЛЖ) и оценки состояния пациентов с СН произведено определение уровня мозгового натрийуретического пептида (NT-proBNP).
Все упомянутые выше исследования выполнены в первые сутки до начала лечения и через 10 дней после проведенной курсовой терапии.
Статистический анализ был проведен с помощью программ SPSS, ver. 21.0. С целью оценки нормальности распределения использованы критерии Колмагорова–Смирнова, коэффициент асимметрии и эксцесса. Количественные данные при нормальном распределении представлены в виде среднего и стандартного отклонений (М ± SD), в его отсутствие – в виде медианы и межквартильного размаха (Ме). При сравнении полученных результатов использованы критерий для парных выборок, критерий Уилкоксона; для оценки уровня значимости изменений в динамике – критерий маргинальной однородности, непарный t-тест Стьюдента, U-тест Манна–Уитни. Статистически значимыми считались различия при p < 0,05.
Для визуализации структуры исходных данных и полученных результатов их анализа использованы графические возможности системы Statistica for Windows. Критерием статистической достоверности получаемых выводов считали общепринятую в медицине величину р < 0,05 [11].
Результаты исследования
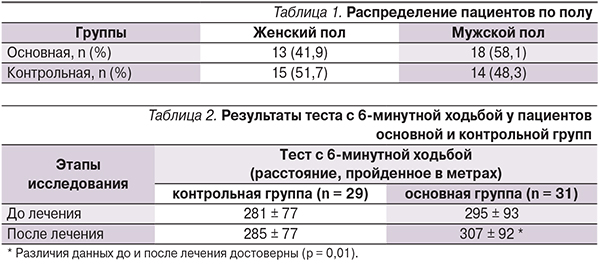
Между группами не было достоверных различий по полу, возрасту, давности заболевания, ФК ХСН. Распределение больных по полу представлено в табл. 1.
Сопоставимость групп прослежена также по следующим показателям: в группе контроля ИБС имели 27 (93,1 %) человек, в основной группе – 29 (93,5 %) человек, длительность ИБС более 10 лет в основной группе была у 25 (80,6 %) человек, в группе контроля – у 20 (69 %) человек; длительность АГ более 10 лет в основной группе была у 27 (87,1 %), в контрольной группе у 24 (82,8 %) человек; АГ 3-й степени в основной группе встречалась у 19 человек (61,3 %), в контрольной – у 22 (75,9 %), 3-я стадия АГ в основной группе встречалась у 24 (77,4 %) человек, в контрольной группе у 16 (55,2 %). Анамнестически наличие стенокардии в контрольной группе было у 22 (75,9 %) пациентов, в группе пациентов, получавших ЦХ-С, – у 24 (75,9 %). Наличие дислипидемии в основной группе составило 71 % (22 человека), в группе контроля – 55,2 % (16). Однако выявилась несопоставимость групп по показателю “масса тела” и по ИМТ.
При анализе качества жизни выявлено, что в контрольной группе в процессе стационарного наблюдения положительная динамика (уменьшения болевого синдрома) отмечена только в разделе “боль в груди” (p < 0,083), тогда как в основной группе высокие степени достоверного улучшения выявлены в разделах “повседневная деятельность” (p < 0,004) и в разделе “боль” (p < 0,011).
При анализе влияния проведенного лечения на результаты теста 6-минутной ходьбы статистически доказана эффективность препарата ЦХ-С по сравнению с плацебо. В среднем после курса терапии пациенты основной группы смогли пройти за 6-минутный интервал на 12,4 м больше, чем до лечения, и эта разница была статистически достоверной (р = 0,01). При анализе данных группы контроля достоверных различий в длине пройденной пациентами дистанции до и после лечения не получено (табл. 2).
Таким образом, сравнение полученных данных между группами показывает, что применение препарата ЦХ-С увеличивает толерантность пациентов с ХСН к физической нагрузке, тем самым способствует уменьшению ФК сердечной недостаточности.
При оценке результатов ХМЭКГ как в контрольной, так и в основной группах достоверных статистических изменений на фоне лечения выявлено не было. В контрольной группе наблюдалась тенденция к незначительному уменьшению количества суправентрикулярных нарушений ритма, в т. ч. и фибрилляций предсердий, однако при этом значимо увеличилось число эпизодов преходящей ишемии. В основной группе тенденции в отношении предсердных аритмий были теми же, но отмечено отсутствие нарастания ишемических эпизодов и значимое уменьшение встречаемости желудочковой экстрасистолии высоких градаций по Ryan.
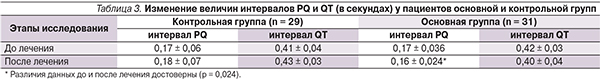
В основной группе после проведенного лечения при анализе ЭКГ наблюдалось уменьшение продолжительности интервала PQ (р = 0,024), тогда как в контрольной группе интервал PQ не менялся (табл. 3). Можно предположить, что применение ЦХ-С способствует улучшению атриовентрикулярного проведения (AВ) у пациентов, страдающих нарушениями AВ-проводимости.
Напротив, в группе контроля на фоне проводимой терапии отмечено увеличение интервала QT (р = 0,33), в то время как в основной группе показатель электрической систолы желудочков до и после лечения не менялся и оставался в пределах нормальных значений (табл. 3). Таким образом, применение препарата ЦХ-С, не вызывая удлинения интервала QT, уменьшает риск развития электрической нестабильности миокарда.
При анализе динамики биохимических показателей отмечено, что применение ЦХ-С не сказывалось на изменении уровня креатинина крови и величины СКФ у пациентов, не страдавших хронической почечной недостаточностью. Однако у единственного пациента с исходно повышенным уровнем креатинина на фоне приема ЦХ-С произошло повышение его уровня и, соответственно, снижение СКФ. Данное нежелательное явление безусловно требует дальнейшего изучения. В контрольной группе уровень креатинина и СКФ не изменялись и оставались в пределах нормальных значений. Применение ЦХ-С не оказывало влияния и на биохимические показатели функции гепатобилиарной системы. В контрольной группе отмечено снижение активности щелочной фосфатазы (р = 0,079), в основной группе этот показатель оставался в пределах нормальных значений как до, так и после проводимой терапии.
Важным маркером степени СН на сегодняшний день признан NT-proBNP. Как видно из данных, представленных в табл. 4, у пациентов основной группы уровень сывороточного NT-proBNP был исходно выше, чем в группе контроля (при статистической обработке по эксцессу асимметрии, коэффициенту вариации и коэффициенту Колмагорова–Смирнова выявлена неоднородность групп по распределению). Из-за большого разброса исходных величин, разница между группами оказалась статистически недостоверной (см. рисунок). Однако на фоне проведенного лечения в контрольной группе отмечен стабильный уровень данного маркера, в то время как в основной группе выявлено значительное (практически в 2 раза) снижение этого показателя после лечения. Интересным оказался тот факт, что снижение NT-proBNP в обеих группах имело место преимущественно у стариков (возраст – более 75 лет).
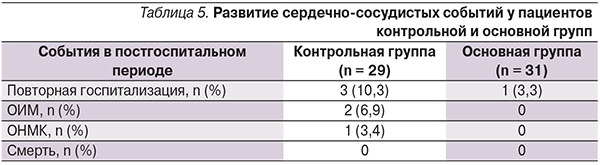
Конечными точками на постгоспитальном этапе наблюдения за пациентами в течение последующего полугода стали повторная госпитализация, острый ИМ, ОНМК, смерть. В обеих группах через 6 месяцев летальных исходов не было, в отношении же других осложнений отмечено большее благополучие пациентов основной группы (табл. 5).
Выводы
- Применение препарата Цитохром-С на госпитальном этапе оказалось эффективным при комплексном лечении пациентов с ИБС, осложненной нарушениями ритма и/или ХСН I–II ФК (NYHA), что проявлялось в улучшении клинической симптоматики, показателей качества жизни, повышении толерантности к физической нагрузке, снижении степени СН по уровню proBNP.
- В исследуемой группе пациентов не удалось достоверно доказать антиаритмическое действие ЦХ-С, однако по сравнению с группой контроля отмечена тенденция к уменьшению градации желудочковых экстрасистол и частоты встречаемости ишемических изменений по данным ХМЭКГ.
- Терапия препаратом ЦХ-С показала свою безопасность в отношении влияния на такие электрофизиологические показатели, как продолжительность электрической систолы желудочков и АВ-проведение, а в ряде наблюдений даже отмечена нормализация интервала PQ.
- Применение ЦХ-С не сказывалось на изменении уровня креатинина крови и, соответственно, на величине СКФ у пациентов, не страдавших хронической почечной недостаточностью. Однако имевшее место некоторое ухудшение показателей функции почек у пациента с исходно нарушенной их функцией требует проведения более углубленного изучения препарата в этом аспекте.
- В постгоспитальном периоде наблюдения за пациентами, прошедшими стационарное лечение с применением ЦХ-С, отмечено значимо меньшее количество сердечно-сосудистых событий по сравнению с лицами, составившими группу сравнения.
- Отсутствие нежелательных гемодинамических влияний, небольшое количество побочных явлений, хорошая переносимость препарата Цитохром-С позволяют рекомендовать его в лечении пациентов с ИБС, осложненной нарушениями ритма и/или ХСН I–II ФК (NYHA) всех возрастных групп.



