Введение
Эпилепсия – одно из наиболее распространенных заболеваний нервной системы. Наиболее частой причиной развития эпилептических припадков, особенно в старших возрастных группах, служат цереброваскулярные заболевания, в частности острая и хроническая церебральная ишемия [1–5]. В связи с этим исследования по изучению особенностей эпилепсии на фоне церебральной ишемии, выявлению факторов риска развития эпилептических приступов представляют высокую актуальность. Целью настоящего исследования было выявить клинические и электроэнцефалографические особенности у пациентов с развитием эпилептических приступов в условиях острой и хронической ишемии головного мозга.
Материал и методы
Комплексно были обследованы 772 пациента в возрасте от 31 до 91 года.
В основную группу вошли 265 больных в возрасте от 31 до 89 лет (мужчин – 176, женщин – 89) с ишемическим инсультом, сопровождавшимся развитием эпилептических припадков, и 174 пациента в возрасте от 44 до 83 лет (мужчин – 80, женщин – 94) с впервые возникшими эпилептическими припадками, манифестировавшими на фоне хронической ишемии головного мозга (ХИМ). Группу сравнения составили 203 пациента в возрасте от 31 до 91 года (мужчин – 126, женщин – 77) с ишемическим инсультом и 130 больных в возрасте от 39 до 82 лет (мужчин – 43, женщин – 87) с ХИМ без эпилептических приступов. Пациенты группы сравнения были сопоставимыми с больными основной группы по возрасту, клиническим характеристикам и представленности патогенетических подтипов инсульта.
В основной группе патогенетический атеротромботический подтип инсульта был у 56,6% пациентов, кардиоэмболический – у 27,2%, лакунарный инсульт перенесли 11,7% пациентов и у 4,5% больных точную этиологию инсульта на момент обследования не удалось установить. В группу сравнения вошли 54,7% пациентов с атеротромботическим подтипом инсульта, 25,1% – с кардиоэмболическим, 10,8% – с лакунарным подтипами и 9,4% больных инсультом неуточненной этиологии.
Обследование выполнено в условиях неврологической клиники Межрегионального клинико-диагностического центра (г. Казань). Неврологический осмотр проведен по общепринятой методике с оценкой по шкале NIHSS (шкала тяжести инсульта Национальных институтов здоровья США). Инструментальные исследования выполнены в межприступном периоде. Визуализация структур головного мозга осуществлена с помощью магнитно-резонансной томографии (МРТ) на аппарате с напряженностью 1,5 Тесла в режимах Т1, Т2, FLAIR, DWI с оценкой измеряемого коэффициента диффузии, с применением МР-ангиографии. Функциональное состояние больших полушарий оценивалось по электроэнцефалограммам (ЭЭГ). Кроме того, выполнено дуплексное эстракраниальное и транскраниальное исследования сосудов головного мозга с оценкой уровня и степени стеноза и цереброваскулярной реактивности.
Статистический анализ проведен на персональном компьютере с применением программ Microsoft Excel, Microsoft Access, Statistica (v 11.0), R. Достоверность различий оценивали на уровне значимости, равном 0,05.
Результаты
В группе пациентов с ишемическим инсультом с эпилептическими припадками выявлены гендерные различия – преобладание мужчин (176 [66,4%] больных) над женщинами (89 [33,6%] больных). У больных обеих обследованных групп припадки чаще всего встречались в возрасте от 50 до 69 лет (61,1% у больных инсультом и 65,8% у больных ХИМ). Как у пациентов с ишемическим инсультом (92,5%), так и у больных ХИМ (88,5%) преобладали фокальные приступы. При этом простые парциальные приступы (ППП) встречались чаще среди пациентов с ишемическим инсультом (34,7%, р<0,05), чем у больных ХИМ (10,3%) (табл. 1).
Напротив, сложные парциальные приступы (СПП) достоверно чаще развивались у пациентов с ХИМ без инсульта (25,9%) по сравнению с больными, перенесшими инсульт (11,3%; р<0,05). Достоверно значимых различий пациентов с вторично-генерализованными приступами (ВГП) в обеих группах не выявлено. Несколько чаще среди пациентов с ХИМ развивались полиморфные фокальные приступы (ПЛП) (21,6 по сравнению с 15,9% наблюдений в группе пациентов с инсультом). В то же время генерализованные приступы (ГП) чаще наблюдались у больных ХИМ без инсультообразного течения (11,3%) по сравнению с пациентами, перенесшими инсульт (7,5%). Эпилептический статус в исследуемых группах развивался только у пациентов с инсультом. Все типы припадков встречались приблизительно с равной частотой у мужчин и женщин, а также в разных возрастных группах.
При практически равной встречаемости у больных инсультом как в правом, так и в левом каротидных бассейнах простых 44 (40%) и 36 (29,8%) соответственно, сложных – 12 (10,9%) и 11 (9,1%) соответственно парциальных припадков, у пациентов, перенесших ишемический инсульт в левом каротидном бассейне, несколько чаще развивалась вторичная генерализация приступов – 44 (36,4%) по сравнению с 33 (30%) в правом каротидном, а также среди пациентов той же группы было достоверно больше больных с клиникой генерализованных припадков (13 [10,7%] – с левополушарным и 4 (3,6%) – с правополушарным инсультом; p<0,05) (табл. 2). У всех пациентов с эпилептическим статусом инсульт был в левом каротидном бассейне.
У пациентов с ишемическим инсультом приступы в первые 7 дней инсульта (острые симптоматические приступы) развивались в 146 (55,1%) случаях, поздние приступы (появившиеся по прошествии недели от развития инсульта) отмечены у 119 (44,9%) больных. У 35 (13,2%) пациентов в анамнезе были припадки-предвестники.
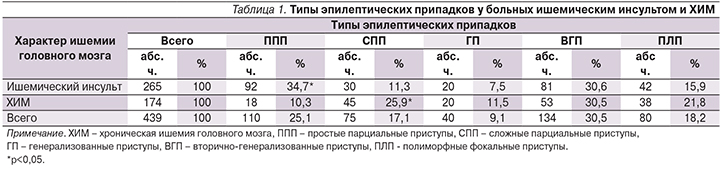
При этом острые симптоматические приступы чаще наблюдались у пациентов с ишемическим инсультом в вертебро-базилярном бассейне (67,6%) и в левом каротидном бассейне (55,4%). Отмечено, что у более молодых пациентов (от 31 до 49 лет) чаще развивались поздние приступы (71,9%). Напротив, у больных старше 80 лет приступы значительно чаще развивались в дебюте инсульта (50%). В группе пациентов с развитием постинсультной эпилепсии ранние приступы появлялись в течение первой недели приблизительно равномерно, в то время как у пациентов, у которых были верифицированы только ранние приступы, эти припадки чаще развивались в дебюте инсульта (77,6%; p<0,05) (рис. 1а, 1б).
Выявлено, что самая высокая частота ассоциации феноменологии припадков с клинически актуальной зоной острой ишемии наблюдалась среди пациентов, у которых эпилептические приступы развились в дебюте инсульта (74,1%). Реже это совпадение отмечалось у больных с другими острыми симптоматическими припадками (57,1%; р<0,05) и всего у 37% пациентов с поздними припадками была ассоциация клинической феноменологии приступов с зоной ишемии (р<0,05). Таким образом, вероятно, в остром периоде инсульта большое значение в качестве источника эпилептической активности играет сам очаг ишемии, в то время как на более поздних стадиях ишемического повреждения мозга развитие эпилептических приступов обусловлено другими патогенетическими механизмами.
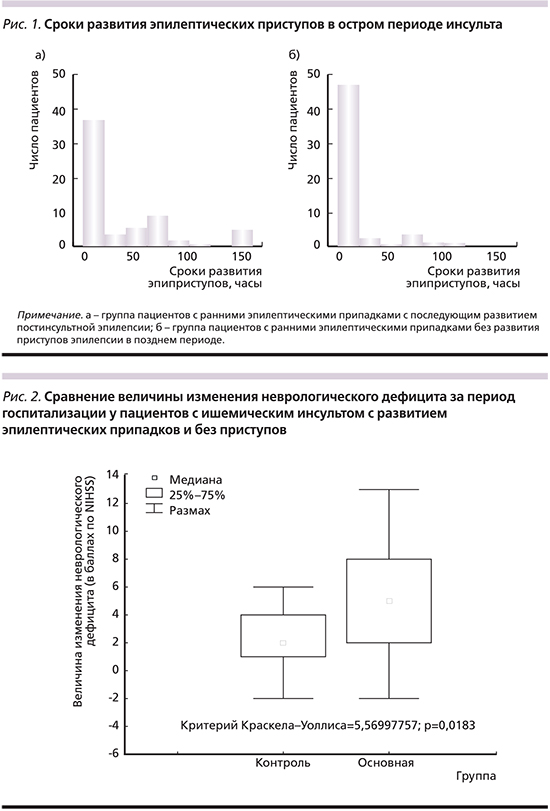
У больных с ранними эпилептическими приступами в первые дни инсульта выявлен более грубый неврологический дефицит по шкале NIHSS (средние значения NIHSS – 6,9; при этом пациенты с NIHSS более 19 баллов составили 6,1%) по сравнению с больными без приступов (средние значения NIHSS – 5,5; пациенты с NIHSS более 19 баллов составили 3,9%) (рис. 2).
Однако и регресс неврологического дефицита к моменту выписки из стационара был более выражен у больных с приступами. Выраженный неврологический дефицит у пациентов с ранними приступами, вероятно, связан с нейромедиаторными блоками в условиях появления эпилептической активности.
У пациентов с эпилептическими приступами, развившимися на фоне как ишемического инсульта (58,9%; р<0,05), так и ХИМ (41,4%; р<0,01), достоверно чаще выявлялись клинические симптомы сочетанного нарушения мозгового кровообращения в системах передней и задней циркуляции по сравнению с больными ишемическим инсультом (42,9%) и ХИМ (25,4%) без развития приступов.
У большинства (91,2%) пациентов ЭЭГ проведена в межприступном периоде. У пациентов с ишемическим инсультом с развитием эпилептических припадков очаги патологической активности были зарегистрированы в 131 (50,6%) наблюдении, среди них очаги эпилептиформной активности зафиксированы у 25 (19,1%) больных, очаговая медленноволновая активность выявлена у 87 (66,4%), сочетание очагов эпилептиформной и медленноволновой активности отмечено в 19 (14,5%) наблюдениях. Генерализация патологической активности была выявлена у 7 (35%) пациентов. У обследованных с ХИМ с развитием эпилептических припадков патологическая активность была зафиксирована в 47 (27,01%) случаях. Среди них эпилептиформная активность была зарегистрирована у 36 (76,6%), очаговая медленноволновая активность наблюдалась у 7 (14,9%) больных. Сочетание очага эпилептиформной и медленноволновой активности зафиксировано у 4 (8,5%) пациентов. Асимметрия биотоков отмечена в 35 (13,5%) наблюдениях с ишемическим инсультом и у 9 (5,2%) пациентов – с ХИМ. Преобладала височная локализация патологической активности: у 117 (45,2%) пациентов с ишемическим инсультом и у 43 (91,5%) – с ХИМ.

Из 131 пациента с ишемическим инсультом с зарегистрированным очагом патологической активности левосторонняя локализация отмечена в 72 (55%) наблюдениях, правосторонняя – в 51 (38,9%) и двусторонняя – в 8 (6,1%) наблюдениях. Из 47 пациентов с ХИМ с зарегистрированным очагом патологической активности левосторонняя локализация имела место у 28 (59,6%) больных, правосторонняя – у 11 (23,4%) и двусторонняя – у 8 (17%) пациентов. Таким образом, как у больных ишемическим инсультом, так и у пациентов с ХИМ с развитием эпилептических припадков локализация очага патологической активности на ЭЭГ слева отмечалась чаще, чем справа и с двух сторон. Кроме того, у пациентов с ХИМ очаг патологической активности чаще верифицирован слева при всех вариантах эпилептических припадков.
Выявлена взаимосвязь регистрации патологической активности на ЭЭГ у больных инсультом и пораженного церебрального сосудистого бассейна (χ2=11,93; p=0,035): у пациентов с ишемическим инсультом в левом каротидном бассейне патологическая активность регистрировалась чаще (в 90 [74,4%] наблюдениях), чем у больных инсультом в правом каротидном бассейне: в 62 (56,4%) и ВББ – в 14 (41,2%) наблюдениях.
Патологическая активность на ЭЭГ достоверно чаще регистрировалась у пациентов с кардиоэмболическим подтипом инсульта (55 [76,4%]), чем у больных с лакунарным (16 [51,6%], р<0,05) и атеротромботическим (88 [60,7%], р<0,05) инсультами. Патологическая медленноволновая активность выявлена у пациентов разных возрастов с приблизительно равной частотой, эпилептиформная активность чаще обнаруживалась у пациентов до 60 лет, сочетание медленноволновой и эпилептиформной активности чаще наблюдалось у больных в возрастном диапазоне от 60 до 69 лет (χ2=24,68; p=0,075) (табл. 2). Наиболее редко патологическая активность на ЭЭГ была зафиксирована среди пациентов с негрубым неврологическим дефицитом: с 0–3 баллами по шкале NIHSS (62 [52,5%]) по сравнению с пациентами с 4–11 баллами по шкале NIHSS (75 [67,6%], p<0,05), а также в меньшей степени, чем у пациентов с 12–18 баллами по шкале NIHSS (16 [80%], p<0,01) и у лиц с 19–27 баллами по шкале NIHSS (13 [81,3%], p<0,01).
Очаги патологической активности значительно чаще регистрировались в группе пациентов с корковой локализацией очагов ишемии, выявленной на магнитно-резонансной томографии: 143 (68,1%; χ2=4,2; p=0,48) по сравнению с больными, у которых ишемическое поражение головного мозга не вовлекало кору: 24 (53,3%) пациента. Анализ ассоциативности семиотики приступов у пациентов с инсультом и выявленной по ЭЭГ очаговой эпилептиформной и медленноволновой активностью показал, что, в то время как у пациентов с развившимися эпилептическими припадками в дебюте и в первые 7 дней инсульта клиника приступов соответствовала локализации зарегистрированной очаговой активности в 75% наблюдений, в группе больных с поздними приступами она была отмечена только в 50% наблюдений (р<0,05).
Общемозговые нарушения биоэлектрической активности были зарегистрированы у 222 (85,7%) пациентов основной группы с ишемическим инсультом и у 147 (85,44%) – с ХИМ с развитием эпилептических припадков.
Обсуждение полученных результатов
В основной исследуемой группе выявлены гендерные различия, а именно преобладание мужчин (66,4%) в группе больных инсультом над женщинами (33,6%). В литературных публикациях о преобладании эпилептических припадков у пациентов мужского или женского пола при сосудистой эпилепсии имеются неоднозначные сведения. В некоторых работах, например у M. Kotila, O. Waltimo (1992), отмечено наиболее частое развитие эпилептических припадков после инсульта у женщин [6]. По данным W.A. Hauser (1995), в старших возрастных группах эпилепсией чаще страдают мужчины [7]. B. Pohlmann-Eden, J.I. Cochius, D.B. Hoch et al. (1997), так же как и R. Roivainen, E. Haapaniemi, J. Putaala et al. (2013), обнаружили в качестве фактора риска развития поздних приступов мужской пол [8, 9]. При изучении факторов риска развития постинсультной эпилепсии Е.К. Муромцева (2013) отметила преобладание мужчин (55,3%) по отношению к женщинам (44,7%) среди пациентов с постинсультной эпилепсией, что согласуется с нашими данными [10].
В нашем исследовании как у пациентов с ишемическим инсультом (92,5%), так и у больных ХИМ (88,5%) преобладали фокальные приступы. Вероятно, в действительности процент фокальных приступов может быть больше, поскольку у части больных с клинической феноменологией генерализованных приступов фокальное начало может быть незамеченным, а инструментальные методы также позволяют верифицировать фокальный компонент не в 100% наблюдений. О преобладании фокальных (парциальных и вторично-генерализованных) приступов у пациентов с острой и хронической ишемией головного мозга свидетельствуют и результаты других исследований [11–16].
Возрастной диапазон, в котором, согласно нашим данным, чаще развивались эпилептические припадки, составил от 50 до 69 лет (61,1% у больных ишемическим инсультом и 65,8% у больных ХИМ), что соответствует и литературным сведениям [7, 12, 17–19]. В частности, Е.К. Муромцева сообщает (2013), что 54,5% пациентов с развитием постинсультной эпилепсии приходилось на возрастной интервал от 50 до 69 лет [10]. При исследовании И.Л. Каймовского (2008) было выявлено достоверное преобладание ранних эпилептических приступов в средней возрастной группе (60– 69 лет) (р=0,0003) [20].
Обнаружено, что среди пациентов, перенесших ишемический инсульт в левом каротидном бассейне, было достоверно больше больных с клиникой генерализованных припадков (10,7%), а также несколько чаще развивалась вторичная генерализация приступов (36,4%) по сравнению с больными инсультом в правом каротидном бассейне (3,6%; p<0,05 и 30% соответственно). Кроме того, у всех пациентов с эпилептическим статусом инсульт был в левом каротидном бассейне, что согласуется и с данными Е.К. Муромцевой (2013), в исследовании которых из 20 больных с эпилептическим статусом на фоне острого нарушения мозгового кровообращения очаг инсульта достоверно чаще (в 55,0% случаев [11 больных], p<0,05) располагался в левом полушарии [10]. Наряду с этим у обследованных нами больных ишемическим инсультом в левом каротидном бассейне несколько чаще развивались ранние (55,4%), чем поздние (44,6%), приступы. Причины таких отличий в клинической картине при патологии правого и левого полушариев головного мозга требуют дальнейшего детального изучения.
Как и у больных основной группы с инсультом, так и у пациентов с эпилептическими припадками на фоне ХИМ достоверно чаще наблюдались неврологические симптомы и синдромы, обусловленные сочетанным нарушением мозгового кровообращения в системах передней и задней циркуляции, по сравнению с пациентами групп сравнения. Подобные явления, возможно, указывают на необходимость для развития эпилептических припадков наличия нарушений реципрокных отношений эпилептической и антиэпилептической систем, развивающихся при сочетанном страдании структур, ассоциированных с кровоснабжением из каротидного и вертебро-базилярного бассейнов.
Результаты электроэнцефалографического обследования у пациентов с сосудистыми поражениями головного мозга, по данным разных авторов, неоднозначны. По наблюдениям многих исследователей, отмечается редкость судорожных комплексов на ЭЭГ в межпароксизмальный период [21]. По данным Э.Г. Меликян, пароксизмальная активность с тенденцией к генерализации регистрировалась у больных дисциркуляторной энцефалопатией значительно чаще (73,6%), чем в нашем исследовании [22]. Напротив, В.О. Генераловым у больных инсультом эпилептиформная активность при рутинной ЭЭГ выявлена только в 11,6% случаев [17]. А.Б. Гехт и соавт. обнаружили фокусы медленноволновой активности, соответствовавшие проекции очага ишемического инсульта в 40% случаев [23]. Нами выявлена более частая регистрация очаговой патологической активности на ЭЭГ в височной области, что соответствует результатам других исследователей [17]. В то же время есть данные, что в пожилом возрасте возрастает процент приступов, вызванных активностью лобной и теменной областей [24]. Зафиксированное преобладание левосторонней локализации очагов патологической активности указывает на большую эпилептогенность левого полушария мозга, что совпадает с данными других авторов [23, 25].
В ранее выполненных работах большая реактивность левого полушария по сравнению с правым объяснялась его более тесными взаимоотношениями с активирующими неспецифическими образованиями ствола головного мозга [23, 26]. Облегчение генерализации эпилептической активности определяется, по мнению В.А. Карлова, межполушарной асимметрией с усилением функциональной активности левого полушария, которое вызывает также диффузное активационное вовлечение всех корковых областей обоих полушарий [26].
Таким образом, в результате исследования определены особенности развития эпилептических припадков у больных церебральной ишемией: превалирование фокальных приступов с преобладанием простых парциальных приступов у пациентов с ишемическим инсультом и сложных парциальных – у больных ХИМ; поздних постинсультных приступов – у лиц моложе 50 лет, приступов в дебюте инсульта – у больных старше 80 лет. Определена ассоциация развития ранних постинсультных приступов с ишемическим инсультом в вертебро-базилярном и в левом каротидном бассейнах. Выявлено превалирование левосторонней локализации очага патологической активности у больных острой и хронической ишемией головного мозга с развитием эпилептических припадков.
Полученные результаты требуют дальнейшего изучения для определения факторов риска развития эпилептических припадков у больных церебральной ишемией головного мозга.


