Введение
По статистическим данным, в мире ревматоидным артритом (РА) страдают более 20 млн человек, при этом в России – около 300 тыс., однако реальное число таких больных составляет более чем 800 тыс. С каждым годом численность больных РА возрастает на 3–4%. Следует заметить, что РА за последние десятилетия значительно помолодел. В Российской Федерации ежегодно регистрируют до 22 тыс. новых случаев заболевания в возрасте до 17 лет [1].
Одной из основных причин летальности при РА являются сердечно-сосудистые катастрофы: инфаркт миокарда, инсульт, внезапная сердечная смерть, обусловленные ранним развитием и быстрым прогрессированием атеросклеротического поражения сосудов [2, 3]. Мета-анализ 17 проспективных исследований (n=92 тыс.) свидетельствует о повышении уровня сердечно-сосудистой летальности при РА на 60% по сравнению с общей популяцией [4]. Увеличение кардиоваскулярной летальности при РА обусловлено накоплением традиционных факторов риска (ФР) сердечно-сосудистых заболеваний (ССЗ); хроническим воспалением, аутоиммунными нарушениями, составляющими основу патогенеза этого заболевания; побочными эффектами противоревматической терапии и, что особенно важно, недостаточным вниманием к профилактике сердечно-сосудистых осложнений (ССО) со стороны врачей и пациентов.
Возникает вопрос: на каком этапе происходит увеличение кардиоваскулярного риска при РА? С одной стороны, его повышение может быть обусловлено иммуновоспалительными изменениями, предшествующими клиническим проявлениям РА. С другой стороны, согласно концепции общих факторов риска ССЗ и РА, пациенты с высоким риском ССЗ могут быть более чувствительными к развитию РА или других аутоиммунных заболеваний [5].
Применение статинов может стать залогом успешной профилактики ССО при РА за счет гиполипидемических и противовоспалительных эффектов. Помимо традиционных показаний к назначению статинов следует назвать длительно сохраняющуюся высокую активность РА и позднее – начало заболевания [6]. На сегодняшний день проведено небольшое количество исследований по применению статинов при РА, что является отражением явно недостаточного внимания к проблеме профилактики ССЗ у этой категории пациентов. В настоящее время лишь 7–12% больных РА получают статины [6–8]. В доступной литературе имеются единичные сведения о влиянии статинов на факторы воспаления у пациентов с РА без верифицированных проявлений атеросклероза. Не изучено их влияние на течение самого РА, что и послужило основанием для проведения настоящего исследования.
Цель исследования состояла в изучении эффектов аторвастатина на лабораторные показатели воспаления у пациенток с РА без ССЗ в анамнезе и оценке двухлетнего прогноза развития кардиоваскулярной патологии.
Материал и методы
Исследование проводилось на базе ГАУЗ «Кемеровская областная клиническая больница № 1» с 2010 по 2015 г.
Всего в исследование были включены 50 женщин (средний возраст составил 50,2±9,9 года), страдавших РА 2-й степени активности, которая оценивалась по индексу DAS28 (Disease activity score), II–III рентгенологических стадий (эрозивная). Все пациентки характеризовались серопозитивностью по ревматоидному фактору.
С целью изучения влияния аторвастатина на показатели факторов воспаления всех пациенток с РА разделили на две группы (табл. 1). Первая группа пациенток продолжала принимать стандартную, ранее назначенную терапию, пациенткам 2-й группы дополнительно был назначен аторвастатин в дозе 20 мг в сутки в течение 6 месяцев.

Исследуемые группы не различались по клинико-анамнестическим данным и принимаемой ранее терапии. Через 2 года провели повторный осмотр пациенток с целью выявления ССЗ и оценки роли факторов, способных прогнозировать возникновение кардиоваскулярных заболеваний. Пациентки не курили ни в прошлом, ни в настоящем, не имели сахарного диабета и ССЗ в анамнезе. В течение последнего года пациентки с РА принимали стабильную дозу метотрексата 10–15 мг в неделю. Глюкокортикоидную терапию, в т.ч. внутрисуставные инъекции, пациентки не получали в течение как минимум последних 6 месяцев. Все пациентки подписали информированное согласие на участие в исследовании, одобренное Комитетом по этике и доказательности медицинских исследований «Кемеровская областная клиническая больница».
Изучение факторов воспаления заключалось в определении концентрации С-реактивного белка (СРБ) с использованием иммунофелометрического метода. Уровень sP-селектина, sЕ-селектина, интерлейкина-6 (ИЛ-6), ИЛ-10, ИЛ-12, фактора некроза опухоли α (ФНО-α), неоптерина, матриксной металлопротеиназы-3 (ММП-3) и ММП-9 оценивали количественным методом твердофазного иммуноферментного анализа, набором для определения в человеческой сыворотке российской фирмы ЗАО «БиоХимМак» (Москва).
Формирование базы данных осуществлено с использованием Microsoft Office Excel 2003 (лицензионное соглашение 74017-640-0000106-57177). Для статистического анализа материала использован пакет прикладных программ Statistica 6.1 (лицензионное соглашение BXXR006B092218FAN11). Характер распределения признака оценивали с использованием критерия Шапиро–Уилка. Для описания количественных данных использовали медиану (Ме) и интерквартильный размах (25-й; 75-й квартили). При обработке данных применяли методы непараметрической статистики для двух независимых выборок – критерий Манна–Уитни (U), критерий Вилкоксона. Критическое значение уровня статистической значимости при проверке нулевых гипотез принималось равным 0,05. В случае превышения достигнутого уровня значимости (р) статистического критерия этой величины принималась нулевая гипотеза. Для выявления ряда статистически значимых клинических, лабораторных и инструментальных параметров, способных оказывать неблагоприятное влияние на развитие артериальной гипертензии (АГ) у больных РА, использовался полиноминальный регрессионный анализ. При проведении множественных сравнений вводилась поправка Бонферрони для оценки вычисленного р-значения. Анализ связи (корреляции) двух признаков проводили с использованием метода Спирмена. Численный показатель площади под кривой AUC (Area Under Curve) вычислен с помощью численного метода трапеций. С целью построения логистической модели был использован пакет прикладных программ SPSS 17, модуль Binary logistic regression.
Результаты исследования
По данным проведенного нами исследования (табл. 2), применение пациентками с РА без кардиоваскулярной патологии, но с наличием дислипидемии аторвастатина в дозе 20 мг в сутки в течение 6 месяцев привело к существенному снижению уровня маркеров системного воспаления.
Так, отмечено статистически значимое снижение уровня СРБ (p=0,00016), ФНО-α (p=0,00012), ИЛ-6 (p=0,0005), sP-селектина (p=0,00001) и повышение уровня противовоспалительного цитокина ИЛ-10 (p=0,045).
Кроме того, получены достоверные (p<0,001) отрицательные корреляционные связи величины ММП-3 (R=-0,52), sP-селектина (R=-0,44) и неоптерина (R=-0,30) с уровнем липопротеидов высокой плотности (ЛПВП) на фоне приема аторвастатина.
Было отмечено снижение активности РА в группе пациенток, получавших в составе комбинированной терапии аторвастатин. Так, показатель DAS28, характеризующий активность воспаления, снизился с 4,9±0,32 до 3,36±0,30 (p=0,0023). У пациенток с РА, которые не получали аторвастатин, на фоне базисной противовоспалительной терапии также отмечено достоверное уменьшение клинической симптоматики артрита, что отразилось в статистически значимом снижении индекса DAS28 (с 4,83±0,32 до 4,40±0,20; р=0,023). Статистически значимым (р=0,001) снижением характеризовался и уровень ИЛ-6 на фоне базисной противовоспалительной терапии. Для остальных показателей системного воспаления отмечена лишь тенденция к снижению, а такие показатели, как ММП-3 и МММ-9, статистически незначимо увеличились.
Наблюдалось повышение уровня аспартатаминотрансферазы на 24% (p=0,00022) на фоне приема аторвастатина, что являлось клинически незначимым.
Через 24 месяца после первичного обследования пациентки с РА (50 человек) были осмотрены в динамике. Из 25 пациенток, которым был назначен аторвастатин, продолжали его получать 20 пациенток, две отказались от приема аторвастатина самостоятельно, троим отменили аторвастатин ввиду увеличения дозы метотрексата и опасения терапевта поликлиники возможного повышения уровня трансаминаз.
Выявлено развитие АГ у 18 (36%), при этом из группы лечения аторвастатином – у 4 (8%). Клинические признаки стенокардии отмечены у 2 (4%) пациенток, не получавших аторвастатин, и у 1 (2%) из группы аторвастатина. У 35 (70%) пациенток (20 – из группы без аторвастатина и 15 – из группы принимавших аторвастатин) имелась одышка смешанного характера при умеренной физической нагрузке, у 25 (50%) – признаки сердцебиения (из них – у 15 пациенток из группы, не принимавших статины) и у 26 (52%) пациенток наблюдались кардиалгии.
В связи с тем что верифицированные приступы стенокардии были только у 8% пациенток, АГ имели 36% пациенток, была предпринята попытка выявления традиционных и нетрадиционных ФР, которые могли способствовать развитию АГ у данной категории пациенток. На основании проведенного полиноминального регрессионного анализа выявлен ряд статистически значимых клинических, лабораторных и инструментальных параметров, влияющих на развитие АГ у больных РА. Установлено, что среди традиционных ФР развития АГ у пациенток с РА значимы следующие: общий холестерин, липопротеиды низкой плотности (ЛПНП), ЛПВП, триглицериды, ОТ, ИМТ, возраст. К нетрадиционным ФР относятся стаж РА, аполипопротеин B (ApoB), аполипопротеин А (АроА), неоптерин, sP-селектин, sЕ-селектин, ИЛ-6, ММР-9 и наличие в крови ревматоидного фактора. Факторами риска не являются ИЛ-10 и ИЛ-12 (отношение шансов [ОШ]=2,085 и ОШ=0,667).
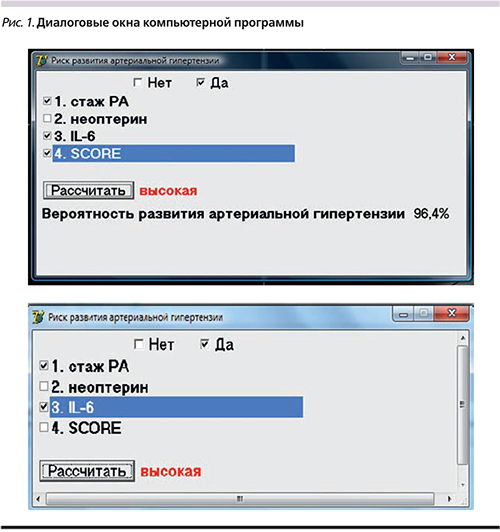
На основании полученных клинических данных была разработана компьютерная программа прогнозирования возникновения АГ. Бинарный логистический регресс дает возможность оценить вероятность наступления события (АГ) в зависимости от выраженности выделенных ФР. С помощью метода логистического регресса рассчитана вероятность наступления события – АГ, которая составляет 81,4%. В ходе исследования с применением пошагового метода включения на основании максимального правдоподобия были определены нетрадиционные ФР, влияющие на формирование АГ: длительность РА, уровень неоптерина, ИЛ-6, индекс SCORE (Systematic COronary Risk Evaluation). На основании вышесказанного была создана компьютерная программа, основанная на оценке клинических и лабораторных данных, с помощью которой определяется риск развития АГ (рис. 1).
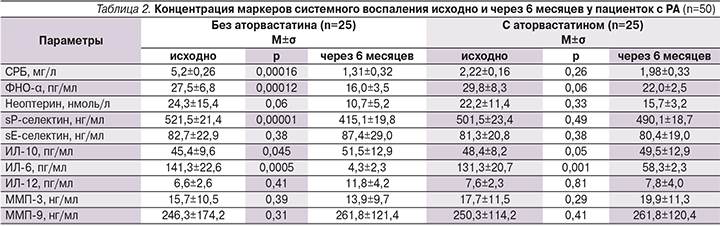
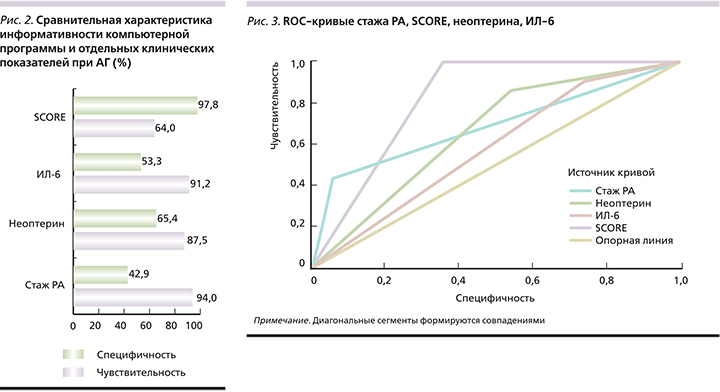
На следующем этапе исследования проведена сравнительная оценка прогностической значимости определения клинических ФР развития АГ и компьютерной программы, основанной на оценке этих факторов. Чувствительность компьютерной программы составила 84,0%, специфичность – 85,7%. К клиническим показателям, обладающим наибольшей чувствительностью в прогнозировании АГ, относились длительность стажа РА (94,0%), наличие высокого уровня ИЛ-6 (91,2%) и неоптерина (87,5%) (рис. 2). Далее был проведен ROC (Receiver Operator Characteristic)-анализ и вычисление площади под кривой. Наибольшей предсказательной способностью обладает SCORE, поскольку график ROC-кривой наиболее приближен к верхнему левому углу. Наименьшая предсказательная способность была у ИЛ-6, т.к. изгиб ROC-кривой ближе расположен к диагональной прямой. Визуальное сравнение ROC-кривых осуществляется с помощью оценки площади под кривыми (рис. 3).
Согласно этим данным, наибольшей прогностической способностью обладает SCORE, поскольку площадь под кривой равна 0,820±0,048 и оценивается как очень хорошая. Сред-ней прогностической способностью характеризуются уровень неоптерина, стаж РА и площадь под кривой (0,659±0,068 и 0,684±0,076 соответственно). Неудовлетворительная прогностическая способность отмечена у ИЛ-6, т.к. площадь под кривой равна 0,582±0,071.
Обсуждение
Существующие шкалы SCORE, Фрамингемская, QRISKII, ACC/AHA (American College of Cardiology/American Heart Association, 2013), основанные на традиционных ФР, не всегда позволяют оценивать кардиоваскулярный риск у пациентов с РА [9, 10]. В последние годы для улучшения стратификации суммарного риска ССО ведутся поиск и разработка различных моделей, с помощью которых можно оценить индивидуальный риск для каждого пациента с РА (ATACC – RAconsortium – ATrans Antlantic Cardiovascular Risk Calculator for Rheumatoid Arthritis) [9]. Определение прогноза развития ССЗ у больных РА – несомненно, важная задача кардиологии. Немаловажным представляется и выявление факторов, способных прогнозировать возникновение кардиоваскулярных осложнений. У 36% пациенток обнаружено развитие АГ, причем преимущественно из группы больных, не принимавших аторвастатин. Доказанные приступы стенокардии были только у 8% пациенток, у 52% наблюдали кардиалгию, что согласуется с данными, представленными Т.В. Попковой [5].
Установлены традиционные ФР развития АГ у пациенток с РА (общий холестерин, ЛПНП, триглицериды, ожирение, возраст) и нетрадиционные (стаж РА, АроА и АроВ, неоптерин, селектины, ИЛ-6, ММР-9, наличие в крови ревматоидного фактора). Посредством метода логистического регресса показано, что вероятность наступления АГ составляет 81,4%. Компьютерная программа риска развития АГ, основанная на оценке клинических и лабораторных данных, характеризуется чувствительностью 84,0%, специфичностью 85,7%. Установлено, что наибольшей прогностической способностью обладает SCORE. При условии, что пациент с РА будет иметь высокий риск ССО по шкале SCORE, назначение статинов не вызывает сомнений. Сочетание длительного стажа РА с высоким уровнем ИЛ-6 и длительного стажа РА с неоптерином также дает высокий риск развития АГ, а сочетание данных факторов обладает наибольшей прогностической способностью, несмотря на низкий риск ССО по шкале SCORE.
Для замедления прогрессирования атеросклеротического поражения сосудов и снижения риска кардиоваскулярных катастроф в настоящее время в кардиологии используется широкий спектр гиполипидемических препаратов, среди которых наиболее эффективны статины [11]. Высокий риск ССО у больных РА регистрируется на 10 лет раньше, чем у лиц без ревматических заболеваний [12, 13]. Результаты многочисленных исследований свидетельствуют об увеличении частоты дислипидемии у этой категории больных (до 84%) по сравнению с лицами, не имеющими ревматических заболеваний [3, 14, 15]. У пациентов с РА за несколько лет до клинической манифестации заболевания наблюдается повышение уровня общего холестерина и снижение концентрации ЛПВП [16, 17]. При РА применение статинов ассоциируется с подавлением клинических и лабораторных показателей активности и снижением общей летальности на 20%, при этом низкая приверженность лечению статинами ведет к увеличению кардиоваскулярного риска [18–20]. Именно поэтому пациентам с РА следует назначать аторвастатин на ранней стадии болезни, который благодаря своим свойствам будет влиять как на классические, так и на нетрадиционные ФР развития ССЗ.
На основании результатов многоцентровых исследований, проведенных на больных кардиологического профиля, был сделан вывод, согласно которому только «агрессивное» снижение уровня атерогенных фракций липопротеидов позволяет достигать стабилизации, а в ряде случаев – и регресса атеросклеротических изменений [10, 15, 16, 21]. Однако применение высоких доз статинов больными РА ограничено повышением риска развития побочных эффектов на фоне базисной противовоспалительной терапии [22]. Мы в своей работе использовали средние суточные дозы аторвастатина (20 мг), но при этом также выявили отчетливые изменения показателей активности заболевания. По нашему мнению, для больных РА представляется целесообразным назначение статинов даже в низких дозах, рассчитывая не только на их липидснижающее действие, но и прежде всего – на плейотропные эффекты.
У больных РА с наличием дислипидемии, но без кардиоваскулярной патологии назначение аторвастатина в дозе 20 мг в сутки в течение 6 месяцев ассоциировалось с вполне ожидаемыми изменениями в липидном профиле крови, снижением уровня маркеров системного воспаления и активности РА. Несмотря на то что Lienetal (2010) продемонстрировали связь между уровнем ММП-3 в сыворотке крови и степенью тяжести атеросклеротического поражения [17], мы отмечали лишь тенденцию к снижению уровня ММП-3 на фоне приема аторвастатина. Проведенное исследование показало хорошую переносимость и клиническую эффективность применения аторвастатина у больных РА с гиперлипидемией. Отмечено клинически незначимое повышение уровня аспартатаминотрансферазы; других побочных эффектов в виде рабдомиолиза, тошноты, рвоты, аллергической сыпи и отека Квинке выявлено не было, что совпадает с имеющимися в литературе данными [13, 23].
Таким образом, в результате проведенного исследования выявлены нетрадиционные ФР развития ССЗ у пациенток с РА, коррекцию которых можно осуществить с помощью приема аторвастатина, разработана комплексная система прогнозирования АГ у пациенток с РА, обладающая высокой информативностью, включающая компьютерную программу, основанную на оценке клинических особенностей пациентов с данным видом патологии. Терапия статинами больных РА представляется нам оправданной не только с точки зрения снижения сердечно-сосудистого риска, но и с позиции положительного их действия на течение самого РА за счет потенцирования противовоспалительного эффекта базисной терапии, влияния на активное воспаление.
Заключение
Полученные данные свидетельствуют о том, что включение в комплексную терапию больных РА аторвастатина влияет на воспалительную активность заболевания, снижая уровень провоспалительных цитокинов, увеличивая уровень противовоспалительного цитокина, что может лежать в основе профилактики развития осложнений ССЗ и дальнейшего прогрессирования заболевания у больных РА.


