Несмотря на значительный прогресс, достигнутый за прошедшие годы, многие вопросы развития и прогрессирования хронической сердечной недостаточности (ХСН) окончательно не выяснены. За последние годы взгляды на патогенез ХСН претерпели существенные изменения. В дополнение к кардиальной, гемодинамической и нейрогуморальной концепциям прогрессирования ХСН получила развитие теория иммунной активации, согласно которой одним из ключевых звеньев патогенеза ХСН признана дисфункция эндотелия, индуцированная окислительным стрессом и провоспалительными цитокинами, подавляющими выработку оксида азота (NO) [1].
В возникновении и прогрессировании ХСН установлена роль провоспалительных цитокинов: фактора некроза опухоли-α (ФНО-α) и интерлейкина-6 (ИЛ-6). Биологические эффекты этих цитокинов во многом схожи: они индуцируют синтез С-реактивного белка (СРБ), повышение уровня которого в свою очередь ведет к прогрессированию ХСН [2]. Обсуждение роли цитокинов в патогенезе ХСН началось еще в 1990 г., когда В. Levine и соавт. обнаружили, что уровень ФНО-α в сыворотке крови больных тяжелой ХСН на порядок выше, чем у здоровых лиц, а лечение, приводящее к компенсации заболевания, сопровождается снижением его концентрации [3]. В 1998 г. В. Buzkurt и соавт. показали, что при длительной инфузии ФНО-α происходит снижение сократительной способности миокарда и развитие необратимой дилатации полости сердца у крыс [4]. При этом в сердечной мышце обнаруживаются лишь минимальные воспалительные изменения, что, возможно, указывает на медиаторную, не зависимую от воспаления роль цитокинов в патогенезе ХСН [5, 6].
Молекулярные механизмы, лежащие в основе цитокининдуцируемого нарушения сократительной способности и ремоделирования миокарда, являются предметом многочисленных исследований. Многие авторы предполагают, что провоспалительные цитокины играют важную роль в прогрессировании ХСН, опосредуя характер и интенсивность процессов ремоделирования миокарда и сосудов посредством регулирования уровня апоптоза кардиомиоцитов, который в настоящее время рассматривают в качестве фундаментального механизма, способного вызывать необратимые нарушения сократительной способности миокарда при ХСН [7].
Целью исследования явилось изучение клинико-диагностической роли маркеров хронического воспаления (СРБ, ИЛ-6 и ФНО-α) у больных ХСН и их динамики на фоне приема розувастатина.
Материал и методы
Обследованы 96 пациентов с ХСН I–IIБ стадиями и I–IV функциональным классом (ФК) по классификации ОССН – Общества специалистов по сердечной недостаточности (2010).
В исследование были включены пациенты обоих полов: 85 мужчин и 11 женщин, в возрасте от 40 до 80 лет (средний возраст – 60,73 ± 9,86 года). Ранее все пациенты перенесли инфаркт миокарда (ИМ) различного срока давности – от 1 до 21 года (в среднем 10,61 ± 7,26 года).
Критерии включения в исследование: наличие у пациентов ХСН ишемической этиологии. Для объективизации ФК ХСН проведен тест с 6-минутной ходьбой в размеченном через каждые 5 метров коридоре длиной 35 метров и оценено клиническое состояние пациентов по модифицированной В.Ю. Мареевым в 2000 г. шкале оценки клинического состояния (ШОКС) при ХСН. Необходимым условием было письменное согласие пациента на участие в исследовании.
Критериями исключения служили: перенесенные менее чем за 6 месяцев до обследования инфаркт миокарда (ИМ); воспалительные заболевания сердца и других органов в стадии обострения; хроническая обструктивная болезнь легких; пороки сердца; болезни соединительной ткани; ревматическая лихорадка; сахарный диабет; болезни крови и онкологические заболевания; хроническая почечная и печеночная недостаточность; повышение уровней аспартатаминотрансферазы и аланинаминотрансферазы – в 3 раза выше верхнего предела нормы; непереносимость статинов.
На момент включения в исследование всем пациентам была назначена рациональная медикаментозная терапия в соответствии с Национальными клиническими рекомендациями по лечению ХСН (2010). При этом терапия не менялась (по группам препаратов) на протяжении по меньшей мере 6 последних месяцев. Медикаментозное лечение включало ингибиторы ангиотензинпревращающего фермента, β-адреноблокаторы, мочегонные препараты, при необходимости нитраты, сердечные гликозиды. На момент включения в исследование пациенты не принимали гиполипидемические препараты или прекратили их прием по разным причинам не менее чем за 6 недель до исследования. Всем пациентам назначали розувастатин (Мертенил, компания «Гедеон Рихтер») в суточной дозе 20 мг однократно. Длительность терапии составила 12 недель, после чего все пациенты были обследованы повторно. Всем провели общеклиническое обследование, включившее сбор анамнеза и оценку объективных данных; комплексное ультразвуковое исследование сердца. Определяли следующие показатели: конечные систолические и диастолические размеры (КДР, КСР, см) и объемы (КДО, КСО, мл) левого желудочка (ЛЖ); фракцию выброса (ФВ, %); толщину межжелудочковой перегородки в систолу и диастолу (МЖПд, МЖПс, мм); толщину задней стенки в систолу и диастолу (ЗСс, ЗСс, мм); массу миокарда ЛЖ (ММ, г); ударный объем (УО, мл); минутный объем (МО, мл/мин). Относительную толщину стенки (ОТС) ЛЖ рассчитывали по формуле: ОТС = (МЖПд + ЗСд)/КДР. Расчет систолического миокардиального стресса (МС в дин/см2) производился по формуле: МС = АДс × КСР/4 × ЗСс × (1 + ЗСс/КСР), где АДс – систолическое артериальное давление. Для оценки сократимости миокарда использован показатель ФВ/МС, предложенный K. Taniguchi и соавт. (2000), отражающий степень адекватности глобальной систолической функции сердца испытываемой нагрузке при данной геометрии ЛЖ [8].
Диастолические свойства ЛЖ изучали при помощи исследования трансмитрального диастолического потока (ТМДП) путем определения максимальной скорости ТМДП в период раннего наполнения ЛЖ (Ve, м/с), максимальной скорости ТМДП в период позднего наполнения ЛЖ (Vа, м/с), отношение максимальных скоростей потоков в период раннего и позднего наполнения (Е/А), времени изоволюмического расслабления ЛЖ (ВИР, мс).
В сыворотке крови больных методом иммуноферментного анализа при помощи соответствующих тест-систем определено содержание СРБ (Вектор-Бест, Россия) и провоспалительных цитокинов: ФНО-α и ИЛ-6 (Протеиновый контур, Санкт-Петербург). Забор крови осуществлен после нахождения пациента в горизонтальном положении не менее 15 минут. Полученные образцы венозной крови подвергали центрифугированию с целью отделения сыворотки, которую потом замораживали и хранили в жидком азоте не более 9 месяцев. При обследовании группы здоровых людей было определено среднее содержание уровней ИЛ-6 (7,27 ± 0,42 пг/мл) и ФНО-α (4,62 ± 0,19 пг/мл).
Анализ данных осуществлен с применением параметрических и непараметрических методов статистики. После предварительного анализа распределения изучаемых признаков на нормальность рассчитано среднее значение (М) и стандартная ошибка (m). Достоверность различий сравниваемых параметров рассчитана с помощью метода вариационной статистики по t-критерию Стьюдента. Различие сравниваемых показателей принималось за достоверное при p < 0,05. Для выявления корреляционных связей различий между параметрами был проведен расчет способом квадратов Пирсона. Корреляционная связь между оцениваемыми параметрами считалась достоверной при p < 0,05.
Результаты иследования
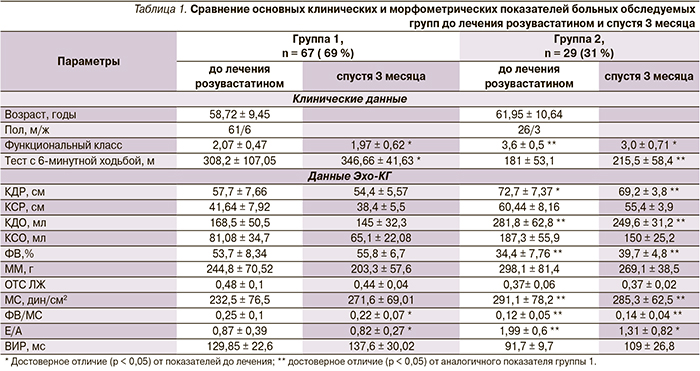
Все пациенты были разделены на 2 группы в зависимости от выраженности ремоделирования ЛЖ по данным Эхо-КГ, согласно критериям ОССН (2010). В группу 1 вошли 67 (69 %) пациентов с адаптивным ремоделированием ЛЖ (I–IIA стадий), в группу 2 – 29 (31 %) пациентов с дезадаптивным ремоделированием ЛЖ (IIБ-стадия). Клиническая характеристика пациентов и показатели морфофункциональных параметров сердца до и на фоне лечения розувастатином представлены в табл. 1.
Исследование завершили 59 пациентов группы 1 и 21 пациент группы 2. За время наблюдения неблагоприятных лекарственных реакций зарегистрировано не было ни в одной из групп. Также не было отмечено достоверного повышения уровня трансаминаз крови более чем в 3 раза от верхней границы нормы.
За время наблюдения произошло 6 (6,25 %) неблагоприятных сердечно-сосудистых событий. Умерли 2 пациента группы 1 и 4 пациента группы 2. Причиной смерти одного пациента из группы 1 явились сложные нарушения ритма, другого – осложнения инфаркта миокарда. В группе 2 причиной смерти стала прогрессирующая сердечная недостаточность.
Из представленных данных видно, что пациенты с дезадаптивным ремоделированием имели значительно более тяжелые проявления ХСН: более высокий ФК недостаточности кровообращения и более значительное снижение толерантности к физической нагрузке. Также было отмечено, что развитие ХСН сопровождается изменением прежде всего геометрии ЛЖ и увеличением массы миокарда ЛЖ. По мере прогрессирования ХСН наблюдалось увеличение линейных размеров полости ЛЖ. У пациентов при развитии дезадаптивного ремоделирования происходило снижение индекса относительной толщины стенки ЛЖ, что свидетельствует о развитии эксцентрической гипертрофии ЛЖ и прогрессировании дезадаптивного ремоделирования ЛЖ, выраженность которого возрастает по мере увеличения ФК ХСН.
У пациентов с адаптивным ремоделированием ЛЖ превалировала концентрическая гипертрофия ЛЖ (77 %), а в 23 % случаев в этой группе пациентов было отмечено развитие эксцентрической гипертрофии ЛЖ.
При исследовании диастолической функции установлено, что у пациентов с адаптивным ремоделированием ЛЖ преобладал 1-й тип диастолической дисфункции, а у пациентов с дезадаптивным ремоделированием ЛЖ – 2-й тип.
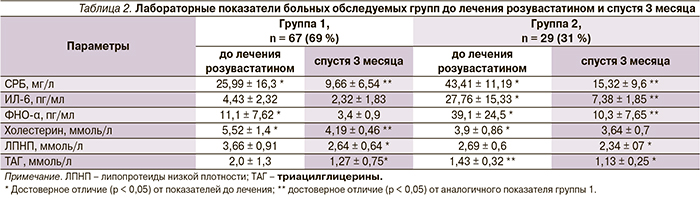
Изменения уровней исследуемых цитокинов в сыворотке крови и концентрации СРБ у больных ХСН характеризовались достоверным их повышением при прогрессировании ХСН (табл. 2).
Максимальный уровень цитокинов (ФНО-α и ИЛ-6) был выявлен у пациентов с дезадаптивным ремоделированием ЛЖ. У пациентов с адаптивным ремоделированием ЛЖ также имело место повышение уровня ФНО-α сыворотки крови, но оно было незначительным по сравнению с группой здоровых лиц. Значимого различия в уровне ИЛ-6 с группой здоровых обследуемых выявлено не было. Уровень СРБ сыворотки крови до лечения был повышен как в группе 1, так и в группе 2, и составил 25,99 ± 16,3 и 43,41 ± 11,19 мг/л соответственно, что существенно выше нормальных значений.
Нами была установлена связь между уровнями провоспалительных цитокинов сыворотки крови и морфофункциональными параметрами ЛЖ. В группе пациентов с дезадаптивным ремоделированием была отмечена корреляционная связь ФНО-α с массой миокарда (r = 0,65; р < 0,05); МС (r = 0,63; p < 0,05); с состоянием диастолической функции: пик Е и Е/А (r = 0,72; p < 0,05, r = 0,58; p < 0,05). Не было отмечено связи с ФВ, но имелась корреляция с показателем ФВ/МС, который характеризует удельную контрактильность миокарда (r = 0,46; p < 0,05). У больных адаптивным ремоделированием ЛЖ отмечена корреляционная связь ИЛ-6 с МС (r = 0,39; p < 0,05) и толщиной стенки ЛЖ (r = 0,75; p < 0,05), а ФНО-α – с ЛПНП (r = 0,41; р < 0,05) и ТАГ (r = 0,38; р < 0,05).
Следовательно, результаты данного исследования продемонстрировали, что уровни провоспалительных цитокинов в сыворотке крови у пациентов с ХСН ассоциированы с развитием и тяжестью клинических проявлений ХСН. Было установлено ранее не описанное скачкообразное увеличение провоспалительных цитокинов сыворотки крови у больных с дезадаптивным ремоделированием ЛЖ.
На фоне приема розувастатина в суточной дозе 20 мг отмечена положительная динамика клинических проявлений ХСН, которая характеризовалась достоверным снижением ФК ХСН и повышением толерантности к физической нагрузке по данным теста с 6-минутной ходьбой как в группе 1, так и в группе 2. Происходило достоверное снижение массы миокарда, уменьшение КДО и КСО. Отмечено улучшение сократительной способности миокарда, показатель ФВ/МС увеличился на 14,2 и 36,0 % у пациентов с адаптивным и дезадаптивным ремоделированием соответственно. Благоприятное изменение структурно-функционального состояния ЛЖ сопровождалось улучшением диастолической функции ЛЖ в виде положительного изменения структуры диастолического наполнения (Е/А) в обеих группах.
Через 12 недель исследования у пациентов, имеющих как адаптивное, так дезадапивное ремоделирование ЛЖ, на фоне клинического улучшения отмечено достоверное снижение концентрации СРБ и провоспалительных цитокинов (ИЛ-6, ФНО-α) сыворотки крови. Все пациенты на момент включения в исследование по шкале SCORE оценки риска смерти от сердечно-сосудистых заболеваний входили в группу высокого и очень высокого риска. У 62 % пациентов спустя 3 месяца от начала лечения розувастатином в суточной дозе 20 мг достигнут целевой уровень ЛПНП (< 2,5 ммоль/л), согласно новым рекомендациям Российского кардиологического общества (2012).
Обсуждение
В настоящее время одним из важных механизмов прогрессирования ХСН считается иммунное воспаление, в развитие которого вовлекаются провоспалительные цитокины, их рецепторы, эндотоксин, молекулы адгезии, реактивные формы кислорода, различные типы лейкоцитов [9]. В ряде работ было показано, что высокий уровень провоспалительных цитокинов ассоциирован с тяжестью клинического состояния больных, приводит к потере массы тела и сердечной кахексии [10]. Полученные нами данные во многом согласуются с данными литературы о неблагоприятном влиянии провоспалительных цитокинов на инициацию, становление и прогрессирование ишемической дисфункции ЛЖ [1, 9]. Они также свидетельствуют о тесной взаимосвязи процессов ремоделирования ЛЖ при ХСН и механизмов иммунного ответа, который активируется при данном заболевании. Обнаруженное значительное скачкообразное повышение уровней провоспалительных цитокинов и СРБ при развитии дезадаптивной фазы ремоделирования сердца может послужить критерием тяжести ХСН и стать отправной точкой в рассуждении клинициста об интенсивности (агрессивности) лечебного воздействия.
Результаты нашего исследования показали, что терапия розувастатином не только сопровождается гиполипидемическим эффектом, но и приводит к значительному снижению концентрации провоспалительных цитокинов сыворотки крови и СРБ у пациентов с ХСН ишемической этиологии. В нашем исследовании уровень СРБ статистически значимо снижался на фоне лечения розувастатином в обеих группах, что свидетельствует об уменьшении воспаления и ассоциируется со снижением декомпенсации деятельности сердца и, соответственно, риска неблагоприятного течения. Это созвучно с результатами ряда исследований, где также отмечена корреляция уровня провоспалительных цитокинов с тяжестью клинических проявлений ХСН, уменьшением продолжительности жизни, а снижение их концентрации на фоне лечения ассоциируется с клиническим улучшением [11].
Таким образом, спустя 12 недель большинство пациентов достигло целевого уровня липидов крови, но еще более важным нам представляется выраженное действие данного лечения на уровень провоспалительных цитокинов и СРБ, что, возможно, будет способствовать торможению развития заболевания. Показанное нами в других работах [12] положительное воздействие терапии розувастатином на эндотелий-зависимую вазодилатацию так же будет способствовать указанным эффектам статинов.
Выводы
Развитие дезадаптивной фазы ремоделирования ЛЖ сопровождается резким подъемом уровня провоспалительных цитокинов и СРБ сыворотки крови.
Имеется достоверная корреляция провоспалительных цитокинов со структурно-функциональными изменениями сердца при ХСН.
Лечение розувастатином (препарат Мертенил) в дозе 20 мг больных ХСН ишемической этиологии сопровождается снижением уровня провоспалительных цитокинов (ФНО-α, ИЛ-6), СРБ сыворотки крови и улучшением структурно-функционального состояния ЛЖ у больных ХСН ишемической этиологии.


