Ревматоидный артрит (РА) – аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом (синовитом) и системным воспалительным поражением внутренних органов [1]. Как сообщили РИА Новости, в Минздраве России накануне Всемирного дня борьбы с артритом более 284 тыс. россиян страдают РА, примерно треть из них имеют тяжелые формы инвалидности. Ревматоидный артрит остается одной из основных причин хронической боли с серьезными последствиями, которые можно ожидать при наличии таких факторов риска неблагоприятного прогноза, как высокие титры ревматоидного фактора, увеличение показателей СОЭ, С-реактивного белка, быстрое развитие деструкции костей.
Еще четверть века назад в ведущих клиниках мира диагностировали РА в среднем через два года после начала болезни, а лечение начинали с анальгетиков и нестероидных противовоспалительных препаратов (НПВП), постепенно добавляя лекарственные препараты разных групп в зависимости от нарастания клинических симптомов.
В конечном итоге подобная тактика приводила к постепенной потере больными трудоспособности, раннему выходу на пенсию и увеличению смертности на 20 % в течение 10 лет [2, 3].
Специальное изучение стратегии лечения больных РА выявило «окно возможности», т. е. непродолжительный период от начала заболевания (до 12 недель), когда лекарственные препараты наиболее эффективны; оказалось, что целью лечения должно быть не просто «улучшение», а достижение «низкой активности» или «ремиссии» заболевания; оценка активности заболевания должна быть максимально объективной (суммарные индексы, острофазовые показатели) и проводиться ежемесячно до достижения цели лечения, что позволяет своевременно проводить его коррекцию [4, 5]. Для более ранней диагностики РА эксперты Американской коллегии ревматологов (ACR) и Европейской антиревматической лиги (EULAR) в 2010 г. предложили новые классификационные критерии (табл. 1) [6]. Эти критерии следует оценивать в баллах для впервые заболевших больных, имевших по крайней мере один сустав с клиническими проявлениями синовита (припухлости); причем синовит – не характерный для других заболеваний. Для определенного (не вызывающего сомнений) РА необходимо, чтобы сумма баллов была не менее шести.

Разработаны основополагающие принципы [5], согласно которым лечение больного РА с учетом сложности диагностики и затратности должен осуществлять специалист-ревматолог, обязательно согласовав назначаемые препараты с больным в соответствии с рекомендациями Европейской антиревматической лиги по лечению РА [7], обращающих внимание на необходимость назначения базисных противовоспалительных препаратов (БПВП) сразу после диагностирования РА, добиваясь ремиссии или низкой активности каждого больного, тщательно контролируя и корригируя лечение каждые 1–3 месяца. При недостаточном эффекте обычных (синтетических) БПВП рассматривается возможность применения генно-инженерных биологических препаратов (ГИБП).
В настоящее время для лечения РА с учетом противопоказаний применяют следующие основные классы лекарственных препаратов: анальгетики и НПВП, глюкокортикоиды, БПВП и ГИБП [8, 9]. Ацетоминофен (парацетамол) – анальгетик с минимальным количеством неблагоприятных реакций, но обычно используют НПВП (широко применяют около 20 препаратов) короткого (ибупрофен, диклофенак, кетопрофен) и длительного (Целебрекс, Мелоксикам, пироксикам) действий, оказывающие симптоматическое (анальгетическое) действие, но не влияющие на прогрессирование деструкции суставов и прогноз заболевания.
Следует непродолжительно применять минимальные дозы НПВП, уменьшающие боли, а после достижения лечебного эффекта на фоне БПВП – быстро их отменять, поскольку могут возникать серьезные неблагоприятные реакции – такие, как образование язв слизистой оболочки желудочно-кишечного тракта, осложняющееся кровотечениями и перфорациями; нарушение функции печени и почек, а также увеличение риска сердечно-сосудистых событий [10].

Категорически противопоказан одновременный прием более одного НПВП. Глюкокортикоиды перорально небольшими дозами (в пересчете на преднизолон 5,0–7,5 мг/сут) назначают больным РА для уменьшения активности воспалительного процесса в течение периода времени, пока не наступил лечебный эффект БПВП, и в дальнейшем постепенно отменяют – в клинической практике обычно в течение 3–6 месяцев из-за отдаленных неблагоприятных реакций: остеопороз и переломы костей, сахарный диабет, катаракта, инфекции [11]. Пероральный прием иногда заменяют однократным внутримышечным введением препаратов группы длительнодействующих глюкокортикоидов (например, 40–80 мг метилпреднизолона), лечебный эффект которых сохраняется в течение 6–8 недель. При наличии показаний глюкокортикоиды вводят внутрисуставно.
Широко применяемые при РА БПВП – метотрексат, лефлуномид или сульфасалазин, уменьшая боль и воспаление, улучшают функцию суставов и замедляют прогрессирование деструктивного процесса в костях. Перед назначением БПВП больные обязательно должны пройти обследование, включающее рентгенографию органов грудной клетки, общий анализ крови, анализ функции печени (общий белок, альбумин, аланиновую и аспарагиновую трансаминазы), почек (креатинин, мочевина). В списке БПВП метотрексат занимает первое место, поэтому в отсутствие противопоказаний именно с него следует начинать терапию (перорально или парентерально), лечебный эффект наступает через 6–8 недель. Обычная стартовая доза – 7,5–10,0 мг один раз в неделю с последующим постепенным (каждые 2 недели на 5 мг) увеличением до 25–30 мг в неделю.
Биодоступность таблетированной формы метотрексата уменьшается с увеличением дозы, поэтому при недостаточном эффекте в течение трех месяцев (не достигнута ремиссия или минимальная активность) рекомендуется подкожное назначение. Фолиевая кислота в дозе не менее 5 мг назначается один раз в неделю не менее чем через сутки после приема метотрексата. Назначение фолиевой кислоты 6 дней в неделю рекомендуется больным с появлением неблагоприятных реакций (тошноты, стоматита). Лефлуномид хотя и сопоставим с метотрексатом по лечебному действию, но несколько реже назначается больным РА. В настоящее время показано, что нагрузочная доза (применение лефлуномида в течение первых трех дней по 100 мг/сут) мало влияет на лечебный эффект в целом по сравнению с обычно применяемой – 20 мг/сут, но чаще вызывает неблагоприятные реакции, среди которых наиболее часто наблюдаются тошнота и диарея (у 20–30 %), кожная сыпь и алопеция (у 5–10 %), повышение печеночных ферментов. Сульфасалазин проявляет лечебное действие спустя 6–12 недель, обычно стартовая доза – 500 мг/сут с последующим еженедельным увеличением дозы до 2–3 г/сут. До 30 % больных в период применения сульфасалазина отмечают тошноту, рвоту, потерю аппетита, понос. В период лечения БПВП обязательно наблюдение врача и контроль показателей крови (табл. 2).
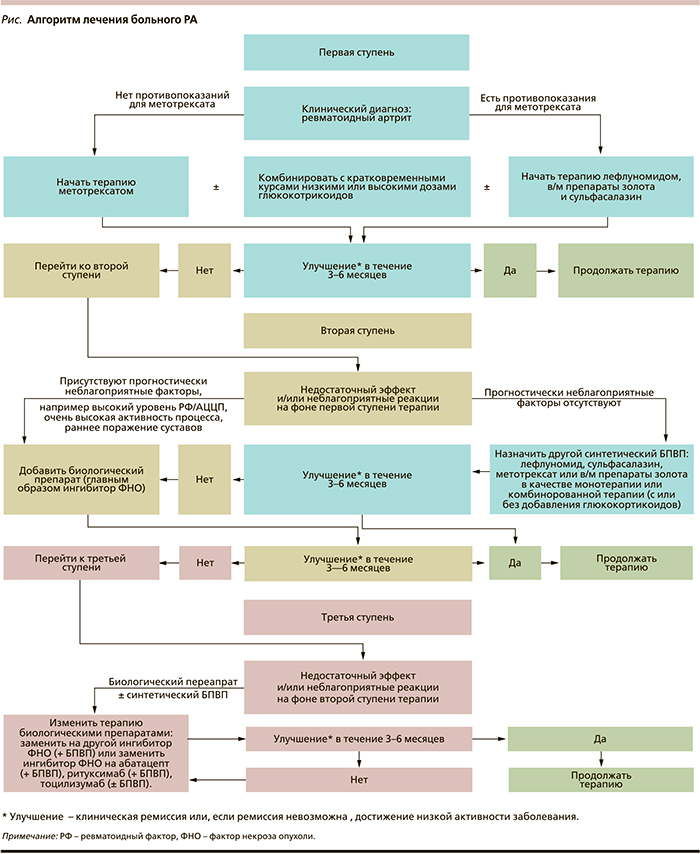
К группе ГИБП относятся ингибиторы фактора некроза опухоли – инфликсимаб, адалимумаб, этанерцепт, цертолизумаб, голимумаб; анти-В-клеточный препарат – ритуксимаб; ингибитор рецепторов интерлейкина – тоцилизумаб; блокатор костимуляции Т-лимфоцитов – абатацепт. Лечение ГИБП должно проводиться в специально оборудованных кабинетах под контролем врача-ревматолога, имеющего опыт применения этих препаратов с учетом противопоказаний и результатов скринирования для исключения латентных инфекционных заболеваний (вирусных гепатитов, туберкулеза) и злокачественных новообразований. На рисунке представлен алгоритм лечения РА, основанный на рекомендациях Европейской антиревматической лиги [7].
Таким образом, в XXI в. рациональным лечением РА считаются:
- назначение БПВП сразу, как только установлен диагноз;
- быстрое, насколько возможно, достижение ремиссии или минимальной активности каждого больного;
- применение метотрексата уже на первом этапе.



