Число больных с различными проявлениями атеросклероза остается высоким, что во многом связано со старением населения и широкой распространенностью факторов риска, важнейшим из которых является гиперлипидемия. Для нормализации липидного профиля и снижения риска сердечно-сосудистых осложнений наряду с соблюдением гиполипидемической диеты во многих случаях необходим длительный прием гиполипидемических препаратов. При этом наиболее хорошо документирована польза от применения статинов [1–2]. Для наилучшего клинического эффекта в настоящее время рекомендуется добиваться достаточно низких значений холестерина (ХС) липопротеидов низкой плотности (ЛПНП) [1, 3].
Толщина комплекса интима-медиа (ТИМ) сонных артерий считается мерой атеросклеротического поражения сосудов, сопряжена с наличием других факторов риска, а также является предиктором возникновения инфаркта миокарда и смерти [8–9]. Продемонстрировано, что гиполипидемическая терапия с использованием статинов приводит к замедлению увеличения ТИМ и при более интенсивном лечении (низких целевых значениях ХС ЛПНП, добавлении никотиновой кислоты) эффект вмешательства возрастает [10–12, 17]. При использовании высоких доз современных статинов продемонстрирована возможность выраженного замедления (фактического прекращения) увеличения ТИМ (розувастатин в дозе 40 мг/сут) и даже регресса имеющихся изменений (аторвастатин в дозе 80 мг/сут) [4, 13].
Однако в реальной клинической практике как в нашей стране, так и за рубежом врачи назначают минимальные стартовые дозы препаратов. Поэтому целевого уровня ХС ЛПНП достигают лишь небольшое число пациентов. Так, по данным Московского исследования статинов, среди больных, нуждающихся в гиполипидемическом лечении, начальные дозы препаратов получают 91 %, а целевых уровней ХС достигают лишь 29,8 % больных [14]. В исследовании REALITY (the Return on Expenditure Achieved for Lipid Therapy), проведенном в 9 европейских странах, среди 58 223 больных групп высокого риска частота достижения целевых уровней ХС ЛПНП не превышала 40 %, а у лиц с ишемической болезнью сердца (ИБС) составила всего 20,9 % [15].
Цель данного исследования состояла в оценке влияния невысоких доз различных препаратов из группы статинов, а также комбинации статина с ингибитором адсорбции ХС эзетимибом на показатели липидного обмена, маркеры воспаления и динамику атеросклеротического процесса у больных каротидным атеросклерозом в условиях реальной клинической практики одного из лечебных учреждений Москвы.
Материал и методы
В исследование включались больные обоего пола в возрасте от 18 до 75 лет с признаками каротидного атеросклероза, выявленными при дуплексном ультразвуковом исследовании сонных артерий (ТИМ более 0,9 см и/или атеросклеротические бляшки), с возможным наличием гиперлипидемии IIa или IIb типов.
В исследование не включали:
- с наследственной и вторичной гиперлипидемией;
- с неконтролируемой артериальной гипертензией (АГ);
- с обострением ИБС;
- с острыми цереброваскулярными расстройствами давностью менее 2 месяцев;
- с хронической сердечной недостаточностью (более II функционального класса по NYHA);
- с тяжелыми соматическими заболеваниями в стадии декомпенсации;
- с активными заболеваниями печени и/или повышением уровня трансаминаз более двух нормальных значений;
- с другими противопоказаниями к применению статинов (дерматомиозитом, полимиозитом); • с индивидуальной непереносимостью статинов;
Кроме того, в исследование не включались женщины репродуктивного возраста, которые не применяли адекватные методы контрацепции. Все пациенты, включенные в исследование, не получали гиполипидемические препараты в течение последних двух месяцев. Изучение было открытым проспективным; схема исследования представлен на рис. 1. Всем пациентам рекомендовано изменить образ жизни, отказаться от курения и соблюдать гипокалорийную и гипохолестериновую диету. Через месяц больные были распределены в 6 групп по 30 человек в каждой. В одной из них применяли симвастатин (Зокор, Merck Sharp & Dohme), в другой – симвастатин в сочетании с эзетимибом (Эзетролом, Schering-Plough), в третьей – генерик симвастатина Симгал (IVAX Pharmaceuticals), в четвертой – аторвастатин (Липримар, Goedecke GmbH), в пятой – розувастатин (Крестор, Astra Zeneca). Шестую контрольную группу составили больные, по разным (немедицинским) причинам отказавшиеся от гиполипидемического лечения. Подбор дозы статина осуществлялся по усмотрению лечащего врача; эзетимиб применяли в фиксированной дозе – 10 мг/сут.
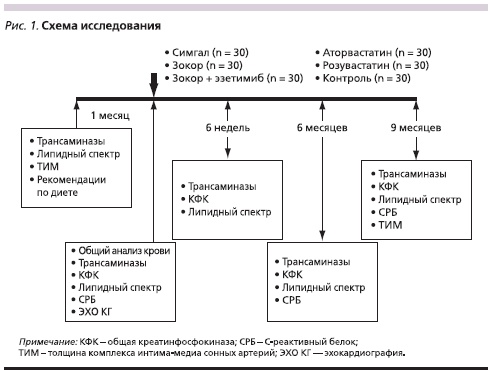
Уровень общего ХС определяли с помощью ферментативного фотометрического теста “CHOD-PAP” (ферментативным гидролизом и окислением), триглицеридов (ТГ) –ферментативного фотометрического теста с глицерин-3-фосфотоксидазой (реагенты “DiaSys”, Германия). Для определения ХС липопротеидов высокой плотности (ЛПВП) использовали реагенты фирмы “HUMAN” (Германия). Расчет уровня ХС ЛПНП проведен по формуле Фридвальда. Уровень С-реактивного белка (СРБ) определен высокочувствительным методом иммунотурбидиметрии с использованием набора реактивов стандартных образцов и контрольных сывороток фирмы “DiaSys” (Германия). Состояние сонных артерий оценивали путем дуплексного ультразвукового сканирования на аппарате Phillips HD7. Определяли ТИМа также наличие атеросклеротических бляшек. Исследование продолжалось 9 месяцев. Плановые визиты осуществлялись через 6 недель, 6 и 9 месяцев после начала приема препаратов.
Статистическая обработка данных осуществлена с помощью пакета статистических программ SPSS 16,0. Данные о непрерывных величинах с нормальным распределением представлены в виде среднего значения и стандартного отклонения (M ± SD), в противном случае – в виде медианы с указанием 25-го и 75-го перцентилей распределения показателя (межквартильного размаха). Сравнение дискретных величин осуществлено с помощью критерия χ2 с коррекцией на непрерывность. Для межгруппового сравнения непрерывных величин (исходных значений показателей, выраженности изменений во время исследования) в случае их нормального распределения применяли дисперсионный анализ с использованием теста ANOVA. В случаях, когда распределение отличалось от нормального, применяли непараметрический критерий Крускала–Уоллеса. Для сопоставления эффективности лечения больных, получавших различные гиполипидемические препараты, проводили дополнительный анализ без учета данных, полученных в группе контроля. В случаях, когда результаты указанных статистических тестов свидетельствовали о наличии достоверного межгруппового различия, группы, за счет которых возникло это различие, определяли с использованием попарных сравнений. Достоверным считали различия при значениях двустороннего р < 0,05.
Результаты
В исследование были включены 180 больных (из них 62,8 % мужчин), их характеристика представлена в таблице. Средний возраст составил 58,4 ± 8,4 года. В анамнезе АГ отмечена у 87,2 % больных, ИБС – у 39,5 %, острое нарушение мозгового кровообращения (ОНМК) перенесли 3,9 %, сахарный диабет (СД) – 20,0 %, курили 32,2 %, индекс массы тела (ИМТ) в среднем составил 28,8 ± 5,02 кг/м2. Нетяжелые проявления хронической сердечной недостаточности при включении в исследование выявлены у 3,9 % больных, фракция выброса левого желудочка составила в среднем 63,8 ± 6,5 %. В начале исследования средние уровни общего ХС составили 245,0 ± 38,8 мг/дл, ХС ЛПНП – 154,1 ± 38,5, ЛПВП – 58,9 ± 14,1, ТГ – 141,9 ± 73,9 мг/дл.
Таблица.Сравнительная характеристика групп больных, включенных в исследование.
По большинству исходных показателей, включивших возраст, пол, распространенность основных факторов риска, исходный уровень липидов и СРБ, достоверных различий между группами выявлено не было. Статистически значимые различия отмечены по частоте использования антагонистов рецепторов ангиотензина II (в группах, получавших Зокор в сочетании с эзетимибом и розувастатин). В группе контроля средняя ТИМ оказалась достоверно меньше, чем в группах гиполипидемических вмешательств.
Средняя суточная доза Симгала составила 19,0 ± 3,1 мг, Зокора – 18,0 ± 6,1, Зокора в сочетании c эзетимибом – 12,3 ± 4,3, аторвастатина – 13,3 ± 4,8, розувастатина – 11,0 ± 3,8 мг.
Данные об изменениях уровня ХС ЛПНП в ходе исследования представлены на рис. 2. Статистически значимое снижение уровня ХС ЛПНП наблюдалось во всех группах гиполипидемической терапии в течение всего периода наблюдения. В контрольной группе через 6 недель от начала исследования отмечено достоверное снижение уровня ХС ЛПНП, однако впоследствии через 6 и 9 месяцев уровень ХС ЛПНП существенно не отличался от исходного. Наиболее выраженный гиполипидемический эффект по степени снижения уровня ХС ЛПНПдостигался при использовании комбинации Зокор + эзетимиб, а также монотерапии розувастатином.

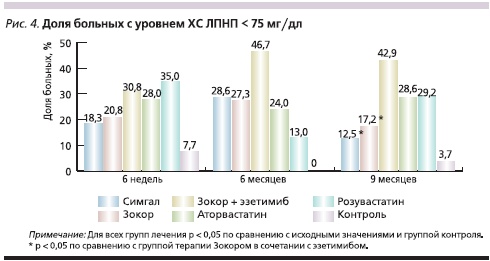
Доля больных, достигших уровня ХС ЛПНП ниже 100 мг/дл, представлена на рис. 3. При использовании гиполипидемических препаратов доля лиц, достигших целевых значений этого показателя (диапазон – от 48,0 до 89,3 %), была достоверно выше, чем в группе контроля (11,1 %). Доля больных, достигших уровня ХС ЛПНП ниже 75 мг/дл, представлена на рис. 4. При использовании гиполипидемических препаратов доля лиц, достигших целевых значений этого показателя, была достоверно выше, чем в группе контроля, и колебалась от 12,5 до 46,7 %.

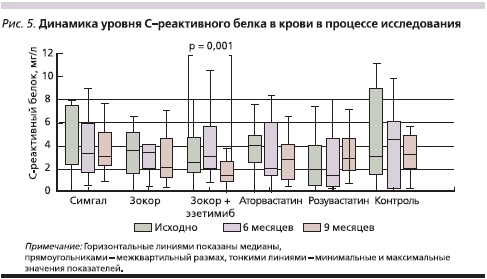
Данные об уровнях СРБ в крови в ходе исследования представлены на рис. 5. Достоверные изменения (уменьшение значений показателя) отмечены только через 9 месяцев лечения Зокором в сочетании с эзетимибом (медианы – 2,6 и 1,4 мг/л соответственно; р = 0,001).
Данные об изменении ТИМ сонных артерий представлены на рис. 6. Существенного изменения ТИМ в правой и левой сонных артериях пациентов групп гиполипидемического лечения не произошло, в то время как в группе контроля этот показатель достоверно увеличился: в среднем с 0,96 до 1,06 мм справа и 1,01 до 1,19 мм слева (р = 0,001).
Рисунок 6. Изменение ТИМ правой (П) и левой (Л) сонных артерий.
Обсуждение
В данное исследование были отобраны лица с начальным поражением сонных артерий (повышенной ТИМ) или наличием атеросклеротических бляшек, видимых при ультразвуковом исследовании. У пациентов выявлены следующие факторы риска прогрессирования атеросклероза: АГ (87,2 %), СД (20,0 %), курение (32,2 %); кроме того, многие имели избыточную массу тела, 40 % больных каротидным атеросклерозом – клинические проявления коронарного атеросклероза. Средние исходные значения ХС ЛПНП были невысокими и составляли 154,1 мг/дл, но даже при наличии умеренного риска неблагоприятного течения заболевания это требует дополнительного гиполипидемического лечения [16]. Средние уровни ХС ЛПВП и ТГ находились в пределах нормальных значений.
В реальной клинической практике применяют небольшие (“начальные”) дозы статинов и целевые уровни ХС ЛПНП достигаются достаточно редко. В данном исследовании оказалось, что даже при использовании невысоких доз статинов в тех случаях, когда нет выраженной гиперлипидемии, существует возможность заметно снизить уровень ХС ЛПНП и более чем в 40 % случаев поддерживать значения этого показателя ниже 100 мг/дл. При этом добавление к невысокой дозе статина (симвастатина) препарата с другим механизмом действия (эзетимиба) позволяет добиться более выраженного гиполипидемического эффекта, сопоставимого с начальной дозой наиболее активного статина (розувастатина).
Гиполипидемическое действие симвастатина в сочетании с эзетимибом в данном исследовании было максимальным, чему соответствовали результаты снижения уровня СРБ в крови, который достоверно уменьшился только в данной группе больных. Можно предположить, что эффект был достигнут за счет добавления к лечению эзетимиба, поскольку монотерапия более высокими дозами симвастатина с этой точки зрения оказалась безуспешной.
Ни один из режимов гиполипидемической терапии в данном исследовании не сопровождался уменьшением ТИМ сонных артерий, однако не было и признаков его прогрессирования в отличие от группы контроля, в которой отмечен достоверный прирост ТИМ. По-видимому, это во многом связано с недостаточно высокой дозой статинов. Результаты ряда других исследований указывают на то, что регресса каротидного атеросклероза можно ожидать при поддержании достаточно низких значений уровня ХС ЛПНП (70–80 мг/дл и ниже) на фоне высоких доз статинов (аторвастатина в дозе 80 мг/сут, розувастатина в дозе 40 мг/сут) [3–6].
В частности, по данным исследования ARBITER (Arterial Biology for the Investigation of the Treatment Effects of Reducing Cholestero)l, ТИМ не увеличивалась при уровне ХС ЛПНП 110 ± 30 мг/дл на фоне 12-месячного использования 40 мг правастатина, в то время как при ХС ЛПНП 76 ± 23 мг/дл при приеме 80 мг аторвастатина ТИМ достоверно уменьшилась [4]. В нашем исследовании уровень ХС ЛПНП через 9 месяцев от начала приема статинов составлял в среднем 105,3 ± 39,2 мг/дл, т. е. был близок к уровню, когда ожидается замедление прогрессирования процесса.
Более низкие значения уровня липидов получены только при сочетании симвастатина с эзетимибом (в среднем 79,2 мг/дл), однако при этом заметного антиатерогенного эффекта выявлено не было.
Представляется, что отсутствие влияния на ТИМ сонных артерий в этой группе больных соответствует результатам исследования ENHANCE (Ezetimibe aNd simvastatin in Hypercholesterolemia enhANces atherosClerosis rEgression), в котором более выраженное итоговое снижение уровней ХС ЛПНП и СРБ, достигнутое за счет добавления эзетимиба к высокой дозе статина, не приводило к дополнительному положительному влиянию на признаки каротидного атеросклероза [7].
В исследовании ARBITER 6-HALTS (Arterial Biology for the Investigation of the Treatment Effects of Reducing Cholesterol 6–HDL and LDL Treatment Strategies), несмотря на выраженное дополнительное снижение уровня ХС ЛПНП на фоне добавления эзетимиба к статину у пациентов с низким ХС ЛПНП (менее 100 мг/дл) и невысокими значениями ХС ЛПВП отмечено увеличение ТИМ в ближайшие 14 месяцев. Одновременно при добавлении к статину никотиновой кислоты ТИМ достоверно уменьшилась, несмотря на менее выраженное снижение уровня ХС ЛПНП (при этом, правда, в отличие от эзетимиба отмечено повышение уровня ХС ЛПВП) [17]. Все это заставляет сомневаться в способности эзетимиба воздействовать на ТИМ.
Таким образом, проведенное исследование позволяет предполагать, что при использовании невысоких (“начальных”) доз гиполипидемических препаратов у больных каротидным атеросклерозом, не имеющих высокого уровня ХС ЛПНП, низкого уровня ХС ЛПВП и гипертриглицеридемии, существует возможность не только улучшить показатели липидного спектра, но, по-видимому, и замедлить прогрессирование каротидного атеросклероза.
Выводы
Невысокие дозы статинов, применяемые в широкой врачебной практике, способствовали существенному снижению уровня ХС ЛПНП в крови у больных каротидным атеросклерозом, не имеющих выраженной гиперлипидемии.
Наибольший и сопоставимый эффект достигался при использовании симвастатина в средней суточной дозе 12 мг в сочетании с эзетимибом и монотерапии розувастатином в средней суточной дозе 11 мг. Лечение невысокими дозами статинов не сопровождалось статистически значимыми изменениями уровня СРБ в крови; его достоверное снижение отмечено только в группе больных, получавших комбинацию симвастатина с эзетимибом. На фоне применения невысоких доз статинов и невысокой дозы симвастатина в сочетании с эзетимибом ТИМ сонных артерий не увеличивалась, в то время как в отсутствие гиполипидемического лечения отмечено достоверное прогрессирование каротидного атеросклероза.
Соколова Наталья Александровна – соискатель кафедры клинической фармакологии ГОУ ВПО РГМУ Росздрава, врач ЗАО МедСи.
E-mail: nataliasokolova@list.ru;
Явелов Игорь Семенович – профессор кафедры клинической фармакологии ГОУ ВПО РГМУ Росздрава.
E-mail: yavelov@yahoo.com;
Белоусов Юрий Борисович – заведующий кафедрой клинической фармакологии ГОУ ВПО РГМУ Росздрава.
Тел. (499)-261-65-10, e-mail: belouspharma@mtu-net.ru;
Леонова Марина Васильевна – профессор кафедры клинической фармакологии ГОУ ВПО РГМУ Росздрава.
Тел. (499)-261-23-08, e-mail: anti23@mail.ru;
Маклакова Елена Владимировна – заведующая терапевтическим отделом МедСи.
Тел. (495) 253-51-68, e-mail: nataliasokolova@list.ru


