Одним из частых осложнений химиотерапии (ХТ) является тошнота и рвота (ТИР). Для купирования эметических реакций, вызванных цитостатиками, необходимо понимать механизм их возникновения. Одну из ключевых ролей в развитии данного осложнения играет серотонин, особенно в остром периоде. При воздействии цитостатиков он высвобождается из энтерохромаффинных клеток слизистой оболочки тонкой кишки и взаимодействует с 5HT3-рецепторами триггерной зоны в ЦНС, что и запускает механизм развития ТИР. Передача импульса в рвотный центр также происходит при взаимодействии серотонина с периферическими рецепторами блуждающего нерва и нейронами желудочно-кишечного тракта. Эффект препаратов группы 5HT3-антагонистов связан с блокадой рецепторов на уровне нейронов как периферических центров, так и ЦНС.
В отсроченном периоде основным механизмом развития ТИР является активация субстанцией Р нейрокининовых рецепторов 1-го типа (NK1).
В связи с многофакторным механизмом развития ТИР в настоящее время наиболее эффективной схемой противорвотной терапии признаны комбинации антиэметогенных препаратов.
Для успешного купирования ТИР необходима правильная оценка эметогенного потенциала цитостатических препаратов и их комбинаций. Выделяют следующие уровни эметогенности: высокий (без проведения противорвотной терапии цитостатики вызывают ТИР более чем у 90% пациентов), умеренный (у 30–90%), низкий (у 10–30%), минимальный (менее чем у 10% больных). В качестве противорвотной терапии при высокоэметогенной ХТ в остром периоде используется комбинация: препарат группы антагонистов 5HT3-рецепторов+дексаметазон+NK1-антагонист. При умеренноэметогенных режимах предпочтение отдают комбинации антагонист 5HT3-рецепторов+дексаметазон, а при низкоэметогенных назначают антагонист 5HT3-рецепторов, или дексаметазон, или антагонист дофаминовых рецепторов [1]. При минимальной эметогенности терапии противорвотной терапии не требуется.
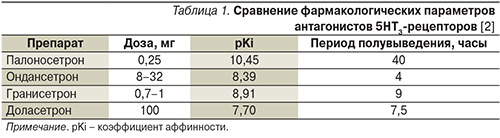
В настоящее время выделяют антагонисты 5HT3-рецепторов первого и второго поколений. К препаратам первого поколения относятся доласетрон, гранисетрон, ондансетрон и трописетрон. Перечисленные препараты имеют близкую эффективность и идентичный профиль токсичности при некоторых различиях в аффинности и периоде полувыведения (от 4 до 10 часов; табл. 1). Они обладают низкой токсичностью, однако при их применении могут наблюдаться побочные эффекты в виде головной боли, головокружения, запоров и изменений на ЭКГ [2]. Одним из наиболее значимых побочных эффектов, который ограничивает применение данной группы препаратов, является удлинение интервала QT на ЭКГ. В августе 2012 г. было опубликовано письмо Федеральной службы по надзору в сфере здравоохранения № 04И-759/12 «О новых данных по безопасности лекарственного препарата Зофран».
В нем сообщалось, что Зофран (ондансетрон) в дозе 32 мг вызывает при внутривенной инфузии дозозависимое удлинение скорректированного интервала QT (QTc). Удлинение интервала QTс может приводить к желудочковой тахикардии типа «пируэт» – нарушению сердечного ритма, потенциально угрожающему жизни. Поэтому доза 32 мг больше не является рекомендованной и не должна применяться.
Единственным препаратом следующего поколения является палоносетрон. Он аллостерически связывает 5HT3-рецепторы, что приводит к их структурным изменениям, а также вызывает интернализацию рецепторов. Такой механизм действия служит фармакологической основой новых свойств 5HT3-антагонистов второго поколения [3]. В отличие от препаратов первого поколения палоносетрон характеризуется более высоким сродством к рецепторам и гораздо большим периодом полувыведения (около 40 часов). По данным исследований, палоносетрон также перекрестно блокирует передачу сигнала с NK1-рецепторов (cross-talk эффект), тем самым обеспечивая большую эффективность в профилактике ТИР как в остром, так и в отсроченном периоде [4].
В рандомизированном исследовании, опубликованном R. Gralla и соавт., было продемонстрировано преимущество палоносетрона перед ондансетроном у 570 пациентов, получивших однодневную умеренноэметогенную ХТ. Первая группа получала палоносетрон в дозе 0,25 мг, 2-я – палоносетрон в дозе 0,75 мг, 3-я группа – ондансетрон в дозе 32 мг. Полный контроль за РИК в остром периоде был достигнут 81% пациентов (p<0,01) для палоносетрона 0,25 мг против 68,6% для ондансетрона 32 мг, а в отсроченном периоде эффективность палоносетрона 0,25 мг оказалась значимо выше, чем ондансетрона (74,1 против 55,1%). Количество полных ответов за весь период наблюдения (0–120 часов после ХТ) составило 69,3 против 50,3%. Уровень полного контроля в группе палоносетрона 0,75 мг был выше, чем в группе палоносетрона 0,25 мг, но разница была статистически недостоверной [5].
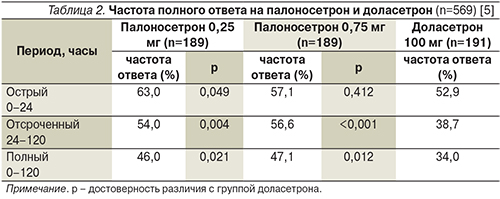
В рандомизированном исследовании, опубликованном Р. Eisenberg и соавт., оценивалась эффективность палоносетрона 0,25 и 0,75 мг по сравнению с доласетроном 100 мг в остром и отсроченном периоде среди пациентов, получавших однодневную умеренноэметогенную ХТ. Препараты вводились однократно за 30 минут до ХТ. Палоносетрон показал сходную с доласетроном эффективность в остром периоде, а в отсроченном периоде эффективность палоносетрона в профилактике ТИР оказалась значительно выше (табл. 2) [6].
Наиболее значимой проблемой для клиницистов является отсроченная ТИР. Преимущество палоносетрона в отсроченном периоде перед ондансетроном при проведении однодневной высокоэметогенной ХТ было продемонстрировано в рандомизированном исследовании III фазы, опубликованном M.S. Aapro и соавт. В исследование были включены 667 пациентов: 1-я группа получала палоносетрон в дозе 0,25 мг, 2-я – палоносетрон в дозе 0,75 мг, 3-я группа – ондансетрон в дозе 32 мг (однократно за 30 минут до ХТ). На усмотрение лечащего врача оставалось использование дексаметазона в дозе 20 мг за 15 минут до ХТ. Полный контроль в остром периоде был достигнут для палоносетрона в дозах 0,25 и 0,75 мг и ондансетрона – в дозе 32 мг у 59,2, 65,5 и 57,0% пациентов соответственно (р=0,701 для палоносетрона 0,25 мг по сравнению с ондансетроном; р=0,079 для палоносетрона 0,75 мг по сравнению с ондансетроном). В отсроченном периоде, а также за весь период наблюдения (0–120 часов после ХТ) уровень полного контроля в группе палоносетрона был выше, чем в группе ондансетрона. В группе палоносетрона 0,25 мг полный контроль в отсроченном периоде был достигнут в 45,3% случаев против 38,9% в группе ондансетрона (р=0,180), а за весь период наблюдения – у 40,8 и 33,0% больных соответственно (п=0,095). В группе палоносетрона 0,75 мг уровень полного контроля в отсроченном периоде составил 48,0%, а за весь период наблюдения – 42,2 (р=0,056 и р=0,051 соответственно по сравнению с группой ондансетрона). При подгрупповом анализе пациенты (n=447), получавшие дополнительно дексаметазон, в остром периоде имели несколько большую частоту полных ответов в группах палоносетрона по сравнению с ондансетроном. Также значительно более высокий уровень полного контроля ТИР отмечен в отсроченном периоде и за период 0–120 часов в группе палоносетрона 0,25 мг+дексаметазон по сравнению с группой ондансетрон+дексаметазон (42,0 против и 28,6%, р=0,021; 40,7 против 25,2%, р=0,005) [7].
Высокая эффективность палоносетрона в отсроченном периоде была показана и в рандомизированном исследовании III фазы, опубликованном K. Kubota и соавт. В это большое исследование были включены 1114 пациентов, которым проведена высокоэметогенная ХТ: цисплатин или доксорубицин/эпирубицин+циклофосфамид (AC/EC). В качестве противорвотной терапии первая группа пациентов получала палоносетрон в комбинации с дексаметазоном, вторая – гранисетрон+дексаметазон. Уровень полного ответа (отсутствие ТИР) был значительно выше в группе палоносетрона в отсроченном периоде (37,8 против 27,2%, р=0,002) и за весь период наблюдения (31,9 против 25,0%, р=0,0117) [8].
В настоящее время ТИР остается серьезной проблемой при проведении многодневной ХТ. Целью исследования M. Musso и соавт. была оценка эффективности комбинации палоносетрон+дексаметазон в профилактике острой и отсроченной ТИР у пациентов, получавших многодневную ХТ. Первая группа больных (n=46) в качестве антиэметогенной терапии получала палоносетрон 0,25 мг в сочетании с дексаметазоном 8 мг внутривенно однократно за 15 минут до ХТ, а также 8 мг дексаметазона внутривенно ежедневно на протяжении всего периода ХТ, в случае развития рвоты допускалось повторное введение палоносетрона, но не ранее чем через 72 часа после первого введения. Вторая группа пациентов (n=45) получала ондансетрон 8 мг с дексаметазоном 8 мг внутривенно однократно за 15 минут до ХТ+8 мг дексаметазона внутривенно ежедневно на протяжении всего периода ХТ, в случае развития рвоты применялся метоклопрамид в дозе 20 мг внутривенно каждые 6–12 часов.
В группах палоносетрона и ондансетрона было проведено 180 и 173 курса ХТ соответственно. Полный ответ был получен от 80% больных, получавших палоносетрон, против 60% в контрольной группе (р<0,05). Появление рвоты, несмотря на проведенную антиэметогенную терапию, успешно купировалось (второй дозой палоносетрона) в 67% случаев в основной группе против 22% в группе ондансетрона (терапия метоклопрамидом; р=0,04) [9].
Палоносетрон служит препаратом с обширной доказательной базой.
А.С. Tricco и соавт. сделали мета-анализ, включивший 299 исследований (58 412 пациентов), целью которого была оценка эффективности и безопасности препаратов группы 5HT3-антагонистов. Все они в монотерапии или в сочетании с глюкокортикостероидами снижают риск ТИР, вызванной ХТ, являясь относительно безопасными. Для комбинации доласетрон+дексаметазон была показана значительно бóльшая частота случаев удлинения интервала QT по сравнению с комбинацией ондансетрон+дексаметазон (4 иссле-дования, 3358 детей и взрослых, отношение шансов – 2,94, 95% доверительный интервал – 2,13–4,17). Однако, по данным мета-анализе, наиболее эффективной и безопас-ной была признана комбинация палоносетрон+дексаметазон [10].
Профиль побочных эффектов палоносетрона аналогичен другим препаратам группы 5HT3-антагонистов и включает головную боль, запоры, нарушения сердечного ритма, изменения ЭКГ (в т.ч. удлинение интервала QT). Однако последнее нежелательное явление при применении палоносетрона менее выраженно, чем при использовании ондансетрона и доласетрона. В исследовании M.S. Aapro и соавт. показано, что удлинение интервала QT для палоносетрона 0,25 мг составляет 3 мс, а для ондансетрона – 5 мс.
В этом исследовании была показана не только бóльшая безопасность, но и более высокая эффективность палоносетрона в группе пожилых пациентов по сравнению с ондансетроном и доласетроном. С учетом более высокого уровня контроля ТИР и незначительного удлинения интервала QT по сравнению с ондансетроном палоносетрон в дозе 0,25 мг рекомендуется для профилактики ТИР у пожилых пациентов [11].
Палоносетрон трансформируется ферментами системы цитохрома Р-450, главным образом CYP2D6 и в меньшей степени – CYP1A2 и CYP3A4, в неактивные метаболиты. Преимуществом палоносетрона является отсутствие влияния на ферменты цитохрома Р-450 и множественность путей элиминации.
В результате при его применении не происходит клинически значимого лекарственного взаимодействия, что особенно важно в группе пожилых пациентов, которые часто получают активную сопутствующую терапию [12].
Не менее сложная при лечении и профилактике ТИР группа пациентов – дети, т.к. лишь в небольшом числе исследований оценивались результаты педиатрического применения антиэметогенной терапии. Палоносетрон показал свою эффективность и безопасность в профилактике ТИР, вызванной высокоэметогенными режимами ХТ у детей, в рандомизированном исследовании A.C. Sepúlveda-Vildósola и соавт. При сравнении группы пациентов, получавших палоносетрон 0,5 мг однократно за 30 минут до ХТ, с группой, в которой применялся ондансетрон 8 мг/м2 каждые 8 часов на протяжении периода наблюдения, показана большая эффективность палоносетрона. Полный контроль рвоты в остром периоде был достигнут в 92% случаев против 72%, на 2-е и 3-е сутки полный эффект достигнут 72 против 46% и 78 против 54% пациентов соответственно. О возникновении побочных эффектов не сообщалось [13]. Палоносетрон в дозе 20 мкг/кг зарегистрирован FDA для применения детьми от 1 месяца до 17 лет [14].
В настоящее время существует не только парентеральный палоносетрон, но и пероральные его формы (монокомпонентные или в комбинации с нетупитантом – NEPA).
В исследовании R. Boccia и соавт. пациенты (n=651) получали умеренноэметогенную ХТ и были рандомизированы в 4 группы: пероральный палоносетрон 0,25, 0,5, 0,75 мг и парентеральная форма 0,25 мг. Все пациенты также были распределены в отношении 1:1 для применения до ХТ в день 1 дексаметазона 8 мг внутривенно или плацебо. При монотерапии палоносетроном полный ответ во всех группах был сходным: в остром периоде – 73,5, 76,3, 74,1 и 70,4%, в отсроченном – 59,4, 62,5, 60,1 и 65,4% и за все время наблюдения – 53,5, 58,8, 53,2 и 59,3% соответственно. При добавлении дексаметазона увеличение частоты полного контроля составляло по меньшей мере 15% для всех групп, кроме перорального палоносетрона в дозе 0,25 мг. Таким образом, авторами был сделан следующий вывод: при проведении умеренноэметогенной полихимиотерапии предпочтительна доза 0,50 мг перорального палоносетрона в комбинации с дексаметазоном [15].
M.S. Aapro и соавт. в 2014 г. опубликовали результаты применения пероральных форм палоносетрона 1455 пациентами, получавшими высокоэметогенную ХТ (режим АС). Первая группа больных принимали комбинированный препарат, содержащий нетупитант 300 мг и палоносетрон 0,5 мг (NEPA), в сочетании с дексаметазоном, вторая группа – палоносетрон 0,5 мг+дексаметазон. Полный контроль ТИР в первой группе был достигнут в 76,9% случаев против 69,5% во второй (р=0,001) [16].
В отделениях химиотерапии ФГБУ «РОНЦ им. Н.Н. Блохина» Минздрава России к настоящему времени накоплен большой опыт успешного применения палоносетрона в профилактике ТИР, вызванной высоко- и умеренно-эметогенной ХТ.
Таким образом, палоносетрон является высокоэффективным и максимально безопасным препаратом группы 5HT3-антагонистов. На основании анализа проведенных исследований можно сделать следующий вывод: палоносетрон превосходит 5HT3-антагонисты первого поколения в профилактике как острой, так и, что особенно важно, отсроченной ТИР при проведении однодневной и многодневной ХТ.


