Достижения медицинской науки в области биохимии, морфологии и медицинской генетики позволили выделить новую группу наследственных болезней, обусловленных нарушением структуры и функций митохондрий. Известно, что митохондриальные дисфункции играют важную роль в патогенезе многих заболеваний, в т.ч. неалкогольной жировой болезни печени (НАЖБП). Это одно из самых распространенных гепатологических заболеваний, приводящее к ухудшению качества жизни, инвалидизации и смерти, что обусловлено высоким риском ее про-грессирования с развитием цирроза, печеночно-клеточной недостаточности, гепатоцеллюлярной карциномы и сердечно-сосудистых осложнений. Распространенность НАЖБП в популяции составляет от 6,3 до 33,0%, причем заболевание встречается в любом возрасте. В России распространенность НАЖБП за последние 7 лет возросла более чем на 10% и составила 37,3%, что позволило ей занять лидирующее место в структуре заболеваний внутренних органов [1, 2].
В течении НАЖБП выделяют несколько стадий, основными из которых являются стеатоз, стеатогепатит, фиброз и цирроз печени. Стеатоз (жировой гепатоз, жировая трансформация, жировая дистрофия печени, жировая печень) – это жировая инфильтрация печеночных клеток, лежащая в основе как морфологического синдрома, так и самостоятельного заболевания печени. Считается, что стеатоз возникает при накоплении в гепатоцитах более 5% липидов, а также при увеличении массы печени на 5–10% выше нормы [3–6].
Понятие неалкогольного стеатоза печени (НАСП) объединяет ряд клинико-морфологических изменений печени, развивающихся у пациентов, не употребляющих алкоголь в гепатотоксичных дозах (для мужчин – не более 40 г/сут, для женщины – не более 20 г/сут в перерасчете на этанол). НАСП встречается во всех возрастных группах, но наибольшему риску развития заболевания подвержены женщины в возрасте 40–60 лет с признаками ожирения [1].
Морфологически выделяют мелкокапельный, крупнокапельный и смешанный стеатоз печени. Чаще встречается т.н. крупнокапельное (макровезикулярное) ожирение, для которого характерно наличие в гепатоците одной большой вакуоли жира, оттесняющей его ядро к периферии клетки. Мелкокапельное (микровезикулярное) ожирение, которому присуще наличие множества мелких вакуолей жира вокруг ядра гепатоцита, сохраняющего центральное положение в клетке, встречается значительно реже. Как правило, на практике в печеночных клетках параллельно отмечаются признаки обоих типов ожирения [6–10].
Патогенез НАЖБП
Развитие жирового гепатоза при НАЖБП представляет собой неспецифическую реакцию гепатоцитов на различного рода токсические воздействия. Так, формированию заболевания способствуют абдоминальное ожирение, гипергликемия, малоподвижный образ жизни, высококало-рийная пища, а также наличие экопатогенных факторов, таких как угарный газ, цианиды, соли тяжелых металлов, побочное действие ряда лекарственных веществ (азидотимидин, вальпроаты, аминогликозиды и др.), алиментарные нарушения (дефицит витаминов группы В), что приводит к возникновению полисистемных митохондриальных дисфункций. В свою очередь увеличение числа митохондриальных дисфункций служит одним из важнейших механизмов старения. Также важную роль в поражении печени играют наследственные факторы, а именно мутация генов: микроРНК-10b (miRNA-10b), ENPP1/PC-1 Lys121GLN и IRS-1 Gly972Arg, PNPLA3, MTP-493 G/T [11–13].
Существует точка зрения, согласно которой крупнокапельный жировой гепатоз чаще возникает у лиц с метаболическим синдромом, при белково-энергетической недостаточности и парентеральном питании. Мелкокапельная жировая трансформация гепатоцитов возникает на фоне приема лекарственных препаратов (тетрациклин, вальпроаты и др.), вирусного гепатита С, наследственного дефекта ферментов цикла мочевины, окисления жирных кислот (ЖК) в митохондриях и т.д. [6].
Наличие стеатоза обычно указывает на нарушение регуляции синтеза и секреции триглицеридов (ТГ), свободных ЖК, других липидов, конкретные механизмы которых изучены недостаточно. Не определены и факторы, выступающие в роли триггеров в данном процессе. Накопление жира в гепатоцитах может быть следствием увеличения поступления ЖК в печень, повышения их синтеза в митохондриях, а также объясняться снижением скорости β-окисления и синтеза и/или секреции липопротеинов очень низкой плотности (ЛПОНП). В нормальной печени жир не обнаруживается при обычном гистологическом исследовании и его содержание не превышает 1,5% от ее массы. Мелкие капли жира в гепатоцитах начинают выявляться при световой микроскопии, если его количество возрастает до 2–5%, что расценивается как патологическое состояние – жировая трансформация (стеатоз) печени [2, 14].
К основным компонентам гепатоцеллюлярных липидов относятся ТГ, субстратами для синтеза которых служат ЖК и глицерофосфат, а также эфиры холестерина (ХС) и сфинголипиды. ЖК поступают в гепатоцит из нескольких источников. Коротко- и среднецепочечные ЖК, образующиеся из пищевого жира и в результате липолиза жировой ткани, доставляются в гепатоцит в связанной с альбуминами форме, а длинноцепочечные – в составе хиломикронов. Кроме этого печеночная клетка способна самостоятельно синтезировать ЖК из ацетил-коэнзима А, особенно при избытке последнего. Источником глицерофосфата в гепатоците является глицерин, образующийся при гидролизе липидов и глюкозы, которая в ходе гликолиза превращается в фосфатидную кислоту, запускающую реакцию синтеза ТГ. Следовательно, продукция ТГ в гепатоците находится в прямой зависимости от содержания в нем ЖК, ацетилкоэнзима А и глюкозы.
В накоплении липидов в гепатоците важное значение придается транспорту ТГ из клетки в составе ЛПОНП. Конъюгация ТГ с апопротеинами происходит на поверхностных мембра-нах эндоплазматического ретикулума с участием ряда ферментов и коферментов, называемых липотропными факторами. ЛПОНП, секретируемые из гепатоцита, под влиянием липопротеиновой липазы крови расщепляются до липопротеинов низкой плотности и ЖК [15]. Следовательно, жировая дистрофия гепатоцитов при НАЖБП может развиваться:
- при состояниях с высоким уровнем ЖК в плазме крови (сахарный диабет, общее ожирение и др.);
- при воздействии токсичных веществ на гепатоциты (четыреххлористый углерод, фосфор, некоторые гепатотоксичные лекарственные препараты и др.);
- при нарушении питания, обусловленном недостатком белка в пищевом рационе (алипотропное ожирение печени, заболевания желудочно-кишечного тракта);
- при генетических дефектах ферментов, участвующих в жировом обмене (наследственные липидозы).
К настоящему времени в литературе накоплены убедительные данные о важной роли митохондриальных дисфункций в патогенезе ряда острых и хронических заболеваний печени. Митохондриальные дисфункции (цитопатии) – гетерогенная группа системных расстройств, обусловленных мутациями митохондриального или ядерного генома, поражающими преимущественно мышечную, нервную, нервно-мышечную системы, а также почки и печень. Существуют разнообразные причины, приводящие к мутациям мито-ДНК, в т.ч. связанные с «ошибками» функционирования ДНК-полимераз и репараз (ферменты синтеза митохондриального генома). Причиной мутаций могут быть повреждения незащищенного гистонами и нитронами митохондриального генома продуктами перекисного окисления липидов (ПОЛ; перекись водорода, гидроксильные радикалы). Мутации мито-ДНК представляют собой делеции различного размера. Репликация мито-ДНК происходит очень интенсивно (в 10 раз быстрее ядерной ДНК), что ведет к быстрому накоплению мутаций [16, 17].
Серьезное поражение печени наблюдается при ряде синдромов с первичным поражением митохондриальной ДНК, при митохондриальной патологии с преимущественным нарушением β-окисления ЖК (стеатоз печени, синдром Рея, острая токсическая жировая дистрофия печени беременных, первичный билиарный цирроз печени и др.). Эти заболевания характеризуются прогрессирующей гепатомегалией, нарушением функции печени и развитием признаков печеночной недостаточности [18].
Митохондрии гепатоцитов играют важную роль в процессах окисления ЖК и окислительного фосфорилирования. Каждая митохондрия содержит 2–10 молекул мито-ДНК. Поскольку гепатоциты богаты митохондриями, можно предполагать, что они являются одним из главных регуляторов метаболизма липидов печени [6, 19].
К основным биохимическим процессам, происходящим в митохондриях гепатоцитов и имеющим отношение к энергообмену, относятся цикл Кребса (цикл трикарбоновых кислот), окисление ЖК, карнитиновый цикл, транспорт электронов в дыхательной цепи и окислительное фосфорилирование. Поступая в гепатоциты, ЖК запускают процесс их активации путем образования ацетил-КоА. Указанный процесс происходит благодаря двум богатым энергией ангидридным связям АТФ. Активированные ЖК попадают в митохондриальный матрикс в виде ацилкарнитина, являющегося трансмембранным переносчиком. Деградация ЖК происходит в матриксе митохондрий гепатоцитов путем реакций окислительного цикла, при которых последовательно отщепляются С2-звенья в виде ацетил-КоА (активированная уксусная кислота). Последовательное отщепление ацетильных групп начинается с кар-боксильного конца активированной ЖК в положении между С2 (α-атом) и С3 (β-атом). Пространственно и функционально β-окисление ЖК тесно связано с цитратным циклом и дыхательной цепью, т.к. матрикс митохондрий богат не только белками, но и ферментами цитратного цикла [20, 21].
Среди причин «поддержания» стеатоза печени при НАЖБП выделяют дефицит ферментов пероксисомального β-окисления ЖК, следствием чего является накопление дикарбоновых кислот. Это приводит к гиперактивации генов, регулирующих экспрессию PPARγ, малонового диальдегида (МДА) и гидроксиноненала. Нарушения структурно-функциональной организации митохондрий при НАЖБП включают ультраструктурные нарушения их мембранного аппарата, нарушения структуры мито-ДНК, снижение активности комплекса дыхательной цепи и β-окисления ЖК [16, 22–24].

Ультраструктурные нарушения митохондриального аппарата обусловливают развитие функциональной недостаточности митохондрий и являются одним из патогенетических факторов развития НАСП. Подтверждением морфологических нарушений гепатоцитов при НАЖБП служат увеличение размера митохондриального аппарата со значительным его набуханием, незначительное количество митохондрий в поле зрения, специфические паракристаллиновые включения в митохондриальном матриксе со сниженной плотностью, выявляемые при электронной микроскопии. Некоторые исследователи подчеркивают, что именно ультраструктурные нарушения митохондриального аппарата обусловливают развитие функциональной недостаточности митохондрий, что является одним из этиологических факторов развития НАСП [24].
В свою очередь первичная или вторичная митохондриальная дисфункция остается важным механизмом развития микровезикулярного стеатоза, при котором нарушения митохондриального β-окисления неэтерифицированных ЖК приводят к аккумуляции их в печени и этерификации в ТГ, которые накапливаются в гепатоцитах в виде вкраплений [25, 26]. В то же время к формированию крупнокапельного стеатоза приводит нарушение собственно структуры мито-ДНК, которое может быть связано как с наследственным дефектом и случайной делецией, так и со встраиванием аналогов нуклеозидов. Торможения митохондриального дыхания у пациентов с заболеваниями печени служат причиной возникновения у них признаков печеночной недостаточности. Некоторые авторы в качестве одной из причин мито-ондриальной дисфункции при НАСП рассматривают повышение проницаемости внутренней мембраны митохондрий для ионов кальция.
При стеатозе печень умеренно увеличена, имеет дряблую консистенцию, а поверхность на разрезе выглядит гладкой и тускло-желтой. На начальных стадиях поражения печени изме-нения гепатоцитов отмечаются в зоне трех, в меньшей степени – в зоне двух печеночных ацинусов, что указывает на роль гипоксического фактора в развитии стеатоза. На поздних стадиях процесса жировая инфильтрация имеет диффузный характер, выявляются жировые кисты, вокруг них возникает клеточная реакция и отмечается разрастание соединительной ткани. Стеатоз смешанного типа следует классифицировать как мелкокапельный, т.к. последний прогностически более неблагоприятен.
Стеатоз печени может протекать в острой или хронической форме. Острое течение стеатоза может провоцировать проявления печеночной недостаточности и приводить к летальному исходу (острая жировая дистрофия печени беременных, синдром Рея), а при более благоприятном исходе заболевания – переходить в хроническую форму. Анализ клинических проявлений НАСП указывает на то, что независимо от этиологии заболевания на первый план выходят явления митохондриальной цитопатии – повышенная усталость, астенический синдром, нарушения сна, психоэмоциональная лабильность, мышечная слабость, непереносимость физических нагрузок, склонность к тахикардии, нарушения моторики желудочно-кишечного тракта, сахарный диабет и др.
К особенностям нарушений энергетического обмена у данной категории больных относится их комплексность и высокая вероятность одновременного выявления в различных органах и системах. Клинические проявления жировой инфильтрации печени зависят от морфологической формы ее поражения. Для крупнокапельного ожирения чаще характерно бессимптомное течение. Иногда от таких пациентов возможны жалобы на тяжесть и неприятные ощущения или боль в правом подреберье, усиливающиеся при движении, что может быть обусловлено избыточным накоплением жира в печени. Больные жалуются на непереносимость жирной пищи, общую слабость, быструю утомляе-мость, раздражительность, снижение работоспособности.
При мелкокапельном ожирении заболевание может проявляться повышенной утомляемостью, тошнотой, рвотой, желтухой, обмороками, гипотензией, кожными геморрагиями, нарушением функций почек. Перечисленная симптоматика связана не только с поражением печени, поскольку липиды могут также накапливаться в канальцах почек, миокарде, головном мозге и поджелудочной железе [9].
Диагностика НАЖБП
Для НАСП при лабораторном исследовании характерно отсутствие биохимической активности ферментов, но в ряде случаев наблюдается минимальное повышение активности алани-новой (АлАТ) и аспарагиновой (АсАТ) аминотрансфераз (индекс АсАТ/АлАТ не превышает 2), щелочной фосфатазы и γ-глутамилтрансфераза; гипертриглицеридемия, гиперхолесте-ринемия; гипергликемия – нарушение толерантности к глюкозе или сахарный диабет 2 типа. С внедрением в клиническую практику современных инструментальных методов обследования появилась возможность неинвазивной диагностики стеатоза печени, что послужило новым толчком к интенсивному изучению данного состояния. Визуализационные методы диагностики позволяют выявлять признаки стеатоза, исключать проявления стеатогепатита, фиброза и цирроза печени. Наиболее информативным методом диагностики стеатоза при НАЖБП является пункционная биопсия печени. Однако, согласно различным международным стандартам, биопсия не обязательна, т.к. жировая дистрофия – это понятие динамиче-ское (стеатоз может активироваться или подвергаться обратному развитию, иметь относительно диффузный или очаговый характер). Поскольку биоптат печени отражает морфологию ее ограниченного участка, это делает трактовку гистологических данных достаточно условной. Если признать морфологическое исследование печени обязательным диагностическим критерием, его нужно проводить достаточно часто, но сама процедура чревата осложнениями. На сегодняшний день жировой гепатоз четко диагностируют при помощи Фибромакс-теста, ультразвукового исследования (УЗИ) и компьютерной томографии (КТ). Так, Фибромакс-тест используют для верификации степени выраженности некровоспалительных изменений на фоне хронических заболеваний печени. Он включает оценку активности процесса, определение стадии фиброза и тяжести заболевания стеатозом и стеатогепатитом. УЗИ печени позволяет верифицировать наличие гепатомегалии, косвенно оценить степень выра-женности стеатоза, а также выявить признаки формирования портальной гипертензии. Признаками НАЖБП при УЗИ могут быть гепатомегалия и спленомегалия, нарушение визуализации печеночных вен, дистальное затухание эхо-сигнала, изменение гиперэхогенности паренхимы печени, нарушение визуализации диафрагмального контура, изменение ангиоархитектоники печеночных вен, расширение диаметра воротной вены. КТ печени также направлена на косвенную оценку степени стеатоза. В целом КТ менее информативна, чем УЗИ, при диффузных поражениях печени, однако она является методом выбора для верификации поражений печени. Основные признаки НАЖБП при КТ: снижение рентгенологической плот-ности печени на 3–5 HU (норма – 50–75 HU); более высокая рентгенологическая плотность селезенки, чем печени, а также внутрипеченочных сосудов, воротной и нижней полой вен по сравнению с плотностью печеночной ткани; пересечение нормальными кровеносными сосудами печени зон пониженной рентгеноконтрастности, что считается характерным признаком очаговой жировой дистрофии. Индекс массы тела выступает в качестве единственного независимого фактора для оценки жировой инфильтрации печени [1, 2, 27].
Ведущий клинический признак жирового гепатоза – гепатомегалия, печень умеренно увеличена, консистенция ее умеренной плотности (плотно эластичная или тестоватая), край закруглен (иногда острый), поверхность гладкая, при пальпации умеренно болезненная. По нашим данным, при осмотре пациентов с НАСП гепатомеголия выявлена в 75% случаев. Кроме того, диагностика заболевания предполагает исключение основных печеночных нозологических форм:
- алкогольное поражение печени;
- вирусное поражение (В, С, D, TTV);
- болезни Вильсона–Коновалова;
- врожденная недостаточность α1-антитрипсина;
- гемохроматоз;
- аутоиммунный гепатит;
- лекарственный гепатит (лекарственный анамнез и отмена возможного препарата, формирующего липопротеины промежуточной плотности [8, 27].
Выявление митохондриальной цитопатии
Современная диагностика митохондриальной цитопатии проводится с использованием хроматомасс-спектрометрии, электронно-оптического, гистохимического исследований биопсионного материала и пр. Обследование пациентов с подозрением на митохондриальную цитопатию включает исследование уровней лактата, пирувата, кетоновых тел, их соот-ношения натощак и после различных нагрузок; определение аминокислотного состава крови и мочи; определение содержания ЖК, спектра липидов и фосфолипидов, общего и свободно-го карнитина, продуктов ПОЛ в крови. Доступными и информативными для динамической оценки интенсивности аэробных окислительных процессов в организме оказались цитохимические тесты на активность сукцинатдегидрогеназы лимфоцитов периферической крови. Характерными гистологическими признаками митохондриальных расстройств при световой микроскопии с применением различных методов окраски служат наличие «рваных» (шероховатых) красных волокон (RRF) в биоптатах мышц, накопление гликогена и липидов, атрофия, вакуолизация и перераспределение волокон 1-го и 2-го типов, дефицит митохондриальных ферментов цикла Кребса и дыхательной цепи (цитохром С-оксидаза, сукцинатдегидрогеназа, НАД-Н-оксиредуктаза и др.), некрозы единичных или мелких групп мышечных волокон, эпителиальных клеток [26].
Нами были обследованы 40 пациентов с НАЖБП на стадии стеатоза. Для верификации митохондриальной дисфункции пациентам проводилась биопсия печени с последующей электронной микроскопией биоптата, а также оценка липидного обмена и оценка активности ферментного и субстратного звеньев антиоксидантной системы. Выбор критериев оценки осуществлялся с учетом наиболее часто встречаемых изменений, возникающих при митохондриальной дисфункции [6, 28]. При анализе данных электронной микроскопии больных НАЖБП нами были выявлены изменения, захватывающие все органеллы цитоплазмы с развитием в них процессов дистрофии и деструкции.
В строении митохондрий наблюдаются следующие изменения: набухание или мелкозернистая гомогенизация внутреннего матрикса, фрагментация и редукция крист, частичное разрушение наружной мембраны и отсутствие признаков деления. Также отмечается уменьшение содержания гранулярной эндоплазматической сети в клетках. Она расположена вблизи митохондрий и представлена единичными короткими канальцами и/или вакуолями. Кроме того, в цитоплазме резко снижено содержание свободных рибосом (полисом) и гликогена, иногда до полного их исчезновения. В цитоплазме содержатся многочисленные липидные включения в виде капель различного размера – от мелких до очень крупных, занимающих большую часть клетки, а также встречаются остаточные тельца, миэлиноподобные структуры и вторичные лизосомы. Все эти изменения в гепатоцитах свидетельствуют о нарушении в них энергетической, синтетической и пластической функций, что приводит к гибели части органелл и появлению в цитоплазме значительных участков, которые выглядят оптически пустыми (см. рисунок).
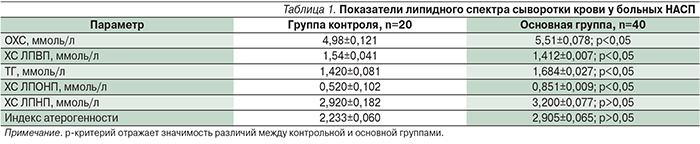
Кроме того, при изучении липидного спектра крови у исследуемых были выявлены нарушения показателей липидограммы в виде повышения концентрации общего ХС (ОХС; р<0,05), ТГ (р<0,05), ХС ЛПОНП (р<0,05), ХС липопротеинов низкой плотности (ЛПНП; р<0,05) и снижения концентрации ХС липопротеинов высокой плотности (ЛПВП; р<0,05). При фено-типировании дислипидемии достоверно чаще выявлялся 11б- и 14-й типы в сочетании со снижением уровня ХС ЛПВП (табл. 1).
Известно, что ПОЛ приводит к повреждению мембран митохондрий, некрозу и апоптозу гепатоцитов. Альдегиды – продукт ПОЛ, способны активировать звездчатые клетки печени, являющиеся основными продуцентами коллагена, а также вызывать перекрестное связывание цитокератинов с формированием телец Мэллори и стимулировать хемотаксис нейтрофилов. Кроме того, ПОЛ приводит к высвобождению МДА и m-гидроксиноненала, индуцирует образование ряда цитокинов: фактора некроза опухоли α, тканевого фактора роста Р), некоторых интерлейкинов.
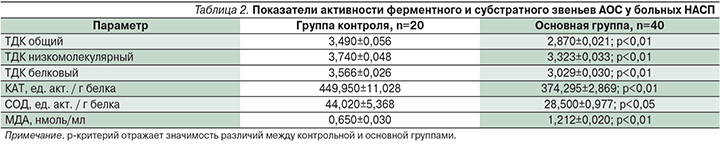
У больных основной группы наблюдались изменения, характерные для окислительного стресса, проявляющиеся снижением активности ферментного и субстратного звеньев антиоксидантной системы (АОС), нарушениями в окислительно-восстановительном гомеостазе тиолдисульфидной системы (табл. 2). Об этом свидетельствовали низкие величины общего (р<0,01), низкомолекулярного (р<0,01) и белкового (р<0,01) тиолдисульфидных коэффициентов (ТДК). Анализ состояния ферментного звена АОС сыворотки крови выявил угнетение активности супероксиддисмутазы (СОД; р<0,01) и каталазы (КАТ; р<0,01). Обнаруженные нарушения происходили на фоне увеличения уровня МДА (р<0,01).
По данным литературы, в ряде исследований была установлена прямая (детергентный эффект, генотоксичность) и опосредованная (ПОЛ, гидроперекиси липидов, дикарбоксильные ЖК, этерифицированные ЖК, изомеры полиненасыщенных ЖК) токсичность ЖК, приводящая к ингибированию K+/Na+-АТФазы, угнетению гликолиза, разобщению окислительного фосфорилирования, активизации путей утилизации избытка ЖК путем вовлечения в процесс PPARα. Следовательно, увеличение поступления ЖК в печеночные клетки, снижение скорости β-окисления ЖК, повышение синтеза ЖК в митохондриях, снижение синтеза или секре-ции ЛПОНП являются механизмами, способствующими накоплению жира в гепатоцитах [22, 28].
Алгоритм лечения НАЖБП
В первую очередь терапия НАЖБП должна быть направлена на факторы, способствующие ее развитию и прогрессированию, а также на коррекцию ассоциированных метаболических и митохондриальных нарушений. Основной целью терапии НАЖБП является уменьшение выраженности стеатоза, предотвращение прогрессирования заболевания и снижение риска сердечно-сосудистых осложнений, а также коррекция митохондриальной дисфункции. Важно вести активный образ жизни, контролировать вес, уровень глюкозы в крови, отказаться от вредных привычек, корректировать липидный профиль и кишечный микробиоценоз, а также необходима адекватная терапия сопутствующих заболеваний и отмена гепатотоксичных лекарственных препаратов [1, 2, 6].
Поскольку НАСП относят к заболеваниям печени, тесно связанным с нарушениями энергетического обмена, основой энерготропной терапии должно быть полноценное качественное питание. Другим важным фактором лечения является коррекция массы тела с использованием как диеты, так и физической активности.
Необходимо ограничить потребление жиров на 20–30%, уменьшить в рационе количество поваренной соли и продуктов, богатых ХС, полностью исключить субпродукты, сырокопченые колбасные изделия, яичный желток, икру, мясо и молочную продукцию с высоким содержанием жира. Также из пищевого рациона должны быть исключены жареные и приготовленные во фритюре блюда. Пациентам с нарушенной толерантностью к глюкозе и сниженной чувствительностью клеточных рецепторов к инсулину рекомендуется отказаться от простых и ограничить потребление сложных углеводов.
Важно употреблять не менее 15 г клетчатки, а также продукты, богатые витаминами А и Е. Помимо диеты необходимы как минимум 30–40 минут ежедневных аэробных физических нагрузок: плавание, ходьба, гимнастический зал. Физическая активность сама по себе снижает инсулинорезистентность и улучшает качество жизни [2, 29]. Постепенное уменьшение массы тела на 0,5–1,0 кг в неделю сопровождается положительной динамикой клинико-лабораторных показателей и морфологической картины печени. Однако при быстром снижении массы тела может наблюдаться нарастание гистологических изменений, характерных для стеатоза. Неэффективность немедикаментозных методов лечения служит показанием к назначению фармакотерапии, направленной на снижение массы тела [2, 11, 30, 31].
Медикаментозное лечение НАЖБП проводят в следующих направлениях:
- коррекция инсулинорезистентности: метморфин, пиоглитазон;
- коррекция гиперлипидемии: ингибиторы ГМК-КОА редуктазы – статины, производные фиброевой кислоты (фибраты), никотиновая кислота, секвестранты желчных кис-лот;
- лечение окислительного стресса: витамин Е, урсодеоксихолевая кислота, эссенциальные фосфолипиды, силимарин, метадоксин;
- восстановление нарушений микробиоценоза кишечника: антибиотики, с последующим назначением про-, пре-, сим-, син- и метабиотиков;
- коррекция митохондриальной цитопатии (L-карнитин, коэнзим Q10);
- нормализация функции и структуры печени – гепатопротекторы.
В зависимости от химической структуры и происхождения гепатопротекторы подразделяются на следующие группы:
- Препараты, содержащие естественные или полусинтетические флавоноиды расторопши, в первую очередь силимарин (Карсил, Гепабене и др.).
- Препараты, содержащие естественные или полусинтетические флавоноиды других растений (Хофитол, ЛИВ-52 и др.).
- Органопрепараты животного происхождения (Прогепар, Гепатосан).
- Препараты, содержащие эссенциальные фосфолипиды (Гепагард Актив, Резолют и др.).
- Препараты разных групп: аминокислоты и их производные (Метадоксил, Орнитин), урсодеоксихолевая кислота (Урсофальк).
Для повышения эффективности лечения больных НАЖБП показано использование препаратов различных групп с разным механизмом действия как в монотерапии, так и в комбинации [11, 32–35]
Поскольку выраженность патологического процесса в печени связана с эффективностью аэробного окисления в печеночных клетках, параллельно с изменением образа жизни, приемом лекарственных препаратов необходимо проводить коррекцию митохондриальной дисфункции.
Что касается лечения митохондриальных нарушений при НАЖБП, обычно оно проводится по двум направлениям:
- повышение эффективности энергетического обмена в тканях (тиамин, рибофлавин, никотинамид, L-карнитин, коэнзим Q10, витамин С, цитохром С и др.);
- предупреждение повреждения митохондриальных мембран свободными радикалами с помощью антиоксидантов (витамин Е, α-липоевая кислота) и мембранопротекторов.
Лечение также включает использование альтернативных источников энергии (креатина моногидрат) и снижение уровня лактата (дихлорацетат) [16, 20, 31].
Заключение
Отсутствие единого представления о сути процессов, происходящих при НАЖБП, скудность клинической симптоматики, ограниченные возможности своевременной диагностики обу-словливают интерес врачей различных специальностей к поиску решений этой проблемы. В нашем исследовании установлена значимая роль митохондриальной дисфункции в развитии стеатоза у больных НАЖБП, что подтверждено данными электронной микроскопии, липидограммы и оценки ПОЛ. Поскольку стеатоз является определяющим этапом в процессе прогрессирования заболевания, подобные характерные изменения необходимо учитывать при составлении плана диагностики и алгоритма лечения больных НАЖБП.



