Введение
В настоящее время не подлежит сомнению тот факт, что эффективный гликемический контроль у пациентов с сахарным диабетом (СД) является основой профилактики возникновения и прогрессирования долгосрочных осложнений. Управление диабетом в детской возрастной группе сопряжено с множеством трудностей, связанных как с объективными, так и с субъективными причинами [1]. Непредсказуемость аппетита и особенности всасывания микронутриентов в желудочно-кишечном тракте у детей младшего возраста, гормональные изменения, в т.ч. пубертатная инсулинорезистентность, активный рост, психосоциальные факторы и желание манипулировать родителями у подростков, определяют сложности достижения и поддержания оптимального гликемического контроля у данной категории пациентов. Кроме того, у подростков и детей, прежде всего в младшей возрастной группе, особое значение имеет гипогликемия как основной побочный эффект инсулинотерапии, являющийся значимым барьером на пути достижения и поддержания оптимального уровня гликемии [2]. Доказана роль гипогликемических состояний в возникновении когнитивных нарушений и аффективных расстройств у детей и подростков, ограничивающих возможности достижения компенсации заболевания [3, 4]. Эпизоды ночной гипогликемии значительно нарушают режим сна не только детей, но и их родителей, а также приводят к развитию постгипогликемической гипергликемии в утренние часы, препятствуя проведению адекватной коррекции гликемии в вечернее время.
Инсулин деглудек (Deg) – инновационный базальный инсулин нового поколения, обладающий сверхдлительным действием и самой низкой среди других традиционно применяемых базальных инсулинов вариабельностью действия. В настоящее время это единственный базальный аналог инсулина, зарегистрированный к применению для лечения СД 1 типа (СД1) у детей старше 1 года. Доклинические исследования продемонстрировали сверхдлинное действие (не менее 42 часов) инсулина Deg, ровный беспиковый фармакологический профиль в течение 24 часов, низкую вариабельность гликемии [5]. Клинические исследования у взрослых пациентов с СД1 и СД2 показали, что инсулин Deg эффективно снижает уровень HbА1c и имеет преимущества в снижении глюкозы плазмы натощак в сочетании с низким риском развития ночных гипогликемий [6]. В исследованиях у детей инсулин Deg также продемонстрировал низкую вариабельность гликемии, сопоставимый контроль гликемии с инсулином детемир при высоком уровне безопасности, обеспечивая снижение частоты как гипогликемий, так и гипергликемий с кетозом [7, 8].
Целью настоящего исследования стала оценка эффективности и безопасности инсулина Deg в комбинации с инсулином аспарт (Asp) у детей и подростков с СД1, не достигших целевых параметров гликемии на предшествовавшей терапии.
Материал и методы
С февраля 2016 г. на инсулин Deg были переведены 39 детей с СД1, проживающих на территории ХМАО–Югры. Распределение детей по возрасту: дошкольники – 6 детей; 7–12 лет – 19 детей; 12–17 – 14 подростков. Основные причины смены базального инсулина: уменьшение риска гипогликемических состояний, особенно у детей младшей возрастной группы, уменьшение риска гипергликемии с кетозом без увеличения риска гипогликемий, улучшение долгосрочного гликемического контроля.

Ниже представлены результаты комплексного анализа терапии 27 пациентов с СД1 (55% мальчиков и 45% девочек) в возрасте от 4 до 17 лет (средний возраст пациентов – 12,1±4,9 года), получавших инсулин Deg более 6 месяцев, стратифицированных по возрасту в 3 группы: 1-я группа – дошкольники – 4 ребенка, 2-я (от 7 до 12 лет) – 12 детей, 3-я группа (от 12 до 17 лет) – 11 детей. Средняя длительность СД составила 5,1±2,4 года. Диабетические осложнения имели место у 12 пациентов (44%): у 4 пациентов (15%) диагностирована диабетическая нефропатия (микроальбуминурическая стадия), у 9 (33%) – периферическая сенсорно-моторная дистальная нейропатия нижних конечностей, у 10 (37%) – гипертрофические липодистрофии; 7 (26%) пациентов с сахарным диабетом имели два и более осложнений на момент обследования.
Основной целью перевода на инсулин Deg была оптимизация гликемического контроля у детей и подростков с СД, поэтому при оценке эффективности терапии в качестве исходных значений использовали базовые параметры пациентов до перевода на инсулин Deg, а в качестве целевых – параметры, согласно рекомендациям ISPAD [8, 9]. До назначения инсулина Deg 26 пациентов получали базис-болюсную терапию аналогами инсулина гларгин или детемир в комбинации с инсулином Asp, 1 ребенок находился на помповой инсулинотерапии (инсулином Asp). Инсулин Deg вводили 1 раз в день в вечернее время (20–21 час). Перевод на инсулин Deg осуществлен в соответствии с инструкцией по медицинскому применению препарата.
У подростков начальная доза инсулина Deg была эквивалентной ранее получаемой дозе базального инсулина; доза инсулина Asp при переводе на Deg не корректировалась; в дальнейшем при необходимости проводилась коррекция доз инсулинов.
У детей младшей возрастной группы, а также у пациентов, склонных к развитию гипогликемических состояний, начальная доза инсулина Deg была на 1–2 ЕД меньше таковой предшествовавшего базального инсулина; в дальнейшем коррекция дозы инсулина Deg проводилась на основании среднего уровня гликемии перед завтраком с учетом всех показателей гликемического профиля; коррекция дозы прандиального инсулина Asp проводилась на основании среднего уровня гликемии перед каждым приемом пищи до достижения целевых значений [7, 8].
Эффективность оценивали через 12 и 24 недели терапии по динамике основного показателя – уровня НbА1с, а также уровней глюкозы в плазме натощак (ГПН), постпрандиальной гликемии (ППГ), глюкозы плазмы (ГП) ночью от исходных значений. Все параметры гликемии во время стационарного лечения определяли в лаборатории стационара или на основании суточного мониторирования, а во время амбулаторного наблюдения – по данным самостоятельного измерения глюкозы в капиллярной крови с помощью глюкометра, калиброванного по плазме. Непрерывный мониторинг уровня глюкозы проводили до перевода на инсулин Deg в течение 3–4 дней, затем повторно через 8–12 и 22–24 недели терапии. Также оценивали изменение дозы инсулина: общей дневной, базисной и болюсной доз инсулина в течение суток по сравнению с исходными.
При анализе безопасности проводимой инсулинотерапии оценивали все нежелательные явления (методом свободного опроса), а также частоту гипогликемических состояний и частоту развития гипергликемии с кетозом и без. Подтвержденными эпизодами гипогликемии считали случаи снижения уровня глюкозы плазмы <3,1 ммоль/л. К тяжелым гипогликемическим эпизодам относили тяжелые клинические состояния, связанные с нарушениями сознания пациента, потребовавшие проведения инфузионной терапии. Эпизоды гипогликемии, возникшие в интервале времени от 23.00 до 6.00 оценивали как ночные гипогликемии. Гипергликемические состояния с кетозом определяли при уровне гликемии более 14 ммоль/л в сочетании с наличием кетонов в моче. Результаты исследования обработаны с применением пакета программ статистического анализа Microsoft Excel 2003, статистического пакета SТATISTICA, версия 7.0. Количественные признаки представлены как среднее со стандартным отклонением M (m). Качественные бинарные признаки – в виде абсолютной и относительной частоты (%). Различия между сравниваемыми вариационными рядами считали статистически значимыми при уровне р<0,05.
Результаты
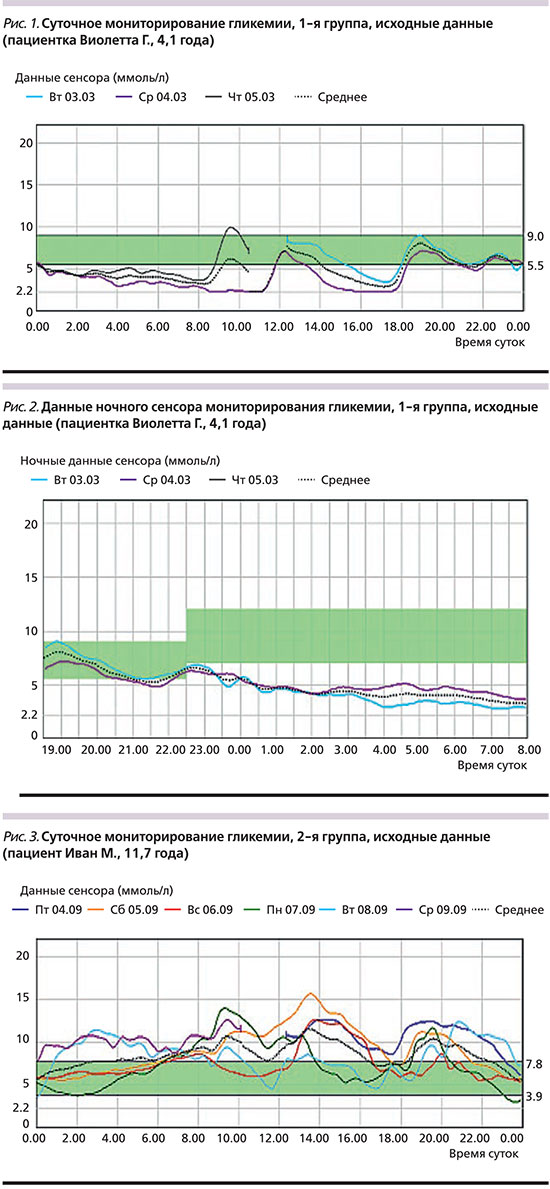
Группы детей разного возраста отличались по основным и дополнительным параметрам, требующим коррекции терапии. В группе детей дошкольного возраста (4 ребенка) основными нарушениями были гипогликемические состояния. Гипергликемия выявлялась в течение 7–10,1% суточного времени; среднее наибольшее значение гликемии в течение суток составило 9,0±1,6 ммоль/л. Среднее наименьшее значение гликемии было 3,4±1,3 ммоль/л, которое фиксировалось в течение 29–74% суточного времени (рис. 1). При этом наиболее частыми нарушениями были ночные гипогликемии (рис. 2). Во 2-й группе (7–12 лет) основной проблемой были гипергликемические эпизоды с кетозом/без кетоза. Средний максимальный уровень гликемии составил 15,7±3,7 ммоль/л, минимальный – 5,6±1,2 ммоль/л (рис. 3).
Для пациентов 3-й группы (подростков) была характерна наиболее высокая вариабельность гликемии: средний максимальный уровень гликемии составил 16,9±3,7 ммоль/л, минимальный – 2,7±0,7 ммоль/л (рис. 4).
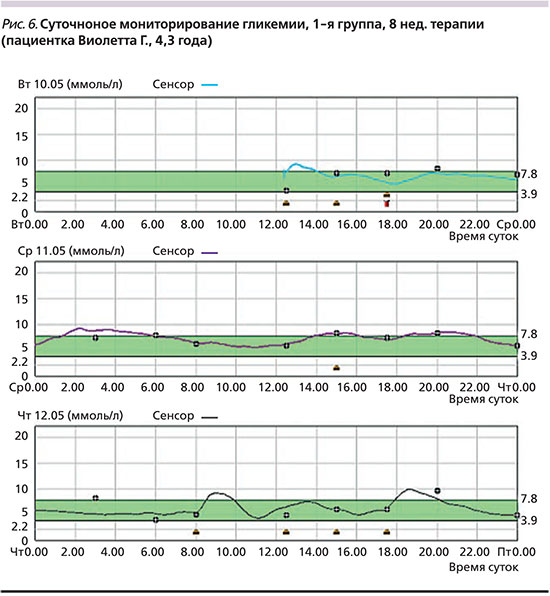
 До перевода пациентов на базис-болюсную терапию инсулином Deg (+Asp) только 14% детей имели целевые показатели гликемического контроля, соответствующие оптимальной компенсации (HbA1c ≤7,5%, ГПН – 4–8 ммоль/л, ППГ– 5–10 ммоль/л, ночная гликемии – 4,5–9 ммоль/л). В то время как 86% детей имели признаки неудовлетворительной компенсации (в 38% случаев HbA1c 7,5–9,0%, в 48% случаев HbA1c >9%) (рис. 5). При первичном анализе (через 12 недель после перевода на Deg) у всех пациентов отмечена статистически значимая положительная динамика показателей углеводного обмена: средний уровень НbА1c в целом снизился с 8,7±2,6% до 7,9±1,55% (р<0,05), ГПН – с 11,4±2,6 до 6,8±1,4 ммоль/л, ППГ – с 11,8±1,9 до 7,9±1,3 ммоль/л. Кроме того, 11 (40%) пациентов 2-й и 3-й групп указали на значительное улучшение общего состояния, что выражалось в хорошей переносимости физических нагрузок без гипогликемических и гипергликемических состояний. Родители детей 1-й группы прежде всего отметили уменьшение частоты гипогликемических состояний, что подтверждено данными дневников самоконтроля, а также значительное улучшение качества ночного сна, в т.ч. в результате уменьшения числа ночных гипогликемий (рис. 6).
До перевода пациентов на базис-болюсную терапию инсулином Deg (+Asp) только 14% детей имели целевые показатели гликемического контроля, соответствующие оптимальной компенсации (HbA1c ≤7,5%, ГПН – 4–8 ммоль/л, ППГ– 5–10 ммоль/л, ночная гликемии – 4,5–9 ммоль/л). В то время как 86% детей имели признаки неудовлетворительной компенсации (в 38% случаев HbA1c 7,5–9,0%, в 48% случаев HbA1c >9%) (рис. 5). При первичном анализе (через 12 недель после перевода на Deg) у всех пациентов отмечена статистически значимая положительная динамика показателей углеводного обмена: средний уровень НbА1c в целом снизился с 8,7±2,6% до 7,9±1,55% (р<0,05), ГПН – с 11,4±2,6 до 6,8±1,4 ммоль/л, ППГ – с 11,8±1,9 до 7,9±1,3 ммоль/л. Кроме того, 11 (40%) пациентов 2-й и 3-й групп указали на значительное улучшение общего состояния, что выражалось в хорошей переносимости физических нагрузок без гипогликемических и гипергликемических состояний. Родители детей 1-й группы прежде всего отметили уменьшение частоты гипогликемических состояний, что подтверждено данными дневников самоконтроля, а также значительное улучшение качества ночного сна, в т.ч. в результате уменьшения числа ночных гипогликемий (рис. 6).
Анализ числа подтвержденных гипогликемических состояний (<3,1 ммоль/л и/или тяжелых клинических проявлений гипогликемии) во всех возрастных группах показал, что на фоне лечения инсулином Deg их абсолютная суммарная частота за анализируемый период уменьшилась с 59 до 43 событий (а относительная частота – с 0,71 до 0,52 эпизода на 1 пациента [средний период наблюдений – 84 дня]). У 24% детей отмечено полное отсутствие эпизодов гипогликемии и у 13% наблюдались только легкие эпизоды гипогликемии (<4 эпизодов в месяц). Наиболее значимо снизилась частота ночных гипогликемий с 31 до 17 событий, а относительная – с 0,36 до 0,2 события на 1 пациента (за 84 дня). У 70,3% пациентов через 8–12 недель терапии, по данным суточного мониторирования, не было зарегистрировано ни одного эпизода ночной гипогликемии.
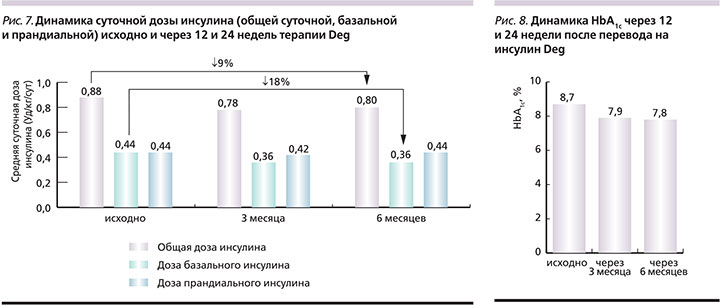
Эпизоды гипергликемии (>14 ммоль/л) с кетозом на фоне терапии инсулином Deg были редкими. Чаще они встречались у детей 7–12 лет и подростков. За период наблюдения общая частота зарегистрированных эпизодов гипергликемии с кетозом снизилась с 77 до 53 событий, относительная частота – с 0,91 до 0,63 события на 1 пациента. За весь период наблюдения не было зафиксировано ни одного случая госпитализации ребенка в отделение реанимации и интенсивной терапии. Суточная доза инсулина за период лечения инсулином Deg в целом снизилась с 0,88 ± 0,09 до 0,78±0,1 ЕД/кг (на 11% от исходной) (рис. 7). Доза базального инсулина до перевода на инсулин Deg составила 0,44±0,12 ЕД/кг, через 8–12 недель после перевода доза инсулина Deg составила 0,36±0,02 Ед/кг (-18% от исходной). При этом средняя доза болюсного инсулина Asp в течение анализируемого периода оставалась без существенных изменений (0,44±0,06 ЕД/кг).
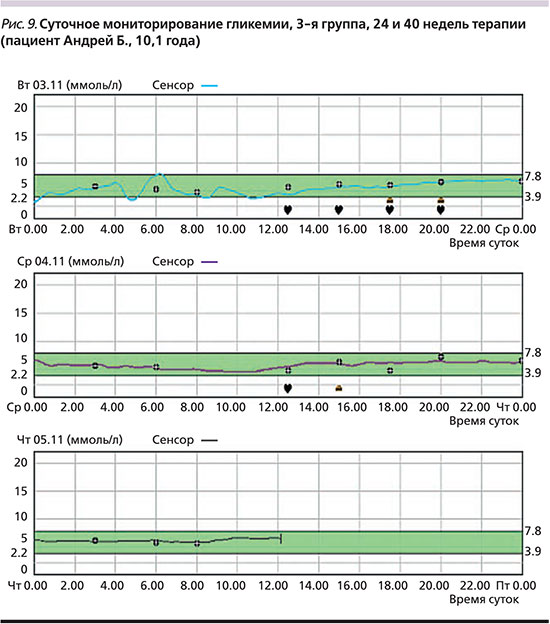
Через 24 недели после перевода на инсулин Deg у большинства (61%) пациентов сохранялась устойчивая тенденция к снижению уровня НbА1c. В конце наблюдения средний уровень HbA1c снизился до 8,7±1,2%; 7,9±0,65%; 7,6±0,65% в 1-й, 2-й и 3-й группах соответственно. У остальных детей отмечено недостоверное незначительное увеличение уровня НbА1c по сравнению с таковым через 12 недель. Однако и у этих пациентов уровень НbА1c в конце исследования был достоверно ниже исходных значений (рис. 8). Кроме того, у всех пациентов через 24 недели после перевода на инсулин Deg сохранялось снижение суточной вариабельности гликемии по сравнению с исходным (рис. 9), а также не отмечено увеличения частоты гипогликемических эпизодов и кетоацидотических состояний по сравнению с оценкой через 12 недель лечения.
Оценка достижения целевых показателей гликемического контроля показала, что в конце периода наблюдения число пациентов, имевших оптимальную компенсацию углеводного обмена, осталось прежним (14%). При этом число детей с субоптимальным контролем (HbA1c в диапазоне 7,5–9,0%) увеличилось с 38 до 49% (+11%), а число детей с уровнем HbA1c >9% уменьшилось с 48 до 37% (рис. 10).
Оценка суточной дозы инсулина показала, что через 24 недели терапии инсулином Deg большинству (66%) пациентов для поддержания оптимального гликемического контроля требовалось применение меньшей дозы инсулина (рис. 7). Лишь у 3 детей доза инсулина в конце исследования соответствовала исходной и у 3 пациентов отмечено некоторое увеличение дозы (+4,1±2,0 ЕД/сут от исходной). В конце периода наблюдения средняя суточная доза инсулина составила 0,8±0,11 ЕД/кг в сутки, что в среднем на 4,6±2,7 ЕД/сут меньше исходной дозы. Снижение общей потребности в инсулине было связано преимущественно с уменьшением дозы базального инсулина (через 24 недели снижение дозы базального инсулина отмечалось у 83% пациентов и составило 5,2±3,1 ЕД/сут).
В целом терапия инсулином Deg хорошо переносилась. Ни у одного из детей, переведенных на деглудек, не было зарегистрировано нежелательных эффектов.
Выводы
Проведенный анализ эффективности и безопасности терапии инсулином Deg у детей и подростков с СД1 показал, что использование инсулина Deg в составе базис-болюсного режима с инсулином аспарт дает возможность повысить эффективность долгосрочной терапии, что связано с улучшением гликемического контроля, снижением вариабельности гликемии, уменьшением потребности в инсулине и снижением частоты гипогликемических состояний. Перевод детей с СД1 с других базальных инсулинов на инсулин деглудек не требует увеличения частоты самоконтроля гликемии и может осуществляться в амбулаторных условиях. Наиболее значимые положительные эффекты получены у детей дошкольного и младшего школьного возраста в условиях хорошего контроля со стороны родителей. Недостаточное качество гликемического контроля в группе подростков, определяющее незначительное увеличение дозы инсулина, требует общих подходов, как и на терапии другими инсулинами.
Конфликт интересов
Я.В. Гирш выступает с лекциями от компаний «Ново Нордиск», «Берлин Хеми», «Мерк»; а также является членом консультационных советов, поддерживаемых компанией «Ново Нордиск».
О.А. Велиева заявляет об отсутствии какого-либо конфликта интересов.
Работа выполнена по инициативе авторов при поддержке компании «Ново Нордиск». Компания не оказывала влияния на выбор пациентов, анализ и интерпретацию результатов исследования.


