Введение
В настоящее время в условиях экологического неблагополучия и бесконтрольного применения антибиотиков резко ухудшилась микроэкология человека. Это привело не только к росту, но и к изменению течения многих неинфекционных заболеваний, т.к. они стали протекать на фоне эндотоксиновой агрессии. Внешняя оболочка грамотрицательных бактерий содержит эндотоксин (липополисахарид). Основным резервуаром бактерий является толстая кишка. Эндотоксин освобождается в просвет кишки в результате разрушения кишечной грамотрицательной микрофлоры, что происходит в процессе ее самообновления, и усиливается в результате антибиотикотерапии. При недостаточности антиэндотоксинового иммунитета, когда концентрация эндотоксина в общем кровотоке превышает физиологически допустимые нормы, развивается эндотоксиновая агрессия [4, 7, 11].
Эндотоксин в организме человека способен изменять регуляцию антителогенеза, активировать В-лимфоциты, освобождать биологически активные вещества, угнетать окислительно-восстановительные процессы, а также вызывать клеточную гипоксию, метаболические нарушения и респираторный дистресс-синдром [2, 14]. Подобный симптомокомплекс наблюдается и при бронхиальной астме (БА), что позволяет предположить возможное участие эндотоксина в формировании данной патологии. Исходя из вышесказанного, целью работы стало определение уровня эндотоксинемии при БА у детей и оценка эффективности энтеросорбента Энтеросгель (полиметилсилоксана полигидрат) в составе комплексной терапии.

Материал и методы исследования
На базе МУЗ детской городской клинической больницы № 2 г. Казани было проведено открытое проспективное рандомизированное клиническое исследование. С этой целью от родителей всех детей было получено информированное согласие на исследование. Изучение клинической значимости эндотоксинемии в развитии БА проводили на 70 детях в возрасте от 10 месяцев до 15 лет. Из них 50 с БА и 20 практически здоровых. Всем пациентам осуществлено углубленное клиническое и специфическое аллергологическое обследование, а также применены лабораторно-инструментальные методы исследования.
Эндотоксин определен LAL-тестом согласно инструкции фирмы-производителя «SIGMA®». Материалом для исследования служила плазма крови, которая забиралась и хранилась в строго апирогенных условиях. Готовился набор пробирок, содержащих по 0,1 мл тестируемой плазмы, раствор эндотоксина с известной концентрацией (0,5 EU/мл, 0,25; 0,125; 0,06; 0,03; 0,015 EU/мл), чистую воду. В каждую пробирку добавлено 0,1 мл препарата Е TOXATE® (Limulus Amebocyte Lysate). После инкубации в термостате в течение 1 часа при 37°С проведено тестирование, которое заключалось в следующем: пробирку с образцом поворачивали на 180˚ и наблюдали признаки гелеобразования. Положительный тест состоял в образовании густого геля, который допускает полный переворот пробирки без его разрушения. Все другие результаты (жидкий гель, повышение вязкости, чистая жидкость) считали отрицательными. Для определения уровня эндотоксина в образце, показавшем положительный результат, его развели чистой водой (в 2, 4, 6, 8, 10 раз и т.д.) и тестировали каждое как исходное, пока не получался отрицательный результат. Уровень эндотоксина определен умножением величины, обратной наибольшему разведению образца, давшему положительный тест, на наименьшую концентрацию стандартного раствора эндотоксина, давшего положительный тест. Результат выражен в EU/мл.
В исследовании по оценке эффективности энтеросорбции приняли участие 45 детей (из 50 детей с БА), которые случайным образом были разделены на 2 группы. В основную группу вошли 25 детей с БА, получавших в составе бронхолитической и противовоспалительной терапии энтеросорбент Энтеросгель в течение 2 недель в возрастной дозировке: дети до 5 лет – по 1 чайной ложке 3 раза в день (15 г), от 5 до 14 лет – по 1 десертной ложке 3 раза в день (30 г), старше 14 лет – по 1 столовой ложке 3 раза в день (45 г). В группу сравнения вошли 20 детей, получавших бронхолитическую и противовоспалительную терапию без энтеросорбента. Бронхолитическая и противовоспалительная терапия между сравниваемыми группами не различалась и в период обострения включала препараты неотложной помощи (ингаляции беродуала, суспензию будесонида через небулайзер, по показаниям – преднизолон парентерально 1–2 мг/кг), в период ремиссии базисную противовоспалительную терапию, согласно степени тяжести (антилейкотриеновые препараты монтелукаст, ингаляционные кортикостероиды (ИГКС), комбинированные препараты ИГКС и β2-агонисты длительного действия) [9]. Все дети, прошедшие курс лечения, закончили его полностью.
 Статистическая обработка данных проводилась с использованием методов вариационной статистики (t-теста) и корреляционного анализа (коэффициент корреляции r) с использованием статистического пакета Statistica. Достоверными считали результаты при p<0,05.
Статистическая обработка данных проводилась с использованием методов вариационной статистики (t-теста) и корреляционного анализа (коэффициент корреляции r) с использованием статистического пакета Statistica. Достоверными считали результаты при p<0,05.
Результаты и обсуждение
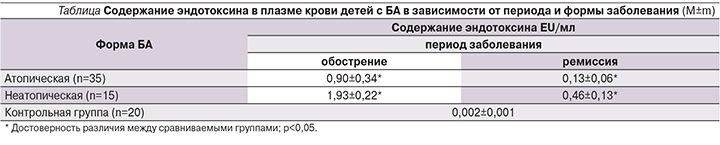
Анализ состояния эндотоксинемии при БА у детей показал (см. таблицу), что в период обострения отмечается увеличение уровня плазменного эндотоксина при атопической форме БА до 0,90±0,34 EU/мл, р<0,001, а при неатопической БА – до 1,93±0,22 EU/мл, р<0,001, тогда как в контрольной группе его значения составили 0,002±0,001 EU/мл.
Изучение клинических особенностей атопической БА у детей в условиях эндотоксинемии показало, что тяжесть заболевания связана с уровнем эндотоксина в плазме крови (рис. 1). Так, при тяжелом течении в период обострения содержание плазменного эндотоксина составило 1,99±0,59 EU/мл, что в 12 раз выше, чем при легких формах (0,16±0,06 EU/мл; р<0,001), и в 4 выше по сравнению со среднетяжелыми формами БА (0,55±0,07 EU/мл; р<0,001). Выявлено, что имеется прямая корреляция частоты приступов, их продолжительности с уровнем эндотоксинемии. Причем, чем чаще приступы БА (r=0,68; р<0,05) и продолжительнее по времени (r=0,64, р<0,05), тем выше содержание эндотоксина в крови. При БА имеется обратная корреляция между количеством плазменного эндотоксина и показателем пикового экспираторного потока – PEF (r=-0,62; p<0,05), свидетельствующая о более выраженном нарушении функции внешнего дыхания с ростом эндотоксинемии.
У больных с тяжелым течением заболевания (атопической БА) в 67% (6 человек из 9) случаев имела место кратковременная температурная реакция (37,3–38,0˚С) при повышении уровня эндотоксина в крови до 2,3 EU/мл. Это объясняется пирогенным действием эндотоксина.
Дисбактериоз кишечника имел место при легких формах у 76% детей (13 из 17), среднетяжелых – у 83% (15 из 18), тяжелых – у 80% (12 из 15).
В 100% случаев (15 человек) при неатопической БА у детей выявлены очаги хронической инфекции в носоглотке, а развитию приступа часто предшествовала их активация. В период ремиссии БА отмечено снижение содержания эндотоксина в крови при атопической форме в 7 раз (до 0,13±0,06 EU/мл [р<0,001]) и при неатопической (в 4 раза до 0,46±0,13 EU/мл [р<0,001]). То есть при атопической форме тем-пы снижения уровня эндотоксине-мии выше, чем при неатопической. При любой степени тяжести заболевания у детей как с атопической, так и с неатопической БА значения эндотоксина в период ремиссии достоверно превышали показатели контрольной группы (р<0,001). Полученные данные свидетельствуют о хронической эндогенной интоксикации организма, более выраженной при неатопической форме заболевания. Чем выше уровень эндотоксина в крови, тем короче продолжительность ремиссии, что подтверждалось наличием обратной корреляции между данными показателями (r=-0,59; p<0,05).
Таким образом, при БА у детей отмечена патологическая эндотоксинемия как в период обострения, так и в ремиссии заболевания. На высоте приступа имела место эндотоксиновая агрессия, указавшая на избыточное поступление эндотоксина в кровоток из кишечника, что подтверждалось высоким уровнем плазменного эндотоксина. Это привело к утяжелению основного заболевания, увеличению продолжительности приступов, их частоты, укорочению периода ремиссии и снижению показателей функции внешнего дыхания.
Наличие системной эндотоксинемии служит показанием к включению в состав комплексной терапии БА препаратов, оказывающих энтеросорбционное детоксикационное и цитопротекторное действия, а также благоприятно влияющих на микрофлору кишечника [3, 7, 10]. Таким лекарственным средством является энтеросорбент Энтеросгель. Энтеросгель характеризуется высокой поглощающей способностью по отношению к эндотоксину грамотрицательных бактерий, обладает цитопротекторным действием на слизистую оболочку желудочно-кишечного тракта, благоприятно влияет на микрофлору толстого кишечника [5, 8]. При включении Энтеросгеля в схему базисной терапии атопической БА отмечено положительное действие препарата [12]. Оно приводило к значительному снижению интоксикации и антигенной агрессии, уменьшало иммунодепрессивное действие эндогенных токсинов [3]. Также Энтеросгель применяли в составе комплексной терапии в лечении БА для медикаментозной коррекции дисбаланса в системе свободнорадикального окисления и антиоксидантной защиты на фоне базисной терапии обострения БА [6]. Известно применение Энтеросгеля для профилактики БА у детей, проживающих на индустриально развитых территориях и имеющих повышенный уровень токсинов в биосредах, способствующих развитию и прогрессированию атопического марша [1].
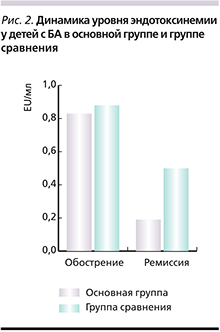
У больных детей в сравниваемых группах в исходном состоянии отмечены примерно одинаковые показатели эндотоксинемии, достоверно превышающие значения у практически здоровых (р<0,001). В основной группе детей с БА (рис. 2) имело место достоверное снижение уровня эндотоксина – от 0,90±0,58 до 0,07±0,03 EU/мл в (12,8 раза; р<0,001), тогда как в группе сравнения – от 0,91±0,59 до 0,33±0,12 EU/мл (в 2,7 раза).Снижение уровня эндотоксинемии при БА у детей сопровождалось положительным клиническим эффектом, отмеченным у 76% (19 детей основной группы) укорочением приступного периода в 3 раза. Так, в среднем длительность приступа БА у детей на фоне коррекции эндотоксинемии составила 1,3 часа (до лечения – 4,0 часа), р<0,05. На фоне коррекции эндотоксинемии при БА происходило значительное улучшение показателей функции внешнего дыхания – увеличение PEF и объема форсированного выдоха за 1 секунду на 25–30%, в то время как в группе сравнения отмечено повышение этих показателей на 15–20%.
Заключение
У детей с БА установлено наличие системной эндотоксинемии. Причем содержание плазменного эндотоксина у детей в период обострения БА превышает таковые показатели у здоровых, снижается в период ремиссии, но не достигает показателей физиологической эндотоксинемии. Уровень плазменного эндотоксина зависит от тяжести течения и формы заболевания. Наличие синдрома системной эндотоксинемии служит показанием к проведению энтеросорбции. Назначение энтеросорбента Энтеросгель в составе бронхолитической и противовоспалительной терапии БА приводит к сокращению приступного периода в 3 раза, улучшению показателей функции внешнего дыхания на 25–30% на фоне снижения уровня плазменного эндотоксина.



