Аллергия – это реакция, вызываемая аллергеном и сопровождающаяся инфильтрацией воспалительных клеток в органы-мишени. Аллергическая реакция может быть IgE (иммуноглобулин Е)-опосредованной и IgE-независимой, проявляться ранней и поздней фазами. Ранняя фаза реализуется в течение 15 минут и обусловлена высвобождением гистамина; лейкотриены (LT) как медиаторы воспаления участвуют и в ранней, и в поздней фазах.
Лейкотриены (LTC4, LTD4, LTЕ4) образуются из арахидоновой кислоты в тучных клетках после воздействия аллергена, провоспалительных цитокинов или других рецептор-зависимых стимулов [1]. Высвобождаясь из тучных клеток, они взаимодействуют со специ-фическими цистеиниловыми рецепторами (CysLT1), экспрессированными на клетках иммунной системы (моноцитах, макрофагах, эозинофилах, базофилах, нейтрофилах, Т- и В-лимфоцитах, тучных клетках) и таргетных клетках структурных органов, таких как гладкомышечные клетки дыхательных путей, эпителиальные и эндотелиальные клетки, а также фибробласты, дендритные клетки. Взаимодействие LT с CysLT1-рецепторами тесно связано со многими аспектами иммунопатогенеза бронхиальной астмы (БА), включая хроническое воспаление, бронхоконстрикцию, бронхиальную гиперреактивность, гиперсекрецию слизи и ремоделирование дыхательных путей, а также вазодилатацию, увеличение проницаемости сосудистой стенки и развитие отека, что приводит к развитию ринита, крапивницы. LT являются более мощным провоспалительным медиатором, в 100 раз активнее гистамина. Эозинофилы, базофилы и тучные клетки служат главным источником LT, а также эпидермальные клетки способны к преобразованию LTА4 в LTВ4, LTС4 [2].
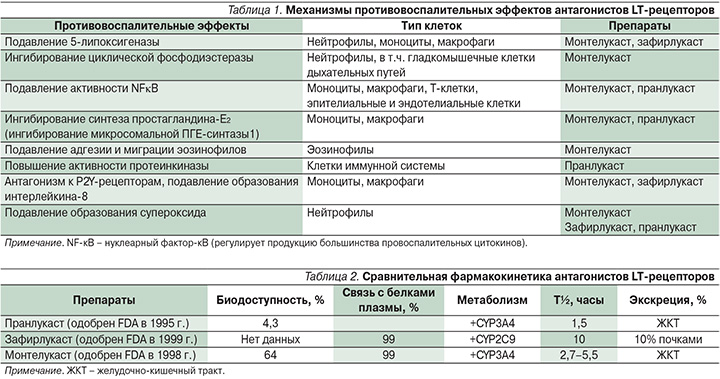
Среди препаратов, воздействующих на активность LT, выделяют антилейкотриены – антагонисты лейкотриеновых рецепторов (LT-рецепторов): пранлукаст, зафирлукаст, монтелукаст, а также ингибитор биосинтеза LT: зилеутон. Действие на LT позволяет оказывать специфическое воздействие на аллергическое воспаление, ринит, астму, крапивницу. Механизмы развития противовоспалительных эффектов антагонистов LT-рецепторов перечислены в табл. 1.
Антагонисты LT-рецепторов рекомендованы в качестве альтернативных препаратов в лечении аллергического ринита (АР) в дополнение к антигистаминным препаратам (АГП) в лечении хронической крапивницы в дополнение к ингаляционным глюкокортикоидам (ИГКС) при лечении БА, особенно в педиатрии.
Монтелукаст – один из популярных препаратов группы антагонистов LT-рецепторов. Помимо известной способности монтелукаста блокировать CysLT1-рецепторов и уменьшать аллергические реакции и воспаление препарат имеет дополнительные вторичные механизмы противовоспалительного действия, связанные с ингибированием 5-липооксигеназы [3], значительным уменьшением высвобождения цитокинов Th2-клеток и уменьшением сосудистого эндотелиального фактора роста и TGF-β1 (β1-трансформирующий фактор роста) в легочной ткани, что может уменьшить ремоделирование дистальной паренхимы легкого и развитие фиброза легких [4].
Монтелукаст обладает наилучшей фармакокинетикой среди препаратов данного класса. В отличие от других антагонистов LT-рецепторов монтелукаст имеет высокую биодоступность после приема внутрь (табл. 2). Монтелукаст доступен на фармацевтическом рынке в нескольких пероральных формах, таких как обычные таблетки с немедленным высвобождением, жевательные таблетки, что позволяет применять его детям и пожилым пациентам.
Монтелукаст наиболее предпочтителен среди антилейкотриенов: он лишен клинически значимых лекарственных взаимодействий, применяется однократно в сутки, разрешен к применению у детей. По данным ТОР-анализа наиболее часто назначаемых препаратов в мире монтелукаст вошел в первую десятку в 2015 г.
Антагонисты LT-рецепторов в лечении БА
БА относится к аллергическим заболеваниям, но при этом характеризуется наличием хронического воспаления в дыхательных путях, обусловленного активацией тучных клеток, эозинофилов, базофилов, Т-лимфоцитов и высвобождением гистамина, простагландинов и LT. LT играют важную роль в патогенезе развития всех вариантов и фенотипов БА. Они вызывают сокращение гладких мышц бронхов, выделение слизи, отек и повышение проницаемости сосудов, способствуют эозинофильному воспалению [5]. К факторам, стимулирующим образование и высвобождение LT, относятся различные аллергены, охлаждение и сухость дыхательных путей. Максимальное увеличение продукции LT наблюдается при тяжелом течении БА, при обострении заболевания, индуцированном вирусной инфекцией, аллергической провокацией, табачным дымом, ацетилсалициловой кислотой, при астме физической нагрузки, а также у пациентов с повышенным индексом массы тела.
Противовоспалительные эффекты антагонистов LT-рецепторов при БА опосредуются блокадой CysLT1-рецепторов на тучных и других клетках иммунной системы и таргетных клетках верхних и нижних дыхательных путей. Антагонисты LT-рецепторов уменьшают выраженность спазма гладкой мускулатуры бронхиол и сосудов, отека; подавляют миграцию эозинофилов и макрофагов; уменьшают секрецию слизи и улучшают мукоцилиарный транспорт [6].
Эффективность антагонистов LT-рецепторов в лечении БА изучалась с 1990-х гг. За последние годы были проведены серии мета-анализов, объединивших результаты этих исследований. Показано, что применение антагонистов LT-рецепторов улучшает симптомы БА и проходимость бронхов; добавление антагонистов LT-рецепторов к терапии ИГКС уменьшается риск обострений заболевания на 36–48% [7–9]. Кроме того, применение антагонистов LT-рецепторов пациентами с легкими персистирующими симптомами БА позволят достигать лучшего контроля БА.
Эффективность монтелукаста в лечении БА у взрослых и детей была показана в нескольких исследованиях.
В двух ранних плацебо-контролируемых исследованиях взрослых с БА монтелукаст улучшал показатели ОФВ1 (объем форсированного выдоха за первую секунду), потребность в β2-агонистах, симптомы ночной астмы [10, 11]. В крупном плацебо-контро-лируемом исследовании у 681 взрослого больного БА применение монтелукаста в дозе 10 мг в вечернее время улучшало ОФВ1, пиковую скорость выдоха и симптомы БА [12]. В крупном наблюдательном исследовании в реальной практике у взрослых с неконтролируемой БА добавление монтелукаста приводило к увеличению ОФВ1 и контролю симптомов астмы (утренние и ночные симптомы, дневная активность, одышка), но не уменьшало потребности в приеме β2-агонистов [13].
В сравнительном исследовании у 895 пациентов с хронической БА монтелукаст (10 мг/сут перед сном) по эффективности уступал беклометазону (200 мкг 2 раза в сутки): прирост ОФВ1 составил 7,4 против 13,1% соответственно [14]. Однако в наблюдательном исследовании в реальной практике у 326 пациентов с БА (в возрасте 12–80 лет) монтелукаст показал сопоставимую эффективность с ИГКС в качестве терапии 1-й линии для контроля симптомов БА или потребности в добавлении β2-агонистов длительного действия [15].
В исследовании монтелукаста в дозе 10 мг/сут и флутиказона пропионата 500 мкг/сут у 1019 пациентов с БА и длительным анамнезом курения монтелукаст показал сопоставимый клинический эффект по контролю симптомов БА в течение 6 месяцев лечения (45 и 49% дней без симптомов в группах соответственно), причем монтелукаст был эффективнее флутиказона пропионата при стаже курения более 11 лет [16].
Все антагонисты LT-рецепторов лицензированы для применения при БА у детей, но наиболее изученным в клинических исследованиях препаратом является монтелукаст. Антагонисты LT-рецепторов рекомендованы в качестве альтернативных препаратов ИГКС при нетяжелой БА у детей или при невозможности применения ИГКС детьми, а также для дополнения к терапии ИГКС при недостаточном контроле симптомов БА средней тяжести и тяжелой формы.
В исследовании 336 детей в возрасте 6–14 лет с БА было показано, что применение монтелукаста 5 мг/сут увеличивает ОФВ1 на 8,23% от исходного уровня по сравнению с 3,58% в группе плацебо [17]. Аналогичный эффект монтелукаста был получен при терапии БА у детей в возрасте 2–5 лет без клинически значимых побочных эффектов [18]. Однако в сравнительном исследовании с будесонидом различий в клинической эффективности в течение 52 недель между группами не наблюдалось [19]. В когорте, которая включила 506 детей (2–18 лет) с умеренной персистирующей БА, монтелукаст назначался как стартовый препарат в течение 6 недель. В результате значительно улучшались показатели симптомов и тяжести БА, участвовавшие педиатры и родители были удовлетворены лечением [20].
Кроме того, лечение монтелукастом связано с уменьшением сопротивления дыхательных путей при астме, вызванной физическими упражнениями, особенно у детей [21]. В первом исследовании 27 детей 6–14 лет с БА изучалась эффективность монтелукаста в тесте с физической нагрузкой в качестве конечной точки. Монтелукаст при регулярном приеме приводил к уменьшению степени снижения ОФВ1 в течение 60 минут после физического усилия. В последующих исследованиях изучалась возможность однократного приема одной дозы монтелукаста перед физической нагрузкой детьми (прием перед нагрузкой «по потребности») и был показан защитный эффект препарата в течение 12 часов.
В недавнем мета-анализе 26 рандомизированных контролируемых исследований (РКИ) было показано, что применение монтелукаста для длительного лечения БА значительно уменьшало число обострений БА (относительный риск [ОР]=0,60) как при использовании в качестве препарата 1-й линии (ОР=0,54), так и в дополнение к проводимой терапии (ОР=0,58); но уступал ИГКС и ИГКС в комбинации с β2-агонистами длительного действия в качестве 1-й линии лечения и уступал β2-агонистам длительного действия в качестве дополнительной терапии. Наибольший клинический эффект наблюдался в подгруппе больных с БА и АР (ОР=0,55). При обострениях БА монтелукаст показал тенденцию к уменьшению потребности в госпитализации (ОР=0,72; р=0,09), достоверно улучшал пиковую скорость выдоха и потребность в системных кортикостероидах (ОР=0,43) [22].
Антагонисты LT-рецепторов в лечении АР
АР – это симптоматическое и воспалительное заболевание слизистой оболочки носа, характеризующееся зудом в носу, пароксизмальным повторяющимся чиханием, водянистой ринореей, пониженным обонянием и заложенностью носа.
При АР воспалительные клетки, включая тучные клетки, CD4-положительные Т-клетки, В-клетки, макрофаги и эозинофилы, инфильтрируют слизистую оболочку носа при воздействии возбуждающего аллергена (чаще всего в воздухе содержатся частицы пылевого клеща, остатки тараканов, перхоть, плесень, пыльца). Т-клетки, проникающие в слизистую оболочку носа, высвобождают цитокины (интерлейкины-3, -4, -5, -13), способствующие образованию иммуноглобулина E (IgE) плазматическими клетками и IgE-обусловленное высвобождение медиаторов, таких как гистамин и LT. Взаимодействие их с таргетными клетками дыхательных путей и носовой полости приводит к расширению артериол, повышению проницаемости сосудов, развитию зуда, ринореи, слизистой гиперсекреции. Медиаторы и цитокины, высвобождающиеся в ранней фазе иммунного ответа на стимулирующий аллерген, вызывают дальнейший клеточный воспалительный ответ в течение последующих 4–8 часов (реакция воспаления в поздней фазе), что приводит к рецидивам (обычно к заложенности носа).
Патогенез заболевания указывает на то, что АР связан с другими воспалительными заболеваниями слизистых оболочек, такими как БА, риносинусит, хронический средний отит и аллергический конъюнктивит [23]. Медиаторы воспаления, такие как гистамин и LT, играют ключевую роль в развитии симптомов АР; АГП и антагонисты LT-рецепторов являются широко применяемыми средствами для лечения.
Монтелукаст изучался при лечении сезонного АР, поскольку LT играют роль в его патогенезе.
В систематическом обзоре 8 РКИ (n=3950) с применением монтелукаста для лечения АР в качестве первичной конечной точки оценивалась шкала тяжести дневных симптомов, полученных при индивидуальной самооценке заложенности носа, ринореи, носового зуда и чихания [24]. Во всех исследованиях монтелукаст показал достоверное улучшение симптомов ринита по сравнению с плацебо. В качестве монотерапии монтелукаст проявлял эффективность, сопоставимую с лоратадином, но меньшую, чем таковую интраназального кортикостероида флутиказона пропионата. Использование монтелукаста в сочетании с АГП, такими как лоратадин или цетиризин, приводило к большей эффективности, чем при использовании этих препаратов в монотерапии, а в некоторых исследованиях результаты были сравнимыми с интраназальными кортикостероидами [25, 26].
Проведен мета-анализ 20 РКИ (n=10270) по оценке эффективности применения монтелукаста для лечения АР [27]. По сравнению с плацебо монтелукаст приводил к достоверному уменьшению выраженности симптомов на 3,4% по шкале дневных назальных симптомов, в т.ч. в подгруппе с хроническим ринитом – на 4,6% и при сочетании с БА – на 4,4%; по шкале оценки качества жизни RQLQ (Rhinoconjunctivitis Quality-of-Life Questionnaire) монтелукаст превосходил плацебо на 0,2 балла. В сравнительных исследованиях АГП на 3% превосходили эффективность монтелукаста по тяжести дневных назальных симптомов, но не отличались по динамике шкалы качества жизни RQLQ. В сравнительных исследованиях назальные кортикостериоды по эффективности превосходили монтелукаст на 8,4% по шкале дневных назальных симптомов; но в подгруппе пациентов с сочетанием АР и БА достоверных различий между назальными кортикостероидами и монтелукастом не было. В исследованиях с использованием комбинации монтелукаста с АГП отмечалась наибольшая динамика на 11,8% по шкале дневных назальных симптомов и на 0,4 балла – по шкале качества жизни RQLQ по сравнению с плацебо; различий в эффективности назальных кортикостероидов не было (разница – 2% по шкале дневных назальных симптомов).
В другом мета-анализе 11 РКИ (n=14 809) при сравнении эффективности применения монтелукаста и лоратадина в лечении АР по шкалам назальных симптомов и качества жизни были получены сопоставимые результаты динамики дневных назальных симптомов и показателей шкалы RQLQ и лучшая эффективность по шкале ночных назальных симптомов в группе монтелукаста [28].
В специально проведенном мета-анализе 13 РКИ (n=6867) по оценке качества жизни на фоне лечения АР АГП и монтелукастом была показана сопоставимая динамика по шкале RQLQ: -1,88 балла в группе лоратадина, -1,36 в группе цетиризина, -0,91 в группе дезлоратадина и -1,64 в группе монтелукаста по сравнению с плацебо [29].
Особое практическое значение имеет применение антагонистов LT-рецепторов в терапии сочетанной БА и АР. Все чаще признается, что эти два состояния взаимосвязаны общим патофизиологическим механизмом и зачастую описываются как «одно связанное заболевание дыхательных путей»: 40% пациентов с АР имеют БА, у 80% больных БА имеется АР [30].
В двух крупных наблюдательных когортных исследованиях оценивалась эффективность применения монтелукаста в качестве дополнительной терапии при лечении БА и симптомов АР у пациентов, получавших ИГКС и β2-агонисты длительного действия. Были включены 5769 (возраст ≥4 лет) и 5855 пациентов соответственно. Оценивали симптомы астмы и АР. Добавление монтелукаста приводило к значительному улучшению всех симптомов АР (чихание, зуд, ринорея, заложенность носа, покраснение глаз) в дополнение к контролю симптомов астмы. Было показано, что добавление монтелукаста позволяет улучшать течение БА и ринита у пациентов, неадекватно контролируемых на терапии ИГКС и β2-агонистами длительного действия [31, 32].
Кроме того, применение монтелукаста пациентами с хроническим АР на фоне полипоза также улучшает симптомы ринита, в т.ч. при добавлении к интраназальным кортикостероидам [33].
Антагонисты LT-рецепторов в лечении аллергических заболеваний кожи
Крапивница относится к числу аллергических заболеваний кожи и характеризуется появлением локального отека, эритемы, волдырей и кожного зуда; длительность симптомов более 6 недель относится к хронической крапивнице. Патофизиологической основой крапивницы является локальная вазодилатация с повышенной проницаемостью капилляров и малых венул, за которыми следует транссудация плазменных составляющих в папиллярную и верхнюю ретикулярную дерму. Многие медиаторы воспаления вовлечены в патогенез хронической крапивницы, такие как гистамин, LT, простагландины, цитокины [34]. LT играют важную роль в патогенезе развития хронической крапивницы и других кожных аллергических заболеваний, таких как атопический дерматит [35].
АГП являются препаратом 1-й линии для всех пациентов с хронической крапивницей [36]. Однако хроническая крапивница часто может быть рефрактерной к стандартной терапии АГП даже в увеличенных дозах. Для пациентов с тяжелым течением крапивницы, которая не купируется стандартной терапией АГП, применяются антагонисты LT-рецепторов.
Положительные результаты лечения антагонистами LT-рецепторов получены от больных разными формами хронической крапивницы, особенно вызванной нестероидными противовоспалительными средствами [37–39].
В двух исследованиях сравнивалась эффективность применения монтелукаста с АГП (фексофенадин, цетиризин) в лечении хронической идиопатической или аспириновой крапивницы. Результаты показали сопоставимую эффективность монтелукаста с АГП.
Монтелукаст показал эффективность в лечении хронической крапивницы, резистентной к АГП. В исследовании у 25 пациентов добавление к терапии АГП монтелукаста по 10 мг/сут значительно улучшало течение хронической крапивницы у 50% больных [40].
В ряде исследований пациентов с хронической крапивницей применение монтелукаста в комбинации с АГП имело наилучшие результаты по эффективности. Так, в крупном сравнительном исследовании у 160 больных хронической крапивницей изучалась эффективность монотерапии монтелукастом в дозе 10 мг/сут и дезлоратадином в дозе 5 мг/сут, а также их комбинации в течение 6 недель [41]. Эффективность терапии оценивали по общей динамике симптомов заболевания, динамике ночных симптомов и дневной активности. Во всех группах по сравнению с плацебо наблюдалась достоверная динамика по количеству и размеру волдырей, но наилучшая эффективность была достигнута в группе комбинации дезлоратадина и монтелукаста.
В другом исследовании 81 пациенту с хронической крапивницей проводилось сравнение эффективности монотерапии дезлоратадином и комбинация монтелукаста с дезлоратадином [42]. Лечение продолжалось в течение 8 недель; критерием оценки эффективности была динамика симптомов по шкале UAS (Urticarial Activity Score) и визуальной аналоговой шкале. В конце лечения в группе монотерапии дезлоратадином динамика симптомов составила 69%, в группе комбинации с монтелукастом – 88,9%, полное купирование симптомов крапивницы отмечено у 16 и 73% пациентов соответственно.
В сравнительном исследовании у 120 пациентов с хронической крапивницей изучалась эффективность в трех группах комбинаций: гидроскизин с цетиризином, гидроксизин с фамотидином и гидроскизин с монтелукастом по сравнению с плацебо [43]. Клиническая эффективность оценивалась по динамике симптомов по шкале UAS. Через 4 недели терапии из группы плацебо выбыли 43% больных; эффективность в группах активной терапии составила 23,3%, 63,3 и 53,3% соответственно в виде уменьшения баллов по шкале на 25% и более.
В двух исследованиях у 30 и 29 пациентов с хронической крапивницей добавление монтелукаста к лечению способствовало достоверному улучшению симптомов по шкале UAS и качества жизни по сравнению с плацебо [44, 45].
LT участвуют в патогенезе развития атопической экземы, ассоциируемой с активацией тучных клеток и высвобождением провоспалительных медиаторов [46]. В нескольких исследованиях у пациентов с атопической экземой отмечено достоверное улучшение течения заболевания на фоне терапии монтелукастом в дозе 5–10 мг в течение 4–8 недель.
Заключение
LT как провоспалительные медиаторы играют важную роль в патогенезе развития аллергических заболеваний, что обосновывает применение антагонистов LT-рецепторов. Монтелукаст – наиболее часто назначаемый препарат класса антагонистов LT-рецепторов, обладающий оптимальной фармакокинетикой. Монтелукаст имеет большую доказательную базу по эффективности контроля симптомов БА и может применяться в качестве альтернативной терапии ИГКС в лечении нетяжелой БА, особенно у детей, что подтверждается результатами длительных исследований в условиях реальной практики. Особое значение имеет применение монтелукаста пациентами в с сочетанием БА и АР. В лечении хронической крапивницы монтелукаст позволяет купировать симптомы при комбинации с АГП и в случаях резистентности к ним.


