Обоснование
Бронхиальная астма (БА) и хроническая обструктивная болезнь легких (ХОБЛ) – гетерогенные заболевания [1–4]. Их гетерогенность проявляется в неоднородности клинических симптомов и разным ответом на базисную терапию. В основе этих проявлений лежат патогенетические механизмы, обусловленные разными типами воспаления дыхательных путей [5–8]. Гетерогенность отражается в фенотипе заболевания. Их фенотипирование основывается на выявлении доминирующего подтипа воспаления дыхательных путей и биологических маркерах. Фенотип – это совокупность всех свойств и признаков особи, сформировавшихся в результате взаимодействия генотипа с окружающей средой. Изучение фенотипов заболевания способствует индивидуальному подходу к ведению пациентов и назначению своевременной адекватной противовоспалительной терапии в зависимости от клинического течения заболеваний [9, 10].
БА является хроническим заболеванием, характеризующимся иммунным воспалением бронхов с развитием гиперреактивности и возникновением вследствие этого симптомов бронхообструкции. Клинические фенотипы астмы формируются на основании эндотипа и факторов внешней среды. Выделяют два эндотипа: Th2- и не-Th2-эндотип [11]. Один эндотип может формировать несколько фенотипов.
К Th2-эндотипу относят аллергическую БА, аспириновую БА, БА физического усилия, позднюю эозинофильную БА, БА с ожирением, БА курильщика, малогранулоцитарную БА, в формировании которой участвуют гладкомышечные клетки, и БА с очень поздним дебютом в патогенезе этих фенотипов астмы лежит не-Th2-эндотип [12, 13].
На современном этапе выделяют воспалительные биофенотипы БА, которые отражают преимущественный тип клеток, вовлеченных в воспаление дыхательных путей. К биофенотипам относят эозинофильную БА, которая характеризуется наличием эозинофилов ≥3% в индуцированной мокроте (ИМ), нейтрофильную БА, когда нейтрофилы составляют ≥61% в ИМ, смешанную гранулоцитарную БА, малогранулоцитарную БА, когда число эозинофилов и нейтрофилов в ИМ в норме [14, 15]. Распространенность фенотипов воспаления БА, по данным цитологического исследования мокроты, вариабельна. В обзоре Г.Б. Федосеева и соавт. приводятся данные о распространенности типов воспаления респираторного тракта при БА: эозинофильное воспаление наблюдалось у 63,8%, нейтрофильное – у 10%, смешанное гранулоцитарное – у 10% и малогранулоцитарное – у 26,2% [16].
Ярким представителем эозинофильного воспаления дыхательных путей является аллергическая БА. Остается дискуссионным вопрос: какое воспаление преобладает при неаллергической БА (НАБА)? Отличительной особенностью НАБА является персистенция воспаления дыхательных путей преимущественно неаллергического генеза и толерантность к лечению глюкокортикостероидом (ГКС) [17]. Авторы связывают такое течение с преобладанием нейтрофильного воспаления в респираторном тракте [18, 19].
ХОБЛ – хроническое обструктивное заболевание бронхолегочного аппарата, в основе патогенеза которого лежит воспаление дыхательных путей. Патофункциональные и клинические проявления ХОБЛ характеризуются частично обратимым, а в дальнейшем необратимым нарушением бронхиальной проходимости и формированием эмфиземы. Данная патология имеет прогрессирующее течение с выраженными системными эффектами, которые приводят к тяжелому течению заболевания.
Больные ХОБЛ также разнородны по клиническому течению заболевания, по ответу на терапию, это способствовало выделению фенотипов данной патологии. Патогенез ХОБЛ обусловлен нарушением мукоцилиарной функции, ремоделированием воздухоносных путей, гиперинфляцией, системной воспалительной реакцией, коморбидной патологией. В зависимости от индивидуальных особенностей больных уже давно выделяют две основные клинические формы заболевания – эмфизематозную и бронхитическую, имеющие четкие разграничительные признаки, определяемые как фенотипы [20]. Эмфизематозный тип («розовые пыхтельщики») характеризуется одышкой, отсутствием цианоза, сниженной массой тела; бронхитический тип («синие отечники») – хроническим бронхитом, цианозом, отеками нижних конечностей и другими признаками правожелудочковой сердечной недостаточности. На протяжении многих лет эти два фенотипа ХОБЛ не потеряли актуальности и в настоящее время.
Для ХОБЛ характерно нейтрофильное воспаление дыхательных путей. Исследования показывают, что у некоторой части пациентов с ХОБЛ в мокроте и крови преобладают эозинофилы [21]. В литературе описывается, что у 34% больных ХОБЛ преобладает эозинофильный тип воспаления дыхательных путей [22]. Отмечено, что больные ХОБЛ с эозинофильным фенотипом хорошо отвечают на терапию ингаляционными ГКС (ИГКС) [23, 24], что приводит к снижению уровня эозинофилов в мокроте, улучшает течение заболевания и качество жизни пациентов [25, 26]. Однако существует риск развития побочных эффектов при лечении ГКС, в первую очередь пневмоний [27], а также гематом, кандидоза полости рта, осиплости голоса [28, 29]. Поэтому назначение ИГКС при ХОБЛ должно быть обоснованно.
По данным обзора. тип воспаления дыхательных путей оценивается по показателям клеточного состава крови, а именно по числу эозинофилов. Но этого не всегда бывает достаточно для определения типа воспаления, т.к. уровень эозинофилов – показатель лабильный, зависит от многих факторов и сопутствующей патологии. Поэтому нами были изучены дополнительные маркеры, которые могут принимать участие в воспалении дыхательных путей при НАБА и ХОБЛ. Изученные и выделенные маркеры типов воспаления дыхательных путей, у больных НАБА и ХОБЛ позволят дифференцированно подойти к диагностике и терапии данной патологии.
Цель исследования: определить маркеры типов воспаления дыхательных путей у больных НАБА и ХОБЛ.
Методы
Обследованы 99 больных с диагнозом НАБА и ХОБЛ на базе ГБУЗ «Клиническая больница № 4» Пензы. Диагнозы «бронхиальная астма» и «хроническая обструктивная болезнь легких» выставлены на основании международных рекомендательных документов GINA (Global Initiative for Asthma) 2019 и GOLD (Global Initiative for Chronic Obstructive Lung Disease) 2019.
Больные были разделены на две группы: 1-ю (n=49) составили больные НАБА, средний возраст – 56 лет, средняя длительность течения заболевания – 10 лет, мужчин – 13 (26,50%) человек, женщин – 36 (73,50%); 2-ю группу (n=50) – больные ХОБЛ, средний возраст которых составил 57 лет, средняя длительность течения заболевания – 9 лет, мужчин – 37 (74%) человек, женщин – 13 (26%). Контрольную группу составили 17 практически здоровых лиц, сопоставимых по полу и возрасту с пациентами изучаемых групп.
По степени тяжести больные НАБА были распределены следующим образом, среднетяжелое течение – 18 (36,74%) больных, тяжелое течение – 31 (63,26%). Все больные НАБА получали лечение в соответствии со ступенчатой терапией, рекомендованной GINA-2019. Выбор доз ИГКС соответствовал степени тяжести заболевания. Средние дозы ИГКС получали 12 (24,49%), высокие дозы – 37 (75,51%) человек, треть больных НАБА получали монотерапию ИГКС, остальные – комбинированную терапию: ИГКС в комбинации с длительно действующими β2-агонистами (ДДБА – длительнодействующие β2-агонисты).
Среднетяжелое течение отмечено у 20 (40%) больных ХОБЛ, тяжелое – у 30 (60%). Все больные ХОБЛ в соответствии с GOLD-2019 получали базисную терапию. Бронхолитическую терапию (длительно действующие антихолинергические препараты – ДДАХП в сочетании с ДДБА) получали 8 (16%) человек, лечение ИГКС в сочетании с ДДАХП/ДДБА – 42 (84%).
Общее клиническое обследование включило клинический осмотр пациентов, сбор анамнеза, оценку степени тяжести течения заболевания, общий анализ крови с подсчетом процентного и абсолютного числа нейтрофилов, эозинофилов, исследование общего анализа ИМ. ИМ получали с помощью ингаляций сальбутамолом 100 мкг по 2 вдоха. Затем через 30 минут делали ингаляции через ультразвуковой небулайзер 3%-ным раствором натрия хлорида сеансами по 7 минут. После ингаляций больные тщательно полоскали рот кипяченой водой. Затем мокрота собиралась в кабинете для сбора мокроты в стерильный контейнер с плотно закрывающейся крышкой [30].
ECP в сыворотке крови определяли методом иммуноферментного анализа (ИФА) при помощи тест-системы «Human Eosinophil Cationic Protein ElisaKit» (AvisceraBioscience, США). Определение уровня НЭ в сыворотке крови определяли с помощью тест-систем для ИФА «Human PMN-Elastase Platinum ELISA» (eBioscience, Австрия). Концентрацию выражали в нг/мл.
Статистическая обработка результатов проводилась с использованием пакета прикладных программ Statistica 6.0 и программы SPSS для проведения ROC (receiver operating characteristic)-анализа. При сравнении групп между собой использовали критерий Манна–Уитни. Показатели представлены в виде медианы (Ме) и квартилей (Q25%; Q75%). Проведен многофакторный анализ для определения значимых факторов и их связи между собой с использованием метода корреляционного анализа по Спирмену. Для определения пороговых значений показателей и их чувствительности и специ-фичности использовали ROC-анализ. Результаты считались статистически значимыми при р<0,05.
Результаты
При исследовании цитологического состава ИМ и крови больных НАБА и ХОБЛ были получены следующие результаты (табл. 1).
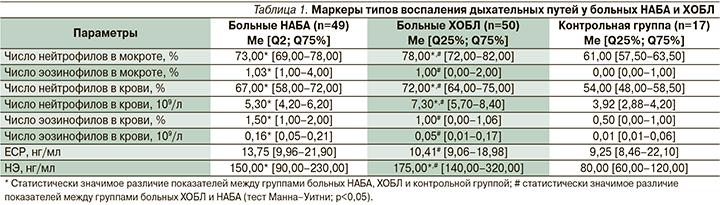
При исследовании ИМ достоверно высокий уровень нейтрофилов определялся у больных как НАБА (73,00% от всех клеток в образце), так и ХОБЛ (78,00% от всех клеток в образце) по сравнению со здоровыми лицами (р<0,05). Содержание эозинофилов в ИМ было достоверно повышено у больных НАБА по сравнению с больными ХОБЛ и контрольной группой (р<0,05). Достоверных различий уровня эозинофилов в ИМ у больных ХОБЛ по сравнению с группой контроля обнаружено не было (р>0,05). Тем не менее высокий уровень эозинофилов в ИМ (более 3%) отмечен не у всех больных НАБА, только у 12 (24,48%). Также выявлено, что у 5 (10%) больных ХОБЛ число эозинофилов было повышено (более 3%).
При изучении клеточного состава крови отмечен повышенный уровень нейтрофилов как в процентном отношении, так и в абсолютных значениях у больных НАБА (67% и 5,30х109/л соответственно) и у больных ХОБЛ (72% и 7,30×109/л соответственно) по сравнению с контрольной группой (54% и 3,92×109/л соответственно) (р<0,05). Число эозинофилов как в процентном отношении, так и в абсолютных значениях было повышено у больных НАБА (1,5% и 0,16×109/л соответственно) по сравнению с больными ХОБЛ (1% и 0,05×109/л соответственно) и контрольной группой (0,5% и 0,01×109/л соответственно) (р<0,05). Высокий уровень эозинофилов в крови (более 3%) наблюдался только у 10 (20,4%) больных НАБА. Статистически значимых различий по уровню эозинофилов как в процентном отношении, так и в абсолютных значениях у больных ХОБЛ по сравнению с группой контроля выявлено не было (р>0,05). У 8 (16%) больных ХОБЛ выявлен повышенный уровень эозинофилов в крови (более 3%).
Таким образом, у больных НАБА и ХОБЛ преобладали нейтрофилы в ИМ и крови. Выявлено, что у больных НАБА и ХОБЛ высокий уровень эозинофилов в ИМ не всегда совпадал с повышенным уровнем в крови, потому что число эозинофилов в крови служит лабильным параметром и зависит от многих факторов. В связи с этим были исследованы дополнительные специфичные маркеры, такие как ЕСР и НЭ, которые могут принимать участие в воспалении дыхательных путей при НАБА и ХОБЛ. Данные маркеры отражают не только число эозинофилов и нейтрофилов, но и их функциональную активность.
При исследовании ЕСР выявлено повышение данного параметра у 14 (28,57%) больных НАБА и у 6 (12%) больных ХОБЛ. Уровень ЕСР у больных НАБА составил 13,75 нг/мл, что статистически выше по сравнению с ХОБЛ (10,41 нг/мл) и контрольной группой (9,25 нг/мл) (р<0,05).
Повышенный уровень НЭ был у 34 (69,38%) больных НАБА и у 41 (82%) больного ХОБЛ. Значения НЭ у больных НАБА составили 150 нг/мл, у больных ХОБЛ – 175 нг/мл, что достоверно выше по сравнению со здоровыми лицами – 80 нг/мл (р<0,05). При сравнении групп больных НАБА и ХОБЛ НЭ достоверно выше у больных ХОБЛ по сравнению с больными НАБА (р<0,05).
Обсуждение
ЕСР, являющийся продуктом эозинофилов, рассматривается как значимый при эозинофильном типе воспаления дыхательных путей. ЕСР был понижен в обеих группах больных. Высокий уровень НЭ определялся у больных как НАБА, так и ХОБЛ, что подтверждает ее роль при нейтрофильном типе воспаления.
Однако тип воспаления дыхательных путей имеет общие физиологические закономерности и не имеет специфических признаков по нозологии. Тип воспаления дыхательных путей может отличаться интенсивностью процесса, а качественная характеристика типа воспаления схожа у больных как БА, так и ХОБЛ. В связи с этим был проведен корреляционный и многофакторный анализ взаимосвязи изучаемых параметров.
По результатам многофакторного анализа наиболее значимыми показателями были число нейтрофилов в абсолютных цифрах, содержание эозинофилов ИМ в процентном отношении, уровень ЕСР и НЭ в крови.
На основании этих значимых маркеров воспаления дыхательных путей больных НАБА и ХОБЛ была разработана модель [31], дающая возможность дифференцировать воспаление дыхательных путей на нейтрофильный и эозинофильный типы. Построение модели осуществлялось методом пошагового регрессионного анализа. Теоретически влияние на построенную модель могут оказывать основные факторы и второстепенные (изменяющие ее ценность). В связи с этим пошагово был проведен регрессионный анализ и установлено, что вклад основных факторов, включенных в модель, составляет 66,6% от общей суммы квадратичных отклонений параметра Y (тип воспаления), а 33,4% вносят неучтенные (случайные) факторы, это свидетельствует об информационной способности модели. С уровнем значимости p<0,0000 модель можно считать значимой и достоверной.
Обозначили тип воспаления дыхательных путей – у, х1 – содержание эозинофилов в ИМ (%), х2 – число нейтрофилов в крови (109/л), х3 – количество ЕСР в крови (нг/мл), х4 – количество НЭ в крови (нг/мл), тогда модель для дифференциальной диагностики типов воспаления дыхательных путей при НАБА и ХОБЛ можно представить как:
у=0,0206×х1-0,0583×х2+0,0205×х3-0,0011×х4+0,582.
Знаки коэффициентов модели отражают прямую (коэффициенты со знаком +) и обратную (коэффициенты со знаком -) связь типа воспаления дыхательных путей с независимыми факторами. Исходно задано значение 0 – нейтрофильный тип воспаления, 1 – эозинофильный тип воспаления.
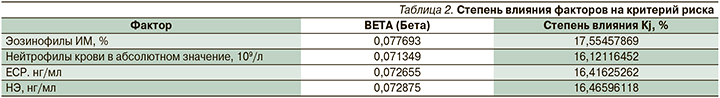
Степень влияния независимых факторов на критерий принадлежности пациентов к нейтрофильному или эозинофильному типу воспаления дыхательных путей рассчитывался, исходя из величины стандартизированных коэффициентов регрессии BETA (Бeтa) (табл. 2) с помощью формулы:
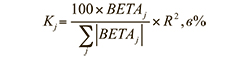
Таким образом, наибольшее влияние на критерий принадлежности к нейтрофильному или эозинофильному типу воспаления дыхательных путей оказывает фактор эозинофилов ИМ (17,6%), чуть меньше – НЭ (16,5%), ЕСР (16,4%) и нейтрофилы крови в абсолютном содержании (16,1%).
Полученная модель дифференциации типа воспаления дыхательных путей у больных НАБА и ХОБЛ позволяет путем подстановки в формулу значений показателей эозинофилов ИМ (%), нейтрофилов крови в абсолютном содержании (109/л), ЕСР и НЭ получить критерий принадлежности к нейтрофильному или эозинофильному типу воспаления.
При значении у=0–0,4 – это нейтрофильный тип воспаления дыхательных путей у больных НАБА и ХОБЛ; y=0,6 и выше – это эозинофильный тип воспаления дыхательных путей у больных НАБА и ХОБЛ.
При промежуточном значении от 0,41 до 0,59 необходимо использовать пороговые значения параметров ЕСР, НЭ, эозинофилов в ИМ и абсолютное значение числа нейтрофилов в крови, полученные при расчете ROC-анализа. В результате проведенного ROC-анализа были определены пороговые значения: ECP – 19,92 нг/мл и выше (чувствительность – 90% и специфичность – 89,7%) и эозинофилов в ИМ – 3,5% и выше (чувствительность – 82,9%, специфичность – 82,9%), НЭ – 135 нг/мл и выше (чувствительность – 85,3% и специфичность – 77,1%), и абсолютного значения числа нейтрофилов в крови – 5,38×109/л и выше (чувствительность – 72,2%, специфичность – 73,9%).
На основании вышесказанного больные НАБА и ХОБЛ со значением параметра ECP 19,92 нг/мл и выше и значением эозинофилов ИМ 3,50% и выше имеют эозинофильный тип воспаления дыхательных путей; пациенты НАБА и ХОБЛ, имеющие абсолютное значение нейтрофилов в крови 5,38×109/л и выше, а также уровень НЭ 135 нг/мл и выше, – нейтрофильный тип воспаления дыхательных путей.
Ранее нами была разработана модель диагностики типов воспаления только для больных ХОБЛ [32], в данной работе модель дополнили для больных НАБА.
Заключение
Проведенное исследование позволило выделить значимые маркеры типов воспаления дыхательных путей. Предложенная модель повышает точность диагностики типов воспаления дыхательных путей у больных НАБА и ХОБЛ, что позволяет оптимально подходить к терапии заболеваний и повышать ее эффективность. Модель диагностики типов воспаления дыхательных путей у больных НАБА и ХОБЛ имеет высокую информационную значимость (коэффициент детерминации – R2=0,64864689) и статистическую ценность (F 4,79=39,307; p<0,0000).


