В статье обсуждается место азитромицина в лечении инфекций дыхательных путей (ИДП) у детей на основании данных об этиологии и антибиотикорезистентности возбудителей ИДП в РФ, фармакологических свойств данного макролида, а также современных тенденций антибиотикотерапии при ИДП в педиатрической практике. Подчеркивается, что азитромицин, обладающий высокой активностью в отношении как типичных, так и атипичных бактериальных возбудителей ИДП у детей, уникальными фармакокинетическими характеристиками, позволяющими использовать короткие курсы лечения данным макролидом, является одним из эффективных и наиболее удобных антибактериальных препаратов применения в амбулаторной педиатрической практике.
Внебольничные инфекции дыхательных путей (ИДП) у детей являются самым частым поводом к обращению за медицинской помощью к врачам-педиатрам и основной причиной пропуска посещения
детских дошкольных учреждений и школьных занятий, а также наиболее частым показанием к назначению антибактериальной терапии (АБТ) в амбулаторной практике [1]. По данным статистики, в среднем на каждого ребенка приходится шесть эпизодов ИДП в год; при этом считается нормальным, если дети второго-третьего года жизни переносят не более пяти, дети четвертого года жизни – не более четырех и дети старше 5 лет – не более трех эпизодов ОРЗ за год. В случае более частых ИДП
детей относят к группе частоболеющих детей (ЧБД) [2].
Ежегодно в РФ среди детей и подростков до 17 лет регистрируется более 20 тыс. случаев внебольничной пневмонии (ВП) [3]; кроме того, в 2010 г. в этой возрастной группе официально было зарегистрировано более 20 млн случаев острых инфекций верхних ДП, что определяет не только медицинскую, но и социально-экономическую значимость данной проблемы [4].
В связи с этим все большее внимание врачей привлекает возможность быстрого излечения пациентов
с ИДП с использованием антибактериальных препаратов (АБП), которые можно применять короткими курсами. Среди АБП, позволяющих проводить терапию короткими курсами, следует отметить прежде всего азитромицин, обладающий уникальными фармакокинетическими особенностями. Однако авторы некоторых публикаций, опираясь на спорные зарубежные данные, заявляют, что азитромицин утратил активность в отношении типичных возбудителей ИДП, в частности β-гемолитического стрептококка серогруппы А (БГСА, Streptococcus pyogenes) и пневмококка (Streptococcus pneumoniae), вследствие приобретенной резистентности и не может рассматриваться в качестве эффективного АБП лечения ИДП у детей.
В настоящей публикации мы рассмотрим имеющиеся данные по антибиотикорезистентности (АБР) основных типичных бактериальных возбудителей ИДП в России и с учетом этого обсудим место азитромицина при различных нозологических формах ИДП у детей.
Общие принципы диагностики и рациональной терапии ИДП у детей
Как известно, ИДП принято подразделять на инфекции верхних (средний отит, ринит, назофарингит, риносинусит, тонзиллофарингит – ТФ, эпиглоттит, ларингит и ларинготрахеит) и нижних (бронхит, бронхиолит и ВП) ДП [5]. Абсолютное большинство внебольничных ИДП имеют вирусную природу и характеризуются высокой вероятностью спонтанного самоизлечения, поэтому назначение АБП в таких случаях является неоправданным. В то же время некоторые состояния, в частности эпиглоттит и тяжелая ВП, требуют незамедлительного назначения адекватной АБТ, необходимой для предотвращения неблагоприятного исхода. Таким образом, перед врачом-педиатром стоит сложнейшая задача дифференциации ИДП предположительно вирусной или предположительно бактериальной природы и назначения АБТ только в тех случаях, когда высоковероятна бактериальная этиология инфекции [6].
Согласно современным представлениям, при тяжелом состоянии ребенка показано проведение диагностическихтестов, позволяющих дифференцировать вирусные и бактериальные инфекции. Наиболее надежным маркером бактериального воспаления является уровень прокальцитонина
(ПКТ) [7]. Существенным подспорьем для врача также являются иммунохроматографические экспресс-тесты для выявления антигенов определенных возбудителей – БГСА (Стрептатест), пневмококка, легионелл, аденовирусов, вирусов гриппа А и В, респираторно-синцитиального вируса
и т. д. Применение этих тестов позволяет в течение нескольких минут подтвердить или исключить определенную этиологию инфекции и принять обоснованное решение о необходимости назначения АБП или специфических противовирусных препаратов.
При нетяжелых ИДП оправданной считается “выжидательная” тактика, точнее – практика отсроченного назначения АБП [8]. В этом случае врач оценивает и учитывает возраст ребенка, тяжесть состояния, медицинский и социальный фон, при условии обязательного повторного осмотра
и возможности обращения за неотложной помощью в случае ухудшения состояния может принять решение не назначать АБТ при первичном обращении пациента, а ограничиться проведением диагностических исследований и симптоматической терапии. АБП назначаются в отсутствие улучшения
состояния ребенка в течение 48–72 часов. Использование подобной тактики рекомендуется для детей старше 2 лет с острым средним отитом (ОСО), при легком течении риносинусита и даже при нетяжелой ВП [8–11].
Этиология и резистентность к АбП основных бактериальных
возбудителей ИДП в РФ
Как уже отмечалось выше, большинство ИДП у детей имеют вирусную природу. В отличие от взрослых пациентов у них значительно чаще встречается вирусная этиология ВП. Так, по данным различных исследований, у детей вирусную ВП диагностировали в 20–45 % случаев, пневмококковую – в 7–68 %, микоплазменную – в 2–40 %, хламидийную – в 1–14 % случаев; в 15–45 % случаев ВП этиологию установить не удалось и в 1–41 % случаев отмечается смешанная (обычно вирусно-бактериальная) инфекция [12]. Более того, этиология ВП у детей в значительной степени зависит от возраста [13]. Так, у детей в возрасте от 3 месяцев до 5 лет в этиологии ВП преобладают вирусы, реже выявляются
пневмококк и гемофильная палочка (Haemophilus influenzae); у детей старше 5 лет, особенно у школьников, распространены инфекции, вызванные Mycoplasma pneumoniae; Chlamydophila pneumoniae и S. pneumoniae встречаются реже [13–15].
При выборе АБП лечения ИДП следует иметь представление о спектре возможных типичных и атипичных бактериальных возбудителей при определенной нозологии. Среди типичных возбудителей ИДП у детей существенное значение имеют S. pyogenes (не только при ТФ, но и при ОСО), S. pneumoniae и H. influenzae (ОСО, острый синусит, ВП). По данным российских исследований, Moraxella
catarrhalis не является распространенным возбудителем ИДП в нашей стране [16, 17]. Атипичные возбудители – M. pneumoniae и C. pneumoniae, как уже отмечалось выше, играют важную роль в этиологии ВП у детей старше 5 лет, кроме того, в настоящее время активно изучается их значение при ТФ, рецидивирующих ИДП и длительном кашле у детей [18, 21–24].
Для лечения ИДП бактериальной природы в педиатрической практике применяются два основных
класса антибиотиков – β-лактамы и макролиды. Соответственно, наибольший практический интерес представляют данные об активности различных представителей именно этих классов АБП в отношении ведущих возбудителей ИДП у детей. У штаммов C. pneumoniae и M. pneumoniae в настоящее время отсутствует клинически значимая АБР к макролидам [25], однако все β-лактамы в отношении этих атипичных возбудителей не активны. У типичных бактериальных возбудителей ИДП возможно развитие резистентности как к β-лактамам, так и к макролидам. Поэтому возможность эффективного применения различных препаратов этих классов для лечения ИДП во многом определяется частотой
выделения возбудителей, имеющих различные механизмы приобретенной АБР в конкретном регионе.
Основным источником информации о чувствительности респираторных патогенов (S. pyogenes, S. pneumoniae и H. influenzae) к антибиотикам в РФ являются результаты многоцентрового проекта ПеГАС, проведенного в различных городах нашей страны с 1999 по 2009 г. Они свидетельствуют о том, что ситуация с АБР возбудителей внебольничных ИДП в России вполне благополучная [26, 27]. Не вызывает сомнений, что наибольшую активность in vitro в отношении штаммов БГСА проявляют β-лактамные антибиотики, к которым случаев развития приобретенной резистентности у S. pyogenes
не отмечено [27]. Однако частота приобретенной АБР к макролидам у штаммов пиогенного стрептококка также не превышает 10 %, что позволяет рассматривать антибиотики этого класса в качестве приемлемой альтернативы пенициллинам при лечении стрептококкового ТФ.
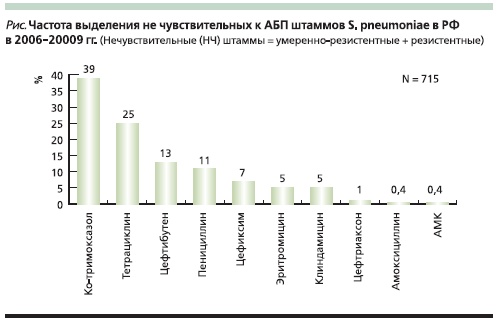
Среди штаммов пневмококка, выделенных на территории РФ в 2006–2009 гг., изоляты с промежуточным уровнем резистентности к пенициллину составили 9,1 %, а с высоким уровнем (МПК пенициллина ≥ 2 мг/л) – 2,1 % [26]. В то же время в некоторых регионах РФ (в частности, в Дальневосточном ФО) частота выделения пенициллинорезистентных пневмококков (ПРП) существенно выше и составляет 17,6 и 7,4 % штаммов с промежуточным и высоким уровнем резистентности соответственно [28]. При анализе данных о распространенности ПРП среди детей различного возраста оказалось, что частота выделения штаммов S. pneumoniae, не чувствительных к пенициллину, достигает 27,2 % у детей 1–3 и 17,7 % у детей 3–7 лет. Наиболее высокой активностью в отношении штаммов пневмококков со сниженной чувствительностью к пенициллину среди β-лактамных антибиотиков обладает амоксициллин, к которому не чувствительны всего 0,4 % изолятов S. pneumoniae (см. рисунок) [28]. Поскольку резистентность к пенициллину у пневмококков не связана
с продукцией β-лактамаз, показатели чувствительности к амоксициллину и амоксициллину/клавуланату (АМК) одинаковы.
Класс-препаратом определения чувствительности пневмококков к 14-членным макролидам и азитромицину является эритромицин, а показатели чувствительности штаммов к клиндамицину позволяют судить об активности 16-членных макролидов и линкозамидов в отношении S. pneumoniae [29]. По данным исследования ПеГАС-III в среднем по России частота выделения штаммов S. pneumoniae, не чувствительных к эритромицину и клиндамицину, составляет всего 4,6 и 4,5 % соответственно [28]. Таким образом, более 95 % штаммов пневмококков, выделенных на территории РФ, чувствительны ко всем макролидным АБП. Примечательно также, что ситуация с резистентностью
S. pneumoniae к макролидам является благополучной во всех регионах РФ и не зависит от распространенности ПРП (от 9,1 до 25 % не чувствительных к пенициллину изолятов) [28]. Среди детей всех возрастных групп показатели устойчивости штаммов S. pneumoniae к макролидам в 2–3 раза ниже, чем к пенициллину, и даже в наиболее проблемных возрастных группах (1–3 года и 3–7 лет) не превышают 10 % (9,9 и 7,8 % соответственно). Подобная ситуация уникальна, поскольку в большинстве стран Европы частота резистентности S. pneumoniae к макролидам выше или соответствует распространенности ПРП [30]. Кроме того, во многих странах мира, в т. ч. пограничных с РФ, показатели резистентности к макролидам у S. pneumoniae и S. pyogenes существенно выше, чем в нашей стране [6, 30]. Следовательно, при разработке рекомендаций по лечению инфекций, вызванных перечисленными микроорганизмами, следует обязательно учитывать российские особенности АБР возбудителей ИДП.
Изоляты гемофильной палочки, выделенные в РФ, сохраняют высокую чувствительность к аминопенициллинам: 95 % штаммов чувствительны, а АБР у оставшихся 5 % штаммов H. influenzae связана с продукцией β-лактамаз и преодолевается путем назначения ингибиторозащищенных препаратов. Активность различных макролидов в отношении H. influenzae неодинакова. Известно, что благодаря уникальному химическому строению молекулы наиболее высокой активностью в отношении H. influenzae обладает азитромицин [6]. По данным проекта ПеГАС, в РФ в 2004–2005 гг. чувствительность к азитромицину составила 98 % [27]. Кроме того, в исследовании in vitro продемонстрирована способность азитромицина препятствовать образованию биопленок штаммами
гемофильной палочки, а также вызывать уменьшение массы и толщины уже сформированной биопленки [31]. Поскольку образование биопленок считается одним из ведущих механизмов, обеспечивающих персистенцию и хронизацию бактериальной инфекции, эти данные могут служить дополнительным основанием к назначению азитромицина при ИДП гемофильной этиологии.
На основании вышеизложенного становится очевидным, почему в качестве препаратов выбора лечения ИДП, вызванных типичными бактериальными возбудителями, в большинстве рекомендаций указаны АБП пенициллинового ряда (амоксициллин или феноксиметилпенициллин при стрептококковом ТФ). С другой стороны, с учетом приведенных выше российских данных по АБР возбудителей макролиды, в частности азитромицин, в РФ могут рассматриваться не только как средство, направленное против атипичных возбудителей, но и как эффективные препараты лечения
ИДП, вызванных типичными бактериальными патогенами – S. pyogenes, S. pneumoniae и H. influenzae.
Острый стрептококковый тонзиллофарингит
БГСА – единственный распространенный возбудитель ТФ, при выделении которого показана АБТ, причем целью ее является не только устранение симптомов ТФ, но и прежде всего эрадикация БГСА из ротоглотки и профилактика возникновения поздних иммуноопосредованных осложнений (острой ревматической лихорадки и острого гломерулонефрита) [6]. С учетом универсальной чувствительности БГСА к β-лактамам АБП выбора в терапии БГСА-ТФ являются пенициллины, при наличии в анамнезе аллергических реакций на β-лактамы –макролиды и линкозамиды [13, 32] (см. таблицу).
Таблица.
Рекомендуемые АБП и режимы лечения острого стрептококкового фарингита,вызванного БГСА, у детей и взрослых [32].
В последние годы появился ряд сообщений о случаях неэффективности пенициллина для эрадикации S. pyogenes со слизистой оболочки миндалин и задней стенки глотки, частота которых может достигать 30–40 % [33, 34]. Объединенные данные двух рандомизированных многоцентровых исследований [33] показали, что, несмотря на 100 %-ную чувствительность пиогенного стрептококка к пенициллину, микробиологическая неэффективность (отсутствие эрадикации БГСА из носоглотки на 10–14-й или 29–31-йдень) отмечена среди 35 % пациентов, получавших феноксиметипенициллин,
и у 37 % больных, получавших бензилпенициллин [33].
Среди основных причин неудачной эрадикации БГСА отмечают низкую комплаентность 10-дневных курсов пенициллина, повторное заражение стрептококками от инфицированных членов семьи, разрушение пенициллина ко-патогенами полости рта, недо-статочное проникновение антибиотика
в ткань миндалин и внутрь эпителиальных клеток [34]. В ходе исследования, выполненного на культуре эпителиальных клеток слизистой оболочки глотки человека (HEp-2), показано, что БГСА, локализованные внутри клеток, сохраняли жизнеспособность, несмотря на воздействие пенициллина [35]. В то же время антибиотики группы макролидов (азитромицин и эритромицин) обладали бактерицидным эффектом в отношении данных микроорганизмов.
Более того, для достижения адекватной эрадикации БГСА из ткани миндалин все АБП, кроме бензатина бензилпенициллина и азитромицина, должны применяться в течение 10 дней [13, 32]. С учетом быстрого улучшения состояния пациента с БГСА-ТФ на фоне проводимой АБТ сложно убедить
пациента и его родителей в необходимости завершения 10-дневного курса терапии. В данном случае приемлемым альтернативным вариантом лечения может быть назначение 5-дневного курса азитромицина.
Результаты Кокрановского метаанализа, опубликованные в 2009 г. [36], продемонстрировали сопоставимую эффективность коротких 3–6-дневных курсов АБТ азитромицином и стандартных 10-дневных курсов лечения феноксиметилпенициллином детей с острым тонзиллофарингитом, вызванным S. pyogenes. В ходе мета-анализа было проанализировано 20 рандомизированных контролируемых исследований (РКИ), включивших 13 102 случая острого БГСА-ТФ среди детей в возрасте от 1 до 18 лет. При терапии короткими курсами отмечены более быстрые нормализация температуры тела и исчезновение боли в горле, а также меньший риск ранней клинической неэффективности терапии. Риск позднего бактериологического рецидива оказался несколько выше при использовании коротких курсов лечения (отношение шансов [ОШ] – 1,31), однако после исключения из анализа РКИ, в которых азитромицин применялся в низкой суточной дозе (10 мг/кг), статистически значимых различий выявлено не было (ОШ – 1,06).
Безусловно важным с практической точки зрения является вопрос об оптимальном режиме дозирования
азитромицина при лечении БГСА-ТФ у детей, решению которого был посвящен мета-анализ, выполненный Casey и Pichichero [37]. Было проанализировано 14 РКИ у детей (n = 3297), в которых азитромицин применялся в курсовых дозах 30 мг/кг (10 мг/кг/сут в течение 3 дней или 10 мг/кг/сут в
1-й день и по 5 мг/кг/сут во 2–5-й дни лечения) или 60 мг/кг (20 мг/кг/сут в течение 3 дней или по 12 мг/кг/сут в течение 5 дней), а в группах сравнения пациенты получали стандартные 10-дневные курсы других АБП (пенициллин, эритромицин, цефаклор, кларитромицин и АМК). В курсовой дозе 60 мг/кг азитромицин достоверно превосходил по эффективности 10-дневный курс препарата сравнения (ОШ = 5,27; р < 0,00001). В то же время низкие дозы азитромицина для детей (30 мг/кг за 3 или 5 дней) достоверно уступали 10-дневному курсу препарата сравнения (ОШ = 0,47; р < 0,02). В дозе 20 мг/кг/сут в течение 3 дней азитромицин по бактериологической эффективности не отличался от 10-дневного курса препарата сравнения (ОШ = 0,62; р = 0,19), однако 5-дневный курс азитромицина в дозе 12 мг/кг/сут превосходил 10-дневный курс лечения препаратами сравнения (ОШ = 4,37; р = 0,02).
Таким образом, назначение азитромицина в дозе 12 мг/кг/сут в течение 5 дней является наиболее оптимальной схемой терапии БГСА-ТЗ у детей.
Острый средний отит
С учетом данных о ведущей роли S. pneumoniae, H. influenzae и S. pyogenes в этиологии ОСО у детей [16] очевидно, что АБП, назначаемые для лечения данной нозологии, должны обладать высокой активностью в отношении этих возбудителей. На основании данных по АБР перечисленных микроорганизмов в РФ для лечения ОСО у детей можно предложить два класса АБП: β-лактамы (амоксициллин, АМК и цефалоспорины II–III поколений) и современные макролиды (азитромицин и кларитромицин). Препаратом выбора лечения ОСО является амоксициллин или АМК. Эффективно также назначение перорального цефалоспорина II поколения цефуроксима аксетила. При аллергии на β-лактамы альтернативными АБП являются макролиды – азитромицин и кларитромицин, обладающие активностью в отношении H. influenzae; при наличии рвоты или сомнений в комплаентности пациента – цефтриаксон внутримышечно (в/м) в течение 1–3 дней [9].
В последние годы педиатры и родители при лечении ОСО оказывают все большее предпочтение коротким курсам АБТ. В 2010 г. опубликованы результаты 2 мета-анализов, посвященных оценке эффективности и безопасности коротких курсов терапии ОСО различными АБП [38, 39].
В первом мета-анализе, включившем 35 РКИ, определяли эффективность и безопасность коротких курсов АБП (< 4 дней) в сравнении с их более длительным применением (> 4 дней) [38]. Несомненным преимуществом коротких курсов АБТ следует считать достоверное уменьшение риска развития
нежелательных лекарственных реакций в сравнении с более длительной терапией (отношение рисков [ОР] =0,58; р < 0,001). При сопоставлении эффективности коротких курсов азитромицина и стандартных курсов лечения препаратами сравнения (по результатам 23 РКИ) повышения риска неэффективности при применении азитромицина выявлено не было (ОР = 0,93; р = 0,35). При терапии цефтриаксоном в/м (по данным 12 РКИ) отмечено незначительное повышение риска неэффективности лечения (ОР = 1,13; р = 0,071), а назначение коротких курсов терапии пероральными АБП с коротким периодом полувыведения (амоксициллин и другие β-лактамы) при ОСО сопровождалось статистически достоверным повышением риска неэффективности терапии более чем в 2 раза (ОР = 2,27; р = 0,04).
Во втором мета-анализе, выполненном в рамках Кокрановского сотрудничества, сравнивали эффективность коротких курсов АБП (менее 7 дней) с более длительными курсами лечения (7 дней и более) [39]. В мета-анализ было включено 49 исследований (22 исследования азитромицина и 9 исследований цефтриаксона), в которых было проанализировано 12 045 случаев ОСО у детей в возрасте от 1 месяца до 18 лет; статистически достоверных различий в эффективности коротких
курсов цефтриаксона или азитромицина и обычных (7 дней или более) курсов АБП выявлено не было. Кроме того, применение короткого курса азитромицина сопровождалось меньшим числом нежелательных явлений со стороны желудочно-кишечного тракта. Таким образом, терапия коротким
курсом азитромицина является эффективным и безопасным режимом лечения ОСО в амбулаторной педиатрической практике.
Острый риносинусит (ОРС)
На долю ОРС приходится от 9 до 20 % всех ЛОР-заболеваний детского возраста [40]. Следует помнить, что ОРС может приводить к развитию серьезных осложнений, особенно в группе часто и длительно болеющих детей [40]. Риносинуситы являются пятой по частоте причиной назначения детям антибиотиков (от 9 до 21 %), причем АБТ нередко назначается при вирусной этиологии ОРС, что является необоснованным. Как и при других ИДП, основную сложность представляет дифференциальная диагностика между ОРС бактериальной природы и ОРВИ. Среди взрослых пациентов было проведено достаточно большое число исследований, посвященных проблемам диагностики и лечения ОРС, на основании которых разработаны руководства по ведению больных.
В педиатрической практике подобные исследования являются единичными и практически не проводились в РФ.
На сегодняшний день имеется несколько зарубежных практических рекомендаций по ведению детей с ОРС [41], но подобных российских руководств нет. Экстраполяция рекомендаций по ведению взрослых пациентов на педиатрическую практику невозможно, а использование в России зарубежных рекомендаций имеет ряд ограничений, связанных с особенностями этиологии и АБР бактериальных возбудителей ОРС в нашей стране.
По данным зарубежных авторов, наиболее частыми бактериальными возбудителями ОРС у детей являются S. pneumoniae (30–66 %), H. influenzae (20–30 %) и M. сatarrhalis (12–28 %). Реже в качестве этиологических агентов выступают S. pyogenes, Streptococcus spp., S. aureus и др. [41].
При бактериальной этиологии ОРС показана АБТ, целями которой являются клиническое выздоровление пациента, эрадикация возбудителя инфекции и восстановление стерильности придаточных пазух носа. АБТ уменьшает тяжесть и длительность клинических симптомов заболевания, предупреждает развитие гнойных осложнений, позволяет сократить сроки лечения, предотвратить рецидивирование и переход процесса в хроническую форму. Чрезвычайно важным является адекватный выбор АБП и соблюдение рационального режима их применения. При нетяжелом течении ОРС пункцию придаточных пазух обычно не выполняют, а выбор антибиотика проводят эмпирически на основании данных о структуре возбудителей и особенностей их АБР в конкретном регионе [13, 41].
Поскольку в РФ не распространены штаммы S. pneumoniae, устойчивые к пенициллину и макролидам, и
β-лактамазопродуцирующие штаммы H. influenzae, а M. сatarrhalis крайне редко выделяются при ИДП у российских пациентов, в качестве препарата выбора при нетяжелом ОРС для детей допустимо и целесообразно использовать амоксициллин в обычных терапевтических дозах (45 мг/кг/сут в 2 приема). В качестве альтернативы могут использоваться АМК или цефуроксима аксетил [13]. При аллергии на β-лактамы назначают макролиды с выраженной активностью в отношении H. influenzae, в частности 3-дневный курс азитромицина в дозе 10 мг/кг/сут или кларитромицин в течение 7–14 дней в дозе 15 мг/кг/сут в 2 приема. В случаях тяжелого или осложненного ОРС у детей рекомендовано парентеральное назначение цефалоспоринов III поколения, например цефтриаксона [41].
В клинических исследованиях детей с острыми и подострыми риносинуситами была продемонстрирована эквивалентная клиническая эффективность короткого курса азитромицина (10 мг/кг/сут в течение 3 дней) и стандартной терапии АМК (в дозе 45 мг/кг/сут по амоксициллину в течение 10–14 дней) [42, 43].
Сегодня азитромицин занимает ведущие позиции среди альтернативных АБП лечения ОРС у детей и
назначается почти каждому 5-му пациенту [44].
Рецидивирующие ИДП у детей
Проблема ИДП особенно актуальна в группе ЧБД, к которой, по данным различных авторов, относят около четверти всей детской популяции. В исследовании, выполненном Esposito и соавт. [45], была изучена роль M. pneumoniae и C. pneumoniae в развитии ОРЗ у детей с рецидивирующими ИДП, а также способность специфической АБТ уменьшать частоту возникновения рецидивов. В исследовании приняли участие 353 ЧБД в возрасте от 1 до 14 лет; контрольную группу составили 208 здоровых детей. ЧБД были рандомизированы в группы лечения с использованием только симптоматической терапии и симптоматической терапии с азитромицином (10 мг/кг/сут 3 дня в неделю на протяжении 3 недель).
Инфекции, вызванные атипичными возбудителями, были диагностированы у 54 % ЧБД (и только у 3,8 %
детей контрольной группы; р < 0,0001). Краткосрочный (на протяжении месяца) клинический эффект более часто отмечался среди ЧБД, получавших азитромицин, однако различия были статистически значимыми только в группе пациентов с инфекцией, вызванной атипичными возбудителями. Долговременный клинический эффект (на протяжении 6 месяцев) отмечался достоверно чаще у ЧБД при терапии азитромицином независимо от этиологии рецидивирующих ИДП. Авторы полагают, что атипичные бактерии, возможно, играют определенную роль в возникновении рецидивирующих ИДП у детей и длительная терапия азитромицином может значительно улучшить течение острого эпизода, уменьшить риск возникновения рецидивов [45].
В другом исследовании, включившем 1706 ЧБД в возрасте от 6 месяцев до 14 лет (частота ОРЗ ≥ 8 эпизодов в год у детей до 3 лет и ≥ 6 – у детей старше 3 лет), показано, что независимо от возраста и клинического диагноза назначение макролидов пациентам с рецидивирующими ИДП обеспечивало достоверно более высокую эффективность терапии по сравнению с β-лактамами (p < 0,0001) или только симптоматической терапией (p < 0,0001) [22].
Длительный кашель
Длительный кашель также является одной из частых причин обращений к врачам-педиатрам. Одной из
наиболее частых причин длительного кашля является коклюш, заболеваемость которым остается на высоком уровне, несмотря на наличие эффективной и безопасной вакцины [4]. Серологически подтвержденная инфекция B. pertussis выявляется в 37 % случаев кашля, продолжающегося более 2 недель после перенесенного ОРЗ. Еще у 12,9 % детей с длительным кашлем была выявлена инфекция M. pneumoniae [23]. Таким образом, примерно в половине случаев длительного кашля, обусловленного инфекционными причинами, имеются показания к назначению АБП группы макролидов.
Согласно результатам Кокрановского систематического обзора по применению АБП для лечения и профилактики коклюша, включившего 12 РКИ (общее число участников – 1720), 3-дневный курс терапии азитромицином по эффективности не уступал 2-недельному курсу лечения эритромицином
[46]. В настоящее время азитромицин включен в рекомендации Центров по контролю и профилактике заболеваний США (CDC) по лечению коклюша. Его необходимо назначать детям до 6 месяцев в дозе 10 мг/кг один раз в сутки в течение 5 дней; детям старше 6 месяцев – 10 мг/кг в первый день (но не более 500 мг), далее по 5 мг/кг (2–5-й дни терапии) [47].
Внебольничная пневмония
К сожалению, следует признать, что вопросы диагностики и рациональной терапии ВП у детей разработаны в значительно меньшей степени, чем у взрослых пациентов. Первые руководства по лечению ВП у детей, подготовленные национальными и международными научными обществами, появились относительно недавно [3, 14, 15]. Основные сложности, с которыми сталкивается врач при подозрении на ВП у ребенка, это подтверждение диагноза ВП и определение предположительной этиологии инфекции (вирусная или бактериальная).
Поскольку у детей до 5 лет основными этиологическими агентами ВП являются вирусы, зарубежные руководства рекомендуют воздерживаться от назначения АБП при нетяжелой ВП у пациентов этой возрастной группы [14, 15]. Российская программа по ВП предлагает в качестве препаратов выбора детям в возрасте от 3 месяцев до 5 лет пероральное назначение амоксициллина, АМК или макролида,
а детям старше 5 лет – амоксициллина или макролида [3]. Предложенный подход следует считать абсолютно обоснованным с учетом российских данных по АБР возбудителей.
Азитромицин, назначаемый в дозе 10 мг/кг 1 раз в сутки в течение 3 дней, продемонстрировал высокую клиническую эффективность при лечении детей с ВП, вызванной как атипичными, так и типичными возбудителями. В исследовании [48] детей с ВП, получавших 3-дневный курс азитромицина, отмечена более быстрая нормализация рентгенологической картины, чем при лечении амоксициллином в дозе 75 мг/кг/сут в течение 7 дней (при предположительно типичной бактериальной этиологии ВП) или эритромицином в дозе 50 мг/кг/сут в течение 14 дней (при предполагаемой атипичной ВП). Кроме того, в группе детей с атипичной ВП прекращение кашля при
терапии азитромицином отмечено значительно раньше, чем при лечении эритромицином (через 3,6 и 5,5 дней соответственно; р = 0,02). При выполнении Кокрановского систематического обзора [49] установлено, что при терапии азитромицином атипичных ИДП, вызванных M. pneumoniae или C. pneumoniae, клинического излечения удалось добиться в 100 % случаев, в то время как при терапии другими препаратами – только среди 77 % детей.
Заключение
Таким образом, азитромицин, обладающий высокой активностью в отношении как типичных, так и атипичных бактериальных возбудителей ИДП у детей, а также уникальными фармакокинетическими характеристиками, позволяющими использовать короткие курсы лечения, – один из эффективных и наиболее удобных АБП применения в амбулаторной педиатрической практике. Дополнительным его преимуществом является хорошая изученность эффективности, безопасности и переносимости как таблетированной лекарственной формы, так и суспензии азитромицина, рекомендованной для назначения детям с массой тела от 10 до 45 кг. На сегодняшний день только в США лечение азитромицином ежегодно получают более 50 млн пациентов, а общее число детей, принимавших азитромицин в виде суспензии, с момента регистрации данной лекарственной формы превысило
100 млн. Наличие специальной детской формы азитромицина позволяет достигать высокой точности дозирования АБП, необходимой для обеспечения максимальной эффективности лечения и минимизации риска нежелательных лекарственных реакций, составляющих первоочередные задачи
фармакотерапии в педиатрии.
1. Cherry DK, Hing E, Woodwell DA, Rechtsteiner EA. National Ambulatory Medical Care Survey: 2006 Summary. Hyattsville, MD: National Center for Health Statistics; 2008. National health statistics
reports.
2. Альбицкий В.Ю., Баранов А.А. В кн.: Часто болеющие дети. Клинико-социальные аспекты, пути оздоровления. Саратов, 1986.
3. Внебольничная пневмония у детей: распространенность, диагностика, лечение и профилактика. М., 2011. 64 с.
4. ФБУЗ “Федеральный центр гигиены и эпидемиологии”, http://www.fcgsen.ru/5/arhiv.htm
5. Meneghetti A. Upper respiratory tract infection. Medscape Reference, http://emedicine.medscape.com/article/302460-overview
6. Синопальников А.И., Козлов Р.С. Внебольничные инфекции дыхательных путей. Руководство для врачей. М., 2007. 352 с.
7. Таточенко В.К., Бакрадзе М.Д. Лихорадка без видимого очага инфекции // Практика педиатра 2008. № 10. С. 5–11.
8. Spurling GK, Del Mar CB, Dooley L, Foxlee R. Delayed antibiotics for respiratory infections. Cochrane Database Syst Rev 2007;3:CD004417.
9. Subcommittee on Management of Acute Otitis Media, American Academy of Pediatrics and American Academy of Family Physicians. Clinical practice guideline: diagnosis and management of acute otitis media. Pediatrics 2004; 113:1451–65.
10. Brook I. Current issues in the management of acute bacterial sinusitis in children. Int J Pediatr Otorhinolaryngol 2007;71(11): 1653–61.
11. Little P, Rumsby K, Kelly J, et al. Information leaflet and antibiotic prescribing strategies for acute lower respiratory tract infection: a randomized controlled trial. JAMA 2005;293: 3029–35.
12. Chetty K, Thomson AH. Management of community-acquired pneumonia in children. Paediatr Drugs 2007;9(6):401–11.
13. Применение антибиотиков у детей в амбулаторной практике. Методические рекомендации / Под ред. А.А. Баранова, Л.С. Страчунского // Клин. микробиол. антимикроб. химиотер. 2007. Т. 9. № 3.
С. 200–10.
14. Bradley JS, Byington CL, Shah SS, et al. The management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America. Clin Infect Dis 2011;53(7):25–76.
15. Harris M, Clark J, Coote N, et al. British Thoracic Society Standards of Care Committee. British Thoracic Society guidelines for the management of community acquired pneumonia in children: update 2011. Thorax 2011;66(2):1–23.
16. Катосова Л.К., Очкасов А.В., Богомильский М.Р. Этиология и рациональная терапия тяжелых форм острых средних гнойных отитов у детей // Антибиотики и химиотерапия 2006. № 2.C. 23–29.
17. Каманин Е.И., Егорова О.А. Острый средний отит у детей: клиническое значение и антибактериальная терапия // РМЖ 2000. Т. 2. №. 2. С. 57–63.
18. Esposito S, Blasi F, Bosis S, et al. Aetiology of acute pharyngitis: the role of atypical bacteria. J Med Microbiol 2004;53(Pt 7):645–51.
19. Esposito S, Marchisio P, Capaccio P, et al. Role of atypical bacteria in children undergoing tonsillectomy
because of severely recurrent acute tonsillopharyngitis. Eur J Clin Microbiol Infect Dis 2008;27(12):1233–37.
20. Esposito S, Bosis S, Begliatti E, et al. Acute tonsillopharyngitis associated with atypical bacterial
infection in children: natural history and impact of macrolide therapy. Clin Infect Dis 2006;43(2):206–09.
21. Esposito S, Marchisio P, Capaccio P, et al. Role of atypical bacteria in children undergoing tonsillectomy
because of severely recurrent acute tonsillopharyngitis. Eur J Clin Microbiol Infect Dis
2008;27(12):1233–37.
22. Principi N, Esposito S, Cavagna R, et al. Recurrent respiratory tract infections in pediatric age: a
population-based survey of the therapeutic role of macrolides. J Chemother 2003; 15(1):53–9.
23. Wang K, Chalker V, Bermingham A, et al. Mycoplasma pneumoniae and respiratory virus infections in children with persistent cough in England: a retrospective analysis. Pediatr Infect Dis J 2011;30(12):1047–51.
24. Thumerelle C, Deschildre A, Bouquillon C, et al. Role of viruses and atypical bacteria in exacerbations
of asthma in hospitalized children: a prospective study in the Nord-Pas de Calais region (France). Pediatr Pulmonol 2003;35(2):75–82.
25. Веселов А.В., Козлов Р.С. Азитромицин: современные аспекты клинического применения. Клин. микробиол. антимикроб. химиотер. 2006. № 8. С. 71–85.
26. Козлов Р.С., Сивая О.В., Кречикова О.И. и др. Динамика резистентности Streptococcus pneumoniae к антибиотикам в России за период 1999–2009 гг. Клин. микробиол. антимикроб. химиотер. 2010. Т. 4. № 12. С. 329–41.
27. Решедько Г.К., Козлов Р.С. Состояние резистентности к антиинфекционным препаратам в России. В кн.: Страчунский Л.С., Белоусов Ю.Б., Козлов С.Н. Практическое руководство по антиинфекционной
химиотерапии. Смоленск, 2007. С. 32–46.
28. Козлов Р.С. Пневмококки: уроки прошлого –взгляд в будущее. Смоленск, 2010. 128 с.
29. Методические указания МУК 4.2.1890-04 Определение чувствительности микроорганизмов к антибактериальным препаратам (утв. главным государственным санитарным врачом РФ 04.03.2004).
30. European Centre for Disease Prevention and Control. Antimicrobial resistance surveillance in Europe 2010. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). Stockholm 2011.
31. Starner TD, Shrout JD, Parsek MR, et al. Subinhibitory concentrations of azithromycin decrease nontypeable Haemophilus influenzae biofilm formation and diminish established biofilms. Antimicrob Agents Chemother 2008;52(1):137–45.
32. Chiappini E, Regoli M, Bonsignori F, et al. Analysis of different recommendations from international guidelines for the management of acute pharyngitis in adults and children. Clin Ther 2011;33(1):48–58.
33. Kaplan EL, Johnson DR. Unexplained reduced microbiological efficacy of intramuscular benzathine
penicillin G and of oral penicillin V in eradication of group a streptococci from children with acute pharyngitis. Pediatrics 2001; 8:1180–86.
34. Pichichero ME, Casey JR. Systematic review of factors contributing to penicillin treatment failure in Streptococcus pyogenes pharyngitis. Otolaryngol Head Neck Surg 2007;137(6): 851–57.
35. Kaplan EL, Chhatwal GS, Rohde M. Reduced ability of penicillin to eradicate ingested group A streptococci from epithelial cells: Clinical and pathogenetic implications. Clin Infect Dis 2006;43(11):1398–406.
36. Altamimi S, Khalil A, Khalaiwi KA, et al. Short versus standard duration antibiotic therapy for acute streptococcal pharyngitis in children. Cochrane Database Syst Rev 2009;1: CD004872.
37. Casey JR, Pichichero ME. Higher dosages of azithromycin are more effective in treatment of group A streptococcal tonsillopharyngitis. Clin Infect Dis 2005;40(12):1748–55.
38. Gulani A, Sachdev HP, Qazi SA. Efficacy of short course (< 4 days) of antibiotics for treatment of
acute otitis media in children: a systematic review of randomized controlled trials. Indian Pediatr
2010;47(1):74–87.
39. Kozyrskyj A, Klassen TP, Moffatt M, Harvey K. Short-course antibiotics for acute otitis media. Cochrane Database Syst Rev 2010;9:CD001095.
40. Гаращенко Т.И., Богомильский М.Р., Радциг Е.Ю., и др. Профилактика и лечение инфекций верхних дыхательных путей у детей // Лечащий врач 2001. № 10.
41. American Academy of Pediatrics. Subcommittee on Management of Sinusitis and Committee on Quality Improvement. Clinical practice guideline: management of sinusitis. Pediatrics 2001;108(3):798–808.
42. Alagie-Smailbegovie J, Saracevie E, Sutalo K. Azythromicin versus amoxicillin-clavulanate in the treatment of acute sinusitis in children. Bosn J Basic Med Sci 2006; 6(4):76–8.
43. Ng DK, Chow PY, Leung L, et al. A randomized controlled trial of azithromycin and amoxycillin/clavulanate in the management of subacute childhood rhinosinusitis. J Paediatr Child Health 2000;36(4):378–81.
44. Shapiro DJ, Gonzales R, Cabana MD, Hersh AL. National trends in visit rates and antibiotic prescribing for children with acute sinusitis. Pediatrics 2011;127;28.
45. Esposito S, Bosis S, Faelli N, et al. Role of atypical bacteria and azithromycin therapy for children with recurrent respiratory tract infections. Pediatr Infect Dis J 2005;24(5): 438–34.
46. Altunaiji S, Kukuruzovic R, Curtis N, Massie J. Antibiotics for whooping cough (pertussis). Cochrane Database Syst Rev2005;(1):CD004404.
47. Tiwari T, Murphy TV, Moran J; National Immunization Program, CDC. Recommended antimicrobial agents for the treatment and postexposure prophylaxis of pertussis: 2005 CDC Guidelines. MMWR Recomm Rep 2005;54(RR-14):1–16.
48. Kogan R, Martinez MA, Rubilar L, et al. Comparative randomized trial of azithromycin versus erythromycin and amoxicillin for treatment of community-acquired pneumonia in children. Pediatr Pulmonol 2003;
35(2):91–8.
49. Mulholland S, Gavranich JB, Chang AB. Antibiotics for community-acquired lower respiratory tract infections secondary to Mycoplasma pneumoniae in children. Cochrane Database Syst Rev 2010;(7): CD004875.
Стецюк Ольга Ульяновна – кандидат медицинских наук, старший научный сотрудник НИИ антимикробной химиотерапии ГБОУ ВПО СГМА.
Андреева Ирина Вениаминовна – кандидат медицинских наук, доцент, старший научный сотрудник НИИ антимикробной химиотерапии ГБОУ ВПО СГМА.
Егорова Ольга Анатольевна – кандидат медицинских наук, ассистент кафедры оториноларингологии ГБОУ ВПО СГМА