Введение
На настоящее время урогенитальные симптомы пери- и постменопаузального периодов встречаются у 8–38% женского населения развитых стран [1, 2], однако только 25% пациенток сообщают о своей проблеме врачу и еще меньшему числу женщин будет назначена гормонозаместительная терапия [3].
Все урогенитальные симптомы можно разделить на две категории – расстройства мочеиспускания (РМИ; учащенное мочеиспускание, ургентность, ноктурия, дизурия, рецидивирующие инфекции нижних мочевых путей и недержание мочи) и атрофические процессы со стороны вульвы и влагалища, проявляющиеся сухостью во влагалище, зудом, жжением и диспареунией. Согласно данным опроса 1200 шведских женщин постменопаузального возраста, до 50% респонденток отметили наличие какого-либо урогенитального расстройства, наиболее частыми из которых были сухость во влагалище и, соответственно, диспареуния, а затем зуд и жжение во влагалище [4].
Давно известно, что состояние урогенитальной зоны высокочувствительно к влиянию половых гормонов. Эстрогенные рецепторы определяются как в уретре и мочепузырном треугольнике, так и в связочном аппарате тазового дна и мышце-леваторе заднего прохода [5]. Снижение уровня гормонов в пери- и особенно постменопаузах негативно сказывается на функциональном состоянии данной области, что выражается в уменьшении объема влагалищных мышц и ослаблении связочного аппарата матки, мочевого пузыря и уретры, следствием чего становится развитие недержания мочи и пролапса тазовых органов (ПТО).
Во влагалище эстрогены способствуют созреванию эпителия путем диспозиции гликогена во влагалищный эпителий [6]. Гликоген в свою очередь метаболизируется как питательная среда для естественной бактериальной флоры, которая продуцирует органические кислоты (прежде всего молочную), оказывающие защитный эффект на генитальный тракт в отношении колонизации другими патогенами (например, энтеробактриями).
В связи с развитием эстрогенного дефицита помимо истончения слизистой оболочки повышается риск развития дисбиоза влагалища, а следовательно, и дальнейшей контаминации слизистой оболочки нижних мочевых путей с развитием расстройств мочеиспускания и рецидивирующей инфекции [7].
Некоторые симптомы урогенитальной атрофии (УГА) могут быть купированы применением влагалищных любрикантов, однако, по последним данным, эти увлажнители способны негативно влиять на состояние эпителия влагалища и микробиома [8].
Успешное применение вагинальной терапии эстрогенами для коррекции симптомов УГА было ранее описано рядом авторов [9, 10]. Также продемонстрировал свою эффективность метод восстановления микробиома влагалища путем применения продуцирующих пероксид водорода лактобактерий, в частности, у постменопаузальных пациенток с хронической рецидивирующей инфекцией мочевых путей [11]. Для коррекции дисбиоза на фоне УГА была предложена комбинированная терапия сочетанием эстрогенов и лактобактерий, которая в плацебо-контролируемых исследованиях показала высокую эффективность и безопасность [12].
Считается, что назначение эстриола вагинально лишено потенциальных рисков, ассоциированных с применением системной гормональной терапии [13]. Однако в исследовании S.А. Ballagh (2005) было показано, что даже минимальные дозы эстрогенов (эстрадиол 7,5 мг ежедневно или 25 мг дважды в неделю) попадают в системный кровоток, что может негативно сказаться на состоянии эндометрия [14]. И даже малые дозы эстрогенов должны сочетаться с прогестагеном для профилактики карциномы эндометрия [15]. В исследовании J.А. Chollet и соавт. (2009) показано, что применение комбинированной интравагинальной терапии эстриолом и прогестероном способствует разрешению симптомов УГА без какого-либо отрицательного влияния на толщину эндометрия в течение 6 месяцев наблюдения [16].
Цель настоящей работы заключалась в оценке динамики менопаузальных урогенитальных симптомов у женщин при хирургической коррекции недержания мочи и/или пролапса гениталий на фоне терапии препаратом, который представляет собой комбинацию эстриола (0,20 мг), прогестерона (2 мг) и лиофилизированной культуры Lactobacillus сasei подвид Rhamnosus Dоderleini (не менее 109 КОЕ на 1 г).

Материал и методы
Проведено проспективное когортное исследование динамики менопаузальных урогенитальных симптомов на фоне терапии препаратом, содержащим комбинацию эстрогена, прогестерона и лактобактерий, женщин, планирующих хирургическое лечение недержания мочи и/или пролапса гениталий, на этапе дооперационной подготовки и послеоперационной реабилитации.
Критерии включения в исследование:
- женский пол, пери- и постменопаузальный возраст;
- отсутствие в анамнезе системной гормонозаместительной терапии и применения комбинированной оральной контрацепции в течение 6 месяцев до включения в исследование;
- наличие симптомов атрофического вульвовагинита, подтвержденного цитологическим исследованием;
- наличие РМИ, предстоящая плановая операция хирургической коррекции недержания мочи и/или пролапса гениталий;
- подписанное информированное согласие.
Критерии исключения: противопоказания, перечисленные в инструкции по медицинскому применению лекарственного препарата; прием в течение 12 месяцев до включения в исследование любого варианта заместительной менопаузальной терапии; применение в течение месяца до включения в исследование локальных или системных средств коррекции нарушений микроценоза (дезинфектанты, антисептики или антибактериальные препараты); применение xирургических методов коррекции недержания мочи и/или ПТО в анамнезе в течение последних 12 месяцев. Пациентки считаются «выбывшими из наблюдения», если документально не был зафиксирован визит последующего наблюдения и окончательной оценки терапии препаратом. Исследование было одобрено локальным этическим комитетом.

Исследование проводилось с ноября 2015 по февраль 2016 г. и включило 4 визита. Первый представлял собой отбор пациенток для участия в исследовании, удовлетворивших критериям включения и исключения. Второй визит проведен через 30 дней после включения – накануне оперативного лечения. Далее всем пациенткам обеих групп были выполнены оперативные пособия по коррекции недержания мочи или ПТО с использованием синтетических материалов. В послеоперационном периоде проводились визиты на 3-й и 30-й дни наблюдения (визит 3 и 4).
Все пациентки на первом визите были распределены в две группы. Первая (исследуемая) получала терапию препаратом, содержащим комбинацию эстрогена, прогестерона и лактобактерий, в два этапа: в течение 30 дней до операции (20 дней по 2 капсулы и 10 дней по 1 капсуле в сутки) и в течение 30 дней начиная с 3-го дня после операции (2 капсулы в неделю). Пациентки второй группы (контроля) не принимали исследуемый препарат.
Во время всех визитов проводилась субъективная и объективная оценка выраженности РМИ и УГА (специализированные опросники Urinary Distress Inventory-6 [UDI-6]), влияния РМИ на качество жизни пациенток (опросник Urinary Impact Questionnaire [IIQ-7]), показателей бактериурии и биоценоза влагалища (бактериологический анализ), цитологического исследования, pH влагалищной среды, частоты развития нежелательных явлений (НЯ) и послеоперационных осложнений. Переносимость лечения оценивалась с использованием 5-балльной визуальной аналоговой шкалы (ВАШ). Также были оценены сроки пребывания в стационаре и сроки восстановления самостоятельного мочеиспускания.
Статистическая обработка полученных данных произведена с использованием системы MedCalc. С целью обнаружения различия между средними значениями двух выборок применялись следующие методы статистической обработки: для непрерывных данных использовался t-тест Стьюдента с предварительной проверкой на нормальность методом Шапиро–Вилка; для сравнения номинальных данных использовался критерий v. В тех случаях, когда условия применимости критерия χ2 не выполнялись, использовался точный тест Фишера. Для порядковых данных применялся критерий Манна–Уитни. Статистически значимым уровнем считалось p≤0,05, т.е. вероятность ошибки в интерпретации данных не превышала 5%.
Результаты
Всего в исследование из 130 отобранных пациенток критериям включения и исключения соответствовали 125 женщин (см. рисунок). Исследуемую группу составили 95, группу контроля 30 пациенток. По исходным характеристикам исследуемые группы пациенток были сопоставимыми (см. табл. 1).
В исследуемой группе на первом этапе терапии (на второй день приема препарата) в связи с НЯ (выраженный зуд и жжение во влагалище) выбыли две пациентки. В итоге в исследуемой группе продолжили лечение 93 пациентки.
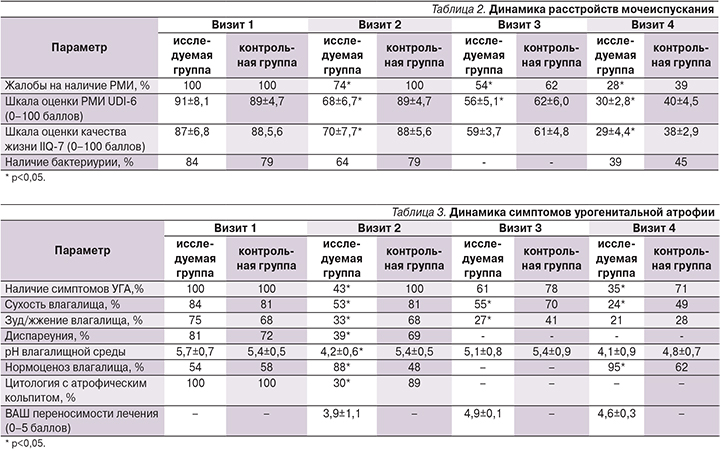
Спустя 30 дней наблюдения на втором визите была отмечена положительная динамика в отношении уменьшения выраженности РМИ (табл. 2), а также симптомов УГА (табл. 3) как при межгрупповом, так и при внутригрупповом анализе.
Статистически значимые различия были получены в отношении субъективной оценки наличия РМИ (74 против 100% в исследуемой и контрольной группах после 1-го этапа лечения соответственно; р<0,05), а также по объективным данным опросника оценки выраженности РМИ UDI-6 (68±6,7 против 89±4,7; р<0,05) и опросника оценки качества жизни в соответствии с состоянием мочеиспускания IIQ-7 (70±7,7 против 88±5,6; р<0,05). Также была отмечена положительная тенденция в отношении уменьшения процента бактериурии (64 против 79%; р<0,05).
Значимые положительные изменения на фоне лечения были отмечены и в отношении динамики наличия симптомов УГА (43 против 100% в исследуемой и контрольной группах после 1-го этапа лечения соответственно; р<0,05), в т.ч. сухости влагалища (53 против 81 %; р<0,05), зуда/жжения во влагалище (33 против 68%; р<0,05), pH влагалищной среды (4,2±0,6 против 5,4±0,5; р<0,05), числа пациенток с нормоценозом влагалищной среды по данным бактериологического анализа (88 против 48%; р<0,05) и наличием атрофического кольпита по результатам цитологического исследования (30 против 89%; р<0,05). Следует отметить разрешение диспареунии 30% пациенток (39 против 69%; р<0,05).
Всем 123 пациенткам обеих групп были успешно выполнены оперативные пособия.
В исследуемой группе (n=93):
- операции по поводу недержания мочи (TVT-O, Monarc, Ophira, TVT): n=56;
- операции по поводу ПТО (Elevate Ant et Apical, сакроспинальная фиксация, пластика цистоцеле местными тканями): n=37.
В группе контроля (n=30):
- операции по поводу недержания мочи (TVT-O, Monarc, Ophira, TVT): n=19;
- операции по поводу ПТО (Elevate Ant et Apical, сакроспинальная фиксация, пластика цистоцеле местными тканями: n=11.
Не было отмечено каких-либо интраоперационных осложнений. На этапе послеоперационной реабилитации также производилась оценка динамики менопаузальных урогенитальных симптомов в обеих группах пациенток. На 30-й день наблюдения после хирургического лечения (визит 4) наблюдалось статистически значимое улучшение субъективной (28 против 39%; р<0,05) и объективной клинической картины РМИ (30±2,8 против 40±4,5; р<0,05), а также показателей качества жизни в соответствии с состоянием мочеиспускания (29±4,4 против 38±2,9; р<0,05), симптомов УГА (35 против 71%, р<0,05) и сухости во влагалище (24 против 49%; р<0,05), показателей нормоценоза влагалища (95 против 62%; р<0,05). Также отмечена тенденция к снижению выраженности бактериурии (39 против 45%; р<0,05) и нормализации pH среды влагалища (4,1±0,9 против 4,8±0,7; р<0,05) в группе, получавшей терапию, по сравнению с группой контроля. С учетом реаблитационного периода всем пациенткам было рекомендовано половое воздержание в течение месяца, в связи с чем наличие диспареунии не оценивалось.
На всех этапах терапии наблюдалась хорошая переносимость терапии исследуемым препаратом по ВАШ (3,9±1,1 и 4,9±0,1 после 1-го и 2-го этапов лечения).
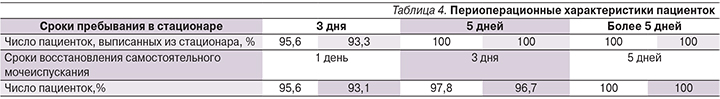
Не было отмечено значимых различий по срокам восстановления мочеиспускания после операции и продолжительности пребывания в стационаре, а также по числу отдаленных послеоперационных осложнений (более 15 дней после операции; табл. 4).
Однако в исследуемой группе 2 пациентки с сахарным диабетом 2 типа в стадии субкомпенсации отметили эпизод острого цистита на 22-й и 30-й день послеоперационного наблюдения соответственно.
Обсуждение
Известно, что снижение овариального резерва в пери- и постменопаузальном периодах ведет к значительным изменениям в организме женщины. Но в отличие от вазомоторных симптомов урогенитальные расстройства не разрешаются, а обычно, наоборот, усиливаются с наступлением менопаузы [17]. По данным литературы, при использовании локальной терапии эстрогенами уменьшение выраженности симптомов вагинальной атрофии наблюдается у 80–95% пациенток [3]. Мета-анализ 77 исследований показал, что применение эстрогенов (как перорально, так и вагинально во всех существующих режимах дозирования) эффективно для лечения УГА. В частности, в 10 рандомизированных плацебо-контролируемых исследованиях было доказано, что использование локальной терапии имеет преимущество по эффективности по сравнению с пероральным приемом. Согласно результатам настоящего исследования, применение препарата Триожиналь® способствует улучшению менопаузальных урогенитальных симптомов у женщин при хирургической коррекции недержания мочи или пролапса гениталий.
В отношении хирургического лечения известно, что каждая 5-я женщина имеет риск быть прооперированной к 80 годам по поводу ПТО либо недержания мочи [18]. С учетом тенденции к увеличению ожидаемой продолжительности жизни населения развитых стран, а следовательно, числа женщин в постменопаузе данная проблема приобретает все большую актуальность и требует пристального внимания. Хирургическое лечение с использованием синтетических имплантатов позволило снизить частоту развития рецидива заболевания, однако возникла новая группа специфических осложнений, связанных с установкой сетчатого протеза, к числу которых относятся инфекционные осложнения, эрозии/протрузии сетчатого имплантата, сморщивание протеза с развитием синдрома тазовых болей. Также в послеоперационном периоде существует вероятность развития различных дисфункций тазового дна, в т.ч. РМИ (недержание мочи при напряжении de novo, синдром гиперактивного мочевого пузыря, затрудненное мочеиспускание), тазовых болей и диспареунии. В связи с этим актуален вопрос тщательного подбора пациенток для данных операций и четкого алгоритма предоперационной подготовки, а также послеоперационной реабилитации. В связи с этим отдельного внимания заслуживает совершенствование алгоритмов послеоперационной реабилитации пациенток.
По данным зарубежных руководств, нет убедительных сведений в отношении рутинного применения локальной либо системной гормонотерапии до и после хирургической коррекции ПТО вне зависимости от доступа операции (уровень рекомендаций С) [19]. Однако в случае наличия менопаузальных урогенитальных симптомов данный подход имеет право на существование. В исследованиях D.D. Rahn и соавт. показано, что интравагинальное применение эстрогенов в течение 6 недель предоперационного периода способствовало усилению синтеза зрелого коллагена, снижению активности разрушающих ферментов и увеличению толщины стенки влагалища, что могло способствовать лучшему восстановлению тканей после наложения шовного материала или имплантации синтетического материала [20]. Однако в другом исследовании отмечена лишь положительная динамика в отношении цитологического исследования содержимого влагалища без увеличения толщины эпителиальной выстилки [21].
Согласно результатам настоящего исследования, интравагинальное применение препарата, содержащего комбинацию эстрогена, прогестерона и лактобактерий, на этапе 30-дневной дооперационной подготовки пациенток, страдавших недержанием мочи и/или ПТО, способствовало уменьшению выраженности клинической картины РМИ и улучшению показателей качества жизни, а также ослаблению выраженности симптомов УГА (в частности, зуда во влагалище и диспареунии), значимо улучшив показатели биоценоза влагалища, в т.ч. показатели pH среды.
По данным ряда работ, применение локальной гормонотерапии после выполнения хирургического лечения с использованием субуретральной петли в раннем послеоперационном периоде приводит к снижению выраженности РМИ, таких как учащенное мочеиспускание и ургентность [22, 23]. В нашем исследовании применение препарата, содержащего комбинацию эстрогена, прогестерона и лактобактерий, после хирургического лечения недержания мочи и/или ПТО положительно влияло на выраженность клинической картины РМИ, параметры качества жизни пациенток, симптомы УГА (в частности, сухость во влагалище) и показатели биоценоза влагалища; способствовало снижению выраженности бактериурии. Это подтверждается данными работы D.R. Karp и соавт., в которой было показано, что раннее локальное применение эстрогенов после хирургических манипуляций влагалищным доступом приводит к улучшению состояния тканей тазового дна в послеоперационном периоде по сравнению с плацебо и группой контроля [24].
Также следует отметить результаты A.L. Mikkelsen и соавт., согласно которым предоперационное применение низких доз эстрадиола вагинально может способствовать уменьшению вероятности возникновения бактериурии в раннем послеоперационном периоде, но не рецидивирующей инфекции мочевых путей [25], что соответствует полученным нами данным.
Необходимо подчеркнуть, что исследуемая терапия не оказывала значимого влияния на сроки восстановления мочеиспускания и продолжительность пребывания в стационаре, а также на количество послеоперационных осложнений. В ходе применения препарата, содержащего комбинацию эстрогена, прогестерона и лактобактерий, как на этапе дооперационной подготовки, так и в раннем послеоперационном периоде пациентками с недержанием мочи и/или ПТО отмечена хорошая переносимость терапии с минимальной частотой НЯ (2%), выразившихся в усилении жжения и зуда во влагалище в начале приема препарата.
Проведенное исследование имеет ряд достоинств и ограничений. Его проспективный дизайн с использованием группы контроля и регулярных визитов больных с выполнением всех основных клинико-лабораторных обследований, большая выборка пациенток при строгом соблюдении всех критериев включения/исключения позволяют говорить о хорошей доказательной базе работы. Однако отсутствие рандомизации/детальной стратификации пациенток (различные исходные нозологии, возможное сопутствующее наличие симптомов гиперактивного мочевого пузыря, наличие пациенток с рецидивирующей инфекцией нижних мочевых путей) в исследовании, особенности выполнения оперативного пособия (опыт хирурга, методика и объем операции) служат основным ограничением данной работы. Тем не менее в исследовании получены первые данные об эффективности и безопасности комбинированной терапии менопаузальных урогенитальных симптомов препаратом, содержащим комбинацию эстрогена, прогестерона и лактобактерий, при хирургической коррекции недержания мочи или пролапса гениталий.
Выводы
На основании полученных результатов коллектив авторов может сделать следующий вывод: применение препарата, содержащего комбинацию эстрогена, прогестерона и лактобактерий, способствует ослаблению выраженности менопаузальных урогенитальных симптомов у женщин при хирургической коррекции недержания мочи или пролапса гениталий и может быть рекомендовано как в до-, так и в послеоперационном периодах.


