Термин «дисфункция тазового дна» (ДТД) – собирательное понятие, включающее недержание мочи (НМ), пролапс тазовых органов (ПТО), недержание кала и сексуальную дисфункцию [1].
В обзоре [2] показано, что симптомы ДТД имеют место уже во время беременности по крайней мере у 40% женщин, которые сохраняются в течение 6–8 недель послеродового периода у большинства из них. Через 1 год после родов частота НМ и ПТО увеличивается на 7–10%, а через 10 лет – на 25% и достигает тех значений, которые указываются в литературе для женщин, обследованных через 10 и более лет после родов (50–77%). Частота сексуальных расстройств коррелирует с вышеуказанными проявлениями ДТД и увеличивается с 20% в послеродовом периоде до 50–80% в отдаленные сроки.
Напротив, частота недержания кала уменьшается (с 40% во время беременности до 4–17% после родов), при этом около половины женщин, имевших этот симптом в первые 3 месяца после родов, отмечают его на протяжении последующих 10 лет. У женщин, перенесших разрывы промежности III–IV степеней, частота недержания кала в 2,7 раза выше по сравнению с теми, у кого не было такой травмы.
Беременность и роды могут служить причиной повреждения каудальных отделов m. levator ani, фасциальной опоры органов таза и анальных сфинктеров [3].
Мышечный комплекс m. levator ani, состоящий из m. pubococcygeus, m. puborectalis и m. iliococcygeus, является самой большой мышцей и важнейшим компонентом системы поддержки тазового дна. Этот мышечный комплекс формирует U-образную стропу вокруг уретры, дистального отдела влагалища и прямой кишки, обеспечивая таким образом поддержку этих структур. Нормальная базовая активность m. levator ani сохраняет закрытым урогенитальное отверстие, противодействуя внутрибрюшному давлению [3].
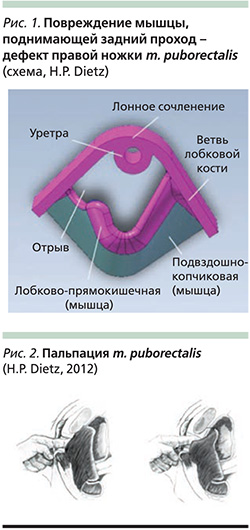 Повреждение m. levator ani означает нарушение связи между m. puborectalis и нижней ветвью лобковой кости (рис. 1). Такое повреждение мышцы леватора является макроскопически очевидным и может быть выявлено пальпаторно – навык, доступный каждому клиницисту и не требующий инвестиций или специализированного оборудования.
Повреждение m. levator ani означает нарушение связи между m. puborectalis и нижней ветвью лобковой кости (рис. 1). Такое повреждение мышцы леватора является макроскопически очевидным и может быть выявлено пальпаторно – навык, доступный каждому клиницисту и не требующий инвестиций или специализированного оборудования.
Для выявления отрыва мышцы необходимо пальпировать щель между уретрой и m. puborectalis, куда в норме помещается один указательный палец. Его необходимо перемещать латерально по отношению к уретре, попросив пациентку сократить мышцы тазового дна. Если палец смещается вдоль нижней ветви лобковой кости на 2–3 см и при этом не пальпируются мышечные сокращения, это свидетельствует о полном отрыве мышцы (рис. 2).
Слева палец обнаруживает непрерывное сопротивление мягких тканей между основным телом лобковой мышцы и тазовой боковиной. Справа кость нижней лобковой ветви обнажена с промежутком между боком и основным телом лобковой мышцы.
Автором было показано, что данная методика не уступает по точности (80–87%) и сравнима с 3D/4D-транслабиальным ультразвуковым исследованием и любая из этих методик может быть использована для документирования травмы мышцы в зависимости от ресурсов лечебно-профилактического учреждения [5].
Визуальная система регистрации результатов, полученных при пальпации лобковых мышц (рис. 3), должна включать и форму оценки Оксфорда для «сжатия и подъема» в двустороннем порядке. Кроме того, следует попытаться провести морфологическую оценку лобковой мускулатуры и задокументировать результаты как дефекты или пробелы, так и прореживание.
Повреждение m. puborectalis является наиболее распространенным следствием родов через естественные родовые пути [2, 6], оказывающее наибольшее влияние на целостность и функцию тазового дна, особенно если травма двусторонняя [7]. В некоторых случаях подобные дефекты становятся очевидными и диагностируются еще в родзале у женщин с крупными разрывами влагалища, но зачастую они остаются незамеченными. Распространенность таких дефектов составляет около 20% [8].
Другим вариантом родового травматизма является повреждение фасции. Передняя стенка влагалища «укреплена» fascia pubocervicalis, которая прикрепляется дистально к области лобковой кости и проксимально – к шейке матки. Она также прикреплена сбоку (с обеих сторон) к мышцам тазового дна, в частности к m. obturator internus. Пока эта вагинальная перегородка цела, мочевой пузырь и уретра остаются в нормальном анатомическом положении. Дефекты эндоплазматической фасции (рис. 4) приводят к развитию переднего пролапса и НМ при стрессе [9–10].
Поддерживающий слой задней стенки влагалища fascia rectovaginalis прикрепляется дистально к промежностному телу, сбоку к m. levator ani и проксимально к шейке матки. Когда имеется разрыв ректовагинальной перегородки, стенка прямой кишки соприкасается с влагалищной стенкой и создает «выпуклость» на задней нижней стороне влагалища (ректоцеле) [9]. Разрывы или отрыв фасций от мест их прикрепления встречаются с частотой около 30% после родов [10].

Таким образом, несостоятельность тазовой диафрагмы, обусловленная анатомическим повреждением структур тазового дна (разрыв/отрыв m. levator ani и фасций) формирует грыжу тазовых органов, имеющую различную топографию грыжевых ворот, и как следствие – включает или не включает в свой состав мочевой пузырь или прямую кишку. С течением времени процесс прогрессирует, последовательно минуя различные степени выраженности до полного выпадения матки и влагалища. Поэтому, как указывает профессор В.Е. Радзинский, анатомический дефект, сопутствующий пролапсу гениталий II и выше степеней (по POP-Q), служит показанием к хирургическому лечению [11]. В данном случае будут неэффективными любые консервативные способы коррекции, которые только оттягивают сроки оперативного лечения, ухудшая его прогноз.
Однако, несмотря на увеличение числа пациенток фертильного возраста с ДТД, в настоящее время не решена проблема выбора тактики лечения и времени оперативной коррекции. Предложены оригинальные методы реконструкции тазового дна, но ни один из них не является универсальным, а частота рецидивов составляет 50%.
Механическое растяжение, денервация, ишемия и реперфузионное повреждение опорной системы мышечно-фасциального комплекса тазового дна во время беременности и родов и последующее их дефектное ремоделирование являются одними из основных механизмов повреждения и развития ДТД в отсутствие явного посттравматического дефекта.
Из-за относительного поверхностного анатомического положения n. pudendus в женском тазу он может быть травмирован во время родов. Сообщается о растяжении и компрессионном повреждении n. pudendus у 38–42% женщин при вагинальных родах [12]. Концентрическая игольная электромиография у женщин с вагинальным родоразрешением в анамнезе показала признаки временной денервации тазового дна [13]. Однако в большинстве случаев это явление обратимо и возможна реиннервация, о чем свидетельствует увеличение плотности нейрофиламентов [14]. Однако, если имеет место серьезное повреждение нерва, возвращение функции может быть отсрочено [15].
Модели животных показали, что стенки влагалища и его поддерживающий тканевой комплекс более растяжимы во время беременности [16]. Это явление опосредуется усиленным синтезом коллагена и эластина фибробластами. Структурными компонентами тканей тазового дна являются главным образом фибриллярные коллагены I и III, которые отвечают за сохранение прочности при растяжении, и эластичные волокна, состоящие из эластина на каркасе из микрофибрилл, фибриллина-1 и -2, обеспечивающих растяжение и сокращение. Изменения в свойствах коллагена вносят вклад в снижение функциональной поддержки тазового дна, а снижение общего содержания коллагена может приводить к ослаблению и растяжению тазовых связок.
Чрезмерное растяжение стенки влагалища во время родов инициирует деградационный ответ, опосредованный высвобождением коллагеназ из активированных фибробластов. Это приводит к увеличению деградации коллагена, а также других составляющих стенки влагалища. Таким образом, трудные или длительные роды могут приводить к превышению пределов растяжения мягких тканей, вызывая дисбаланс в репаративных и деградирующих процессах и повышая восприимчивость структур, поддерживающих тазовое дно, к родовой травме [17].
После родов происходит ремоделирование компонентов соединительной ткани за счет увеличения синтеза коллагена и эластина. Однако новая ткань не так сильна, как исходная, которую она заменяет. Дефекты в процессе ремоделирования стенки влагалища после родов изучались на животных как возможный механизм развития пролапса [18]. Генетические и экологические факторы также способствуют возникновению НМ и ПТО. Изучение 3376 монозиготных и 5067 дизиготных женщин-близнецов, выполненное D. Altman et al. [19], показало бóльшее сходство результатов у монозиготных близнецов. В исследовании нерожавших женщин H.P. Dietz et al. [20] продемонстрировали наследуемость подвижности мочевого пузыря. Систематический обзор S.L. Lince et al. [21] обнаружил значительно бóльшую вероятность пролапса у женщин с генетической предрасположенностью по сравнению с женщинами без нее.
Релаксин, который играет важную роль в поддержании удержания мочи во время беременности, может стимулировать рост тканей в нижних отделах мочевыводящих путей и увеличивать уретральное давление. Наблюдается заметное увеличение концентрации релаксина до пика в гестационном возрасте 10–14 недель, а затем снижение до стабильного уровня примерно в половине пикового значения на 17–24-й неделях беременности, что приводит к уменьшению роста эпителия уретры [22, 23]. Это может приводить к снижению тонуса уретры [24].
Поскольку беременные женщины с НМ имеют более низкий тонус уретры, чем беременные женщины без НМ, более низкие концентрации релаксина на поздних сроках беременности, следовательно, коррелируют с более высокой распространенностью НМ во втором и третьем триместрах.
Прогестерон увеличивается во время беременности с 24 нг/мл на 8-й неделе до 150 нг/мл на 36-й [25]. Повышенный уровень прогестерона способствует расслаблению гладких мышц тазового дна и мочевой системы, может приводить к уменьшению объема мочевого пузыря и тонуса уретры [26]. Значения параметров профиля давления уретры ниже медианного значения и дефектной передачи давления над уретрой наблюдались почти у всех беременных женщин, которые испытали НМ во время беременности. Эти наблюдения указывают на то, что присущая слабость механизма сфинктера уретры играет ключевую роль в патогенезе НМ [27]. Однако изменения в уровнях гормонов во время беременности не коррелировали с изменениями профиля давления уретры.
Два фактора – увеличение матки и веса плода с гестационным возрастом, особенно в третьем триместре, влияют на механизм недержания мочи. Они оказывают прямое давление на мочевой пузырь, что может приводить к изменению положения шейки мочевого пузыря [28] и уменьшению его емкости, что способствует повышению давления в мочевом пузыре, превышающего таковое уретры [24, 29], что и приводит к утечке мочи.
Таким образом, физиологические изменения во время беременности приводят к снижению прочности, поддерживающей и сфинктерной функции тазовых мышц. Это вызывает подвижность шейки мочевого пузыря и уретры и приводит к некомпетентности сфинктера. Следовательно, когда внутрибрюшное давление увеличивается при кашле, чихании, смехе или движении, давление внутри мочевого пузыря становится больше, чем таковое закрытия уретры, а сфинктер недостаточно силен, результатом будет утечка мочи. Те же механизмы срабатывают и при прогрессирующем опущении тазовых органов.
Однако беременность и роды не являются единственным фактором, способствующим выпадению тазовых органов. Эффект паритета наиболее заметен у молодых женщин в возрасте от 20 до 34 лет и исчезает у женщин старше 65 лет [30].
Возраст является фактором риска, связанным с симптоматическим пролапсом и значительным дефицитом мышечной массы m. levator ani [30].
К другим факторам риска развития ПТО относятся курение, подъем тяжестей, хронические заболевания, ожирение, диабет, неврологические расстройства [10], которые при слабости мышц тазового дна в сочетании с повышением внутрибрюшного давления ведут к постепенному развитию ПТО и функциональных нарушений со стороны мочевого пузыря и прямой кишки, ухудшению сексуальной функции. Симптомы пролапса при этом могут не проявляться в течение многих лет после такого события, как роды, но когда они появляются, могут быть довольно тягостными [10].
Отдельные авторы связывают «омоложение» пролапса с развитием генерализованной дисплазии соединительной ткани [31, 32], малые формы которой встречаются с частотой 6,7% у женщин перименопаузального возраста, а у женщин фертильного возраста – 22,2–25,0% [33]. В то же время дисплазия соединительной ткани как первичная причина несостоятельности тазового дна (НТД) возможна только у женщин, страдающих пролапсом гениталий и не имевших в анамнезе беременности более 20 недель, однако число этих женщин составляет всего 1% [34].
По рекомендациям FDA (Food and Drug Administration), достижение идеальной тазовой поддержки не является необходимым для большинства женщин, чтобы добиться симптоматической помощи, и не каждая женщина с выпадением половых органов нуждается в хирургическом лечении [35]. Эксперты рекомендуют информировать пациентов о преимуществах и рисках нехирургических вариантов лечения, хирургии без сетчатого имплантата, хирургической сетки, устанавливаемой абдоминально, и вероятном успехе этих альтернатив по сравнению с трансвагинальной хирургией с сеткой. На основании результатов мета-анализа было показано отсутствие преимуществ хирургического лечения с применением сетчатых имплантатов по сравнению с лечением без них и отмечено, что 50% пациенок требуется повторная операция. Особо подчеркивается, что только при недостаточной эффективности консервативных методов (сохранении или прогрессировании симптомов) показано хирургическое лечение.
Профилактика, ранняя диагностика и эффективное лечение слабости мышц тазового дна позволяют избегать формирования пролапса в подавляющем большинстве случаев. Тренировки мышц тазового дна – это единственный способ консервативного лечения, направленный в будущее: способ, который должен быть обязательным компонентом любого комплекса и не может подменяться иными формами консервативного лечения, откладывающими начало эффективных тренировок (В.Е. Радзинский) [11].
Среди методов консервативного лечения указываются [36, 37]:
- простые способы изменения стиля жизни (4-С) – лечение хронического кашля (отказ от курения, лечение хронической обструктивной болезни легких), профилактика запоров (диета, богатая клетчаткой), избегание физических нагрузок, связанных с подъемом тяжестей, поддержание нормальной массы тела (снижение массы тела при ее избытке);
- тренировки мышц тазового дна (Iа-А) – упражнения Кегеля с использованием перинеометра или тренажеров с биологически обратной связью (в т.ч. для домашнего применения);
- использование средств, содержащих эстрогены (или селективные модуляторы эстрогеновых рецепторов – ралоксифен, тамоксифен) (Ia-А);
- использование пессариев гинекологических или урогинекологических (Ib-А);
- наблюдение и контроль со стороны врача (4-С).
Эффективное консервативное лечение предполагает его раннее начало, в идеале – сразу после родов. Методы консервативного лечения ПТО на ранних стадиях, в т.ч. осложненных недержанием мочи и кала, с помощью тренировок мышц тазового дна (упражнения Кегеля с использованием перинеометра, вагинальных тренажеров) эффективны по критерию уменьшения степени пролапса у 17% пациенток, что было показано в 4 рандомизированных клинических исследованиях, отличающихся высокой степенью доказательности [38].
При этом снижение выраженности симптомов со стороны мочевого пузыря и кишечника достигается у 40–60% пациенток, а отсутствие прогрессирования – более чем у 94% [39]. Эффективность подтверждается также данными УЗ-исследования (увеличение объема мышц, сокращение длины мышц и повышение позиции мочевого пузыря и прямой кишки) [40].
Полученные В.Н. Серовым и соавт. результаты применения электростимуляции мышц тазового дна у пациенток со снижением их тонуса в сочетании со стрессовым НМ умеренной и легкой степеней тяжести и у больных со снижением тонуса мышц тазового дна без НМ свидетельствуют о достаточно высокой эффективности указанного метода лечения. Оценка проведена на основании анализа симптомов, дневников мочеиспусканий, одночасового прокладочного теста, качества жизни по Incontinence Quality of Life Questionnaire (I-QoL, опросник качества жизни при инконтиненции), опросника Patient Global Impression of Severity (PGI-S, общее впечатление пациенток о степени тяжести состояния) и Patient Global Imression of Improvement (PGI-I, общее впечатление пациенток об улучшении состояния). Увеличение контрольных показателей тестов более, чем на 50% от исходного уровня, отмечено у 87,5% пациенток первой (с симптомами стрессового НМ) и у 100% женщин второй (без симптомов) групп. У большинства пациенток улучшение наступало через 4–5 недель терапии [41].
В многоцентровом проспективном нерандомизированном исследовании изучалась эффективность электромиостимуляции у женщин с ургентным и смешанным НМ, получавших лечение по 15 минут дважды в день в течение 20 недель. У всех женщин наблюдалось снижение частоты опорожнения мочевого пузыря, эпизодов «утечки» мочи и частоты ночных мочеиспусканий. Среди пациенток 69% имели существенное улучшение (снижение частоты симптомов на 50% и более), при этом 28% из них были излечены. В целом 93% пациенток хорошо переносили лечение и 72% были удовлетворены его результатами [42]. Аналогичные результаты (у 70% пациенток с НМ) представлены в исследовании Н. Eyjólfsdóttir и соавт. [43].
Систематический обзор применения тренировок мышц тазового дна у беременных и родивших показал их эффективность и даже превосходство над электрической стимуляцией и использованием конусов, что послужило основанием для рекомендаций по включению в качестве рутинной части для женских программ в послеродовом периоде. Полезна электромиостимуляция в лечении НМ после родов при условии продолжительности тренировок не менее 8 месяцев. Альтернативные тренировки (пилатес, тай чи и др.) не получили доказательств эффективности и не рекомендуются [44].
Эффективность применения пессариев, по данным 1 РК, составляет 60%, по данным когортных исследований, достигает 92% [45].
При сравнении результатов лечения в группе женщин, использовавших пессарии, с теми, кто был прооперирован, было выявлено статистически значимое снижение степени пролапса, улучшение функции мочевого пузыря, кишечника и сексуальной функции через 1 год после проведенного лечения в обеих группах без существенной разницы между ними [46].
Почти все симптомы пролапса купируются в течение до 2 месяцев использования пессария: наличие «выпуклости» в половой щели (с 90 до 3%, р<0,001), чувство давления (с 49 до 3%, р<0,001), непроизвольная потеря мочи (с 12 до 0%, р=0,003), а также запоры (с 14 до 0%, р=0,001).
По данным отдельных авторов, при использовании пессариев происходят положительные объективные изменения: уменьшение размера половой щели через 3 месяца с 4,8 до 3,9 см, снижение степени опущения у 21% женщин после 1-го года использования (по POP-Q) [47].
Купирование мочевых симптомов (стрессовое недержание, частые позывы и затруднение мочеиспускания) достигается в 59% случаев [48], симптомы, связанные с дисфункцией кишечника (анального недержания и обструктивные симптомы), – в 40% [49], рост частоты сексуальных контактов и сексуального удовлетворения выявлен в 50% [50].
Таким образом, наличие высокого риска ДТД у женщин в период гестации и после родов, а также констатация у 35% женщин в этот период недержания мочи и пролапса тазовых органов I и II степеней свидетельствуют о необходимости активного выявления таких женщин с помощью скрининга и оказания им своевременной медицинской помощи.


