Хронический панкреатит (ХП) – часто встречающееся хроническое рецидивирующее воспалительное заболевание поджелудочной железы (ПЖ), приводящее к прогрессирующей атрофии железистой ткани органа, замещению соединительной тканью клеточных элементов паренхимы, поражению протоков, болевому синдрому и потере экзо- и эндокринной функций железы, как правило, сопровождающееся нарушениями нутриционного гомеостаза [1, 5–7]. Заболеваемость ХП в РФ составляет 27,4–50 случаев на 100 тыс. населения в год, в западных странах – от 1,6 до 56 случаев на 100 тыс. населения в год [3]. Около 20% больных ХП умирают от его осложнений в срок до 10 лет от момента установления диагноза. Двадцатилетняя выживаемость составляет всего 45% [4].
Столь неутешительные данные свидетельствуют о том, что проблема тактики лечения ХП по-прежнему актуальна. В последние десятилетия все чаще обсуждается вопрос о показаниях к хирургическому лечению ХП и оптимальном объеме лапароскопической резекции ПЖ при данной патологии. Обширный характер оперативного вмешательства, высокая частота общих и специфических осложнений (панкреатическая фистула, гастростаз) требуют тщательного изучения нутритивного статуса (нутриционной диагностики по параметрам алиментационно-волемического диагноза – АВД), т.к. существует прямая корреляционная зависимость между нутритивной недостаточностью и летальностью: чем выше белково-энергетический дефицит, тем чаще наблюдаются развитие осложнений, полиорганная дисфункция и летальный исход. В связи с этим уточнения требуют современные подходы к нутриционному лечению в до- и послеоперационом периоде. В частности, в свете развития многокомпонентной технологии fast-track спорными и требующими изучения являются вопросы: всегда ли после операций следует отказываться от парентеральной нутритивной поддержки и в какие сроки необходимо переходить на раннее энтеральное или сипинговое питание, какие программы нутриционной поддержки наиболее оптимальны, чтобы обеспечить профилактику метаболических и хирургических осложнений? Небезынтересен и вопрос об объеме нутриционной предоперационной подготовки, ее достаточности и целесообразной длительности [2].
Решение этих вопросов возможно на основе сопоставления состояния функций ПЖ (ее экзосекреции, определяющей уровень усвоения нутриентов, функционального резерва) и нутриционного дефицита (нутриционный риск по АВД).
Материал и методы
Анализу (ретроспективному и проспективному) подверглись данные 17 пациентов (7 женщин и 10 мужчин в возрасте 55,5±2,9 года), страдавших ХП. При этом у 1 пациента выявлен ХП типа А по М. Buchler и соавт. (классификация 2009 г.), у 8 – ХП типа В и у 8 – типа С. Двое пациентов лечились консервативно, 15 – подверглись оперативным вмешательствам в связи с возникшими осложнениями (свищи – в 2% случаев, дуоденальная дистрофия – в 24%, калькулезный ХП – в 26%, стриктуры панкреатического протока [ПП] – в 5%, расширение ПП – в 9%, кисты ПЖ – в 5%, асцит – в 17%, желтуха – в 19%, у остальных пациентов отмечено сочетание нескольких осложнений, например спленомегалии и регионарной портальной гипертензии). Пациентам были выполнены следующие виды операций: дренирование кисты – 1 больному, корпорокаудальная резекция – 2, панкреатодуоденальная резекция (пилоросохраняющая) – 1, резекция головки ПЖ с продольным цистопанкреатоеюноанастомозом на отключенной по Ру петле – 2, дренирование желчного пузыря – 1, тотальная резекция головки ПЖ с циркулярной резекцией нисходящей части двенадцатиперстной кишки – 1, дренирование холедоха – 1, гастропанкреатодуоденальная резекция – 1, дистальная резекции хвоста ПЖ – 1, субтотальная резекция ПЖ с формированием гепатикоеюноанастомоза на петлях тонкой кишки – 1. У наблюдаемых больных был использован следующий порядок метаболической коррекции: консультация нутрициолога, начало предоперационной подготовки амбулаторно, предоперационная коррекция в стационаре терапевтического профиля (до операции) – 7 дней, послеоперационный период в режиме fast-track в реанимационном и хирургическом отделениях при участии нутрициоло-га – 5–6 дней.

Для выбора оптимальной программы метаболической коррекции сравнивали две группы пациентов: получавших традиционную нутритивную коррекцию в до- и постоперационном периодах и модифицированную коррекцию в соответствии с приведенным выше порядком и на основе данных АВД (функционального резерва лимитирующих усвоение органов, реабилитационного потенциала, готовности кишечника к усвоению нутриентов и др.). Оценку нутритивного статуса осуществляли по АВД (при расчете антропометрических параметров использовали биоимпедансную методику определения состава тела с помощью прибора МЕДАСС).
Секрецию ПЖ исследовали по результатам определения С-пептида, эластазы кала, активности липазы, исследованиям копрограммы, при наличии показаний определяли паратгормон. При сравнении предложенной нами технологии с традиционной тактикой проводили не только клинический, но и фармакоэкономический анализ по критериям анализа затрат, анализа влияния на бюджет и упущенных возможностей, эффективности, анализа «затраты–эффективность». В работе пользовались современной классификацией ХП. Едина классификация ХП отсутствует. В МКБ-10 с ХП связаны следующие параграфы:
- К.86.0. Алкогольный ХП.
- К.86.1. Другие формы ХП (инфекционный, непрерывно-рецидивирующий, возвратный).
- К.86.2. Киста ПЖ.
- К.86.3. Псевдокисты ПЖ.
- К.86.8. Другие уточненные заболевания ПЖ (атрофия, литиаз, фиброз, цирроз, панкреатический инфантилизм, некроз).
- К.90.3. Панкреатическая стеаторрея.
Однако наиболее применяемая в клинической практике классификация M. Buchler и соавт. (2009), которую мы и использовали в настоящей работе (табл. 1).
Результаты
Осложнения, наблюдавшиеся при различных типах ХП, приведены в табл. 2.
Сопоставление параметров внешней секреции ПЖ и нутриционного статуса на основе полученных данных свидетельствует, что при осложненном ХП типа А секреторные расстройства отсутствовали. Нутриционный статус страдал незначительно, однако имели место нарушения концентраций кальция и хлора в плазме, дефицит циркулирующего белка до 7,8% от нормы, дефицит массы тела 1–2-й степеней (индекс массы тела [ИМТ] около 16–17; окружность плеча у мужчин – 23–24 см, у женщин – 22 см; кожно-жировая складка над трицепсом [ТКЖС] у мужчин 8,5, у женщин – 11,6 мм), лимфоциты – 1600×109/л. Распределение скелетно-мышечной массы и водных разделов по МЕДАСС было в пределах нормы.
Функциональный резерв органов, лимитирующих усвоение нутриентов, находился в пределах допустимого.

Индекс нутриционного риска (НР) по соотношению альбумина и изменения массы тела составил 97,4 (минимальный НР). Параметры секреции ПЖ при ХП типа В представлены в табл. 3, при этом уровень паратгормона четко изменялся лишь при калькулезно осложненном панкреатите.
Сопоставление параметров внешней секреции ПЖ и нутриционного статуса на основе полученных данных свидетельствует, что при ХП типа В секреторные расстройства ПЖ, как и при типе А, не были критическими или отсутствовали вовсе. При этом нутритивный статус требовал коррекции в 28,9% случаев в связи с наличием дефицита массы тела (около 12%), дефицита циркулирующего альбумина (альбумин составлял в среднем 37 г/л), что соответствовало индексу НР 92,9 (умеренная недостаточность питания, средний НР).
В связи с тем что наиболее трудными при организации нутритивной коррекции являются пациенты с нарушенной функцией ПЖ, в настоящей работе наиболее детальный анализ посвящен именно схеме нутритивной поддержки больных ХП типа С, его осложнениями в дооперационном периоде и на ранних этапах после лапароскопических операций.
При ХП типа С нутриционной предоперационной коррекции требовали 91,2% пациентов. Чаще в предоперационном периоде отмечалось угнетение внешней секреции ПЖ (в большинстве случаев в отсутствие существенного угнетения других лимитирующих алиментационный метаболизм органов); степень НР при этом была низкой у 29% больных и средней – у 42%. При ХП типа С3 выявлены С-пептид 0,9±0,03 нг/мл (в контроле 0,01), концентрация эластазы 0,9±0,08 мкг/г (контроль 0,009), уровень амилазы колебался от нормальных значений до 200–300 ЕД, активность моноглицеридлипазы при длительном течении ХП составляла 1920 ЕД, уровень паратгормона – 69,1±11,3 пг/мл, сахара крови – 11,9±0,7 ммоль/л, в копрограмме – жир, непереваренные частицы. Нутриционный статус: у 9% пациентов имели место дизгидрические расстройства (как правило, изоосмотическая гипогидратация), у 7,8% – нормо- или гипоцитемическая нормоволемия, дефицит циркулирующего белка различной степени имел место в 93% случаев, дефицит циркулирующего альбумина – в 82%, дефицит циркулирующего кальция – в 59%, калия – в 12%. Антропометрические параметры: ИМТ колебался в приделах от 15 до 17, ТКЖС составлял 10,1±1,2 мм; состав тела: содержание жира – около 8%, умеренный или тяжелый дефицит тканевого белка; потребности (рассчетно определенные): возрастали до 132–135 г/сут для пластического компонента и до 3000–3200 ккал/сут для энергетического. Иммунокритерии оценки статуса питания: лимфоциты крови 0,9–1,3×109/л, γ-глобулин – менее 8,0±1,3 г/л. Функциональная дисфункция печени характеризовалась следующими данными: альбумин – 28–32 г/л, γ-глутаматтранспептидаза – 103,4–109 ЕД/л, щелочная фосфатаза – 870–930 ммоль/л, билирубин – 20,5–32,5 мкмоль/л (при билиарном панкреатите – до 300), АЛТ – 300–490 ЕД/л, АСТ 380–460 ЕД/л в зависимости от выраженности дисфункции печени); факторы свертываемости при печеночной дисфункции: АЧТВ снижен, МНО повышен. При этом функциональное состояние кишечника также было угнетенным (изменены соотношения короткоцепочечных жирных кислот копрофильтрата, всасывание по биотесту снижалось на 26–30%). Индекс НР составлял 79,8 (крайне высокий).
Как следует из приведенных данных, функциональная активность ПЖ в значительной мере влияла как на другие лимитирующие усвоение нутриентов органы, так и на нутриционный статус в целом: в отсутствие нарушений со стороны ПЖ (ХП типа А и В) нутриционный статус сохранялся на более высоком уровне, НР был минимальным либо средним. При ХП типа С НР был высоким вплоть до крайне высокого.

Как видно из табл. 2, характер осложнений при различных типах ХП был разным. При анализе функциональной сохранности ПЖ, степени нарушений нутриционного статуса и вида осложнений можно отметить, что хотя характер осложнений ХП и не определял специфических нутритивных нарушений, однако в случае калькулеза выявлялись значительные электролитные сдвиги, а при наличии свищей и асцита были более ярко выражены иммуномаркеры нутриционной недостаточности, дискоординация водных разделов. Переваривающая функция кишечника страдала также в большей степени при ХП типа С. Таким образом, критерии НР при различных типах ХП были определены для использования в клинической практике стационара и при диспансерном наблюдении. Диспансерному наблюдению подлежат люди, перенесшие острый панкреатит. Больные после операций на ПЖ наблюдаются так же, как и пациенты с ХП.
По степени НР и функционального резерва ПЖ можно было выделить 3 программы для предоперационной и послеоперационной нутритивной коррекции: для пациентов с низким, средним и высоким НР. При низком НР (как правило, при ХП типа А) предоперационная подготовка с точки зрения нутрициолога может быть минимальной. При ХП типов В и С следует ориентироваться на степень метаболических расстройств и состояние функций ПЖ. Предоперационную подготовку можно прекращать при отсутствующем НР, слабовыраженном и в крайнем случае – при среднем НР (при условии проведения предоперационной подготовки по доведению НР до слабовыраженного). При высоком НР операция не может выполняться (за исключением вмешательств по жизненным показаниям) из-за риска развития хирургических послеоперационных осложнений (несостоятельность швов, гнойно-септические, метаболические осложнения и др.). При сравнении эффективности модифицированной и традиционной программ ведения пациентов оказалось, что длительность реанимационно-реабилитационного раннего периода у больных с высоким и средним НР значительно выше, чем у пациентов с отсутствующим или низким НР.
При предварительной рациональной нутриционной коррекции и нутри-ционных назначениях в послеоперационном периоде, определяемых в соответствии с расчетом НР, длительность пребывания в стационаре в отсутствие хирургических послеоперационных осложнений может быть снижена практически в 1,5 раза. Процент послеоперационных хирургических осложнений после предварительной нутриционной подготовки снижается (несостоятельность швов – на 6%, обострения панкреатита в остаточной культе при резекции ПЖ – на 2,5%), нагноения послеоперационных ран практически отсутствуют. Из анализа примененных технологий также следует, что отказываться от парентерального питания не всегда целесообразно: при достаточной подготовке и удовлетворительном нутритивном статусе (обычно ХП типа А) это возможно.
В других случаях решение принимается для конкретного случая, ориентируясь на сохранность функций ПЖ и НР.
Клинические данные, полученные при сопоставлении двух использованных программ, положительно отражаются и на экономических критериях эффективности.
Фармакоэкономика – новая самостоятельная наука, которая изучает в сравнительном плане соотношение между затратами и эффективностью, безопасностью, качеством жизни при альтернативных схемах лечения (профилактики) заболевания. Комплексный подход к оценке целесообразности применения медицинских технологий предполагает взаимосвзанную оценку последствий (результатов) и стоимости медицинских вмешательств. Наиболее принципиальным в данном определении является именно взаимосвязанная оценка, т.е. речь идет не просто о сравнении затрат, а об оценке соотношения между затратами и полученными результатами. С точки зрения практического врача это означает, что фармакоэкономика – это не поиск наиболее дешевых лекарственных средств и оправдание их использования, а расчет затрат, необходимых для достижения желаемой эффективности, и соотнесение этих затрат с возможностями. При проведении оценки прямых затрат на проведение нутриционной поддержки выделены медицинские и немедицинские затраты. К прямым медицинским отнесены затраты на лекарства (в т.ч. препараты нутриционной поддержки), диагностические услуги, консультации врачей, медицинские манипуляции.

К немедицинским относятся накладные расходы – стоимость койко-дня, лечебное питание, транспортировка пациентов, соцподдержка.
К прямым затратам была отнесена стоимость проведения полного парентерально-энтерального питания, стоимость базовой терапии (в ОРИТ и профильном отделении).
Расчет: больной расходует до 30 ккал энергии с каждого килограмма массы тела в сутки (рекомендации ESPEN). ДРЕ – действительный расход энергии составлял в сутки 34 кг×30=1020 ккал, на весь курс лечения (при нахождении в ОРИТ и хирургическом отделении) необходимо 1020×8=31 620 ккал. Поскольку, по современным критериям, в энергетической квоте должно быть 20% белка, 35% липидов и 55% углеводов, рассчитывали парентеральный компонент. При расчете энтерального компонента за эталон принимали химус (25 г белков, 17 г углеводов и 28 г липидов в сутки).
Стоимость препаратов и непрямых расходов при лечении осложненного ХП на одного пациента приведены в табл. 4. Поскольку наиболее тяжелым контингентом с высоким НР и нарушениями функций ПЖ являются пациенты с ХП типа С, здесь приводится ориентировочный фармакоэкономический анализ схем лечения именно для данного типа патологии.
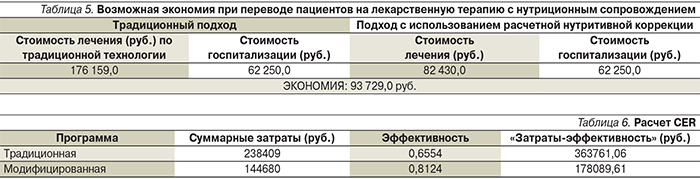
Как видно, по первой программе прямые+непрямые расходы составили 176 159 руб., а по модифицированной программе с предварительной нутриционной подготовкой прямые и непрямые расходы составили 82 430руб. Как видно при сопоставлении традиционной и модифицированной программ, предварительная предоперационная подготовка экономически целесообразна. Введение модифицированных схем метаболической коррекции ведет к снижению расходов на лечение больного осложненным ХП.
Влияние на бюджет
Суть анализа «влияние на бюджет» заключается в оценке финансовых последствий применения новых технологий с учетом ограниченности ресурсов ЛПУ. На основании результатов, представленных в табл. 4, был рассчитан возможный экономический эффект при использовании предложенной нами технологии (консультация нутрициолога, начало предоперационной подготовки амбулаторно, предоперационная коррекция в стационаре до операции – 3–5 дней, послеоперационный период с участием нутрициолога – 5–6 дней).
Расчет осуществлен по формуле:
Ес=cost(х)×100-cost×100,
где Ес – возможная экономия при использовании новой технологии, сost(х) – стоимость лечения одного пациента в течение стационарного периода при традиционном подходе, сost – стоимость лечения пациента по предложенной технологии. Рассчитанный таким образом уровень экономии затрат приведен в табл. 5.
Анализ упущенных возможностей
Этот показатель говорит о том, сколько дополнительно пациентов можно пролечить при переходе на менее затратную схему лечения, и рассчитывается по формуле:
Q=Ес/Сlow×100,
где Q – показатель упущенных возможностей, количество дополнительно пролеченных больных (ЕД), Ес – возможная экономия при замене технологии на более эффективную с фармакологической точки зрения (руб.), Сlow – затраты на лечение по менее затратной технологии (руб.).
Таким образом: 93729,0/144680×100=64,78, т.е. Q=65 ЕД упущенной возможности.
Анализ эффективности
Выбранный критерий эффективно-сти – выживаемость больных, соответствует конечной цели лечения (сохранение жизни пациенту) и оценке койко-дня до наступления снижения НР на 1–2 порядка (по критериям АВД). Оказалось, что выживаемость при традиционной методике соответствовала 0,6554 (11 пациентов из 17), а при модифицированной – 0,8124 (13 из 17). Койко-день в реанимационном и хирургическом отделениях после операции при этом был практически идентичен.
Анализ «затраты–эффективность» (СER)
Данный анализ (отношение суммарных затрат к критерию эффективности) позволяет математически точно определить, насколько затраты на модифицированную технологию соответствуют ее эффективности (табл. 6).
На основе полученных результатов выявлено, что при предварительно установленной степени НР проведение нутриционной подготовки (частично амбулаторной и 2–7-дневной стационарной) даже при высоком и крайне высоком риске как клинически, так и экономически целесообразно: затраты в послеоперационном периоде намного меньше, чем в случае, если не прово-дить достаточную коррекцию нутриционного статуса в дооперационном периоде. Нутриционный статус при этом целесообразно оценивать полно ( с использованием параметров АВД). Выбор программы нутриционной коррекции должен учитывать функциональные секреторные возможности ПЖ, опираться на НР и характер осложнений ХП (что укладывается в классификацию M. Buchler). Сопоставление программ с традиционной и усиленной нутритивной подготовкой позволяет заключить о необходимости нутритивной коррекции при подготовке к вмешательствам на ПЖ до уровня снижения НР на 1–2 порядка. В структуре fast-track-технологии, являющейся многокомпонентной, для профилактики осложнений алиментации следует учитывать постепенность восстановления функций ПЖ и желудочно-кишечного тракта, использовать последовательно парентеральное, электролитное (не менее чем через 2–4 часа после операции), олигомерное (не менее чем через 5–6 часов после вмешательства) питание с постепенным переходом (объем белково-энергетической нагрузки увеличивается нутрициологом по результатам оценки потребностей и функционального резерва как минимум ПЖ, кишечника и печени) на диетическое питание и назначенную гастроэнтерологом и эндокринологом лекарственную терапию. Таким образом, раннее пероральное питание (в отсутствие необходимости в парентеральной коррекции) может рассматриваться как метод выбора после лапароскопических операций на ПЖ по поводу ХП.
Однако переход на него должен быть быстрым (в идеале – в течение недели), но последовательным (постепенность перехода с водно-электролитных на олигомерные составы и только затем на сбалансированный сипинг-питание и диету), согласовываться с физиологическими возможностями органов, лимитирующих усвоение (в частности, как минимум с секреторной активностью ПЖ), в каждом конкретном случае.


