Введение
Ренин-ангиотензин-альдостеро-новая система (РААС) представляет собой ключевой патофизиологический фактор поражения сердечно-сосудистой системы в кардиоваскулярном континиууме [1, 2]. Фармакотерапевтические подходы лечения сердечно-сосудистых заболеваний основаны на использовании препаратов разных классов, блокирующих активность РААС. К их числу относятся β-адреноблокаторы (БАБ), ингибиторы ангиотензинпревращающего фермента (ИАПФ), блокаторы рецепторов ангиотензина II (АТII; АРА), антагонисты альдостерона, прямые ингибиторы ренина.
В настоящее время наиболее широкое клиническое применение имеют два класса препаратов, блокирующих РААС, – ИАПФ и АРА. Целью их воздействия является устранение главных эффектов АТII – вазоконтрикторных и пролиферативных, приводящих к неблагоприятным гемодинамическим и структурно-функциональным изменениям (ремоделированию) в органах-мишенях. Вместе с тем с учетом механизмов действия ИАПФ и АРА не всегда удается блокировать высокую активность РААС, что может быть причиной их недостаточной эффективности.
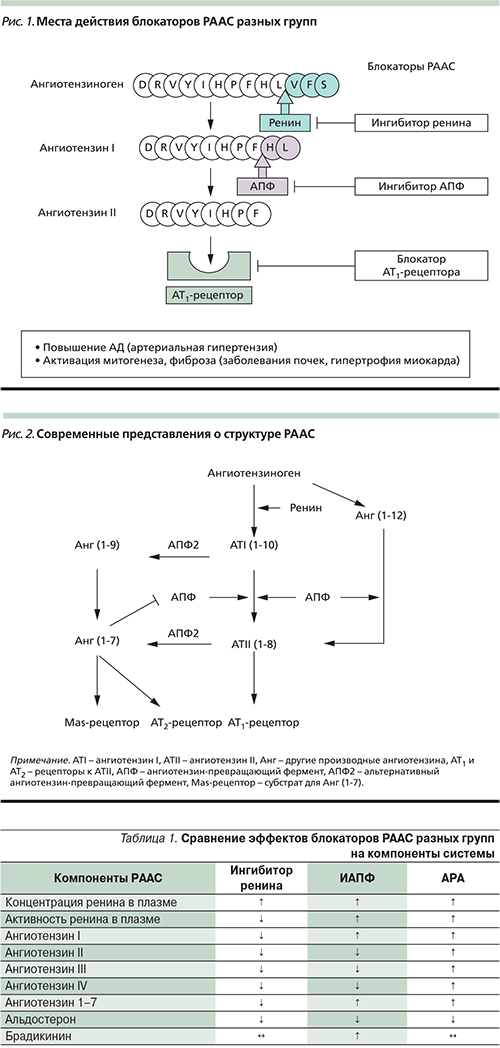
Известно, что ИАПФ и АРА по механизму обратной связи повышают активность ренина, что является причиной ускользания эффективности блокаторов РААС. Ренин представляет собой фермент первого этапа преобразования ангиотензиногена в АТII (рис. 1), а также участвует в механизме обратной связи. Поэтому ингибирование ренина позволяет обеспечить более полную блокаду РААС [3]. Поиск ингибиторов ренина ведется с 1970-х гг.; в 2002 г. FDA одобрила первый пероральный прямой ингибитор ренина алискирен.
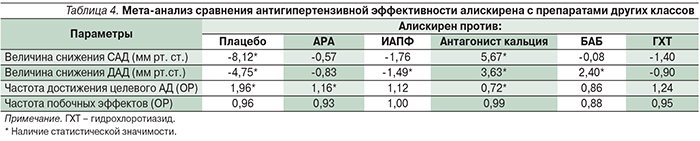
Алискирен имеет избирательную тропность к ренину плазмы: он связывает каталитический центр активности ренина, не снижает его концентрации в плазме, но уменьшает его активность. В результате образование АТII снижается на 80%, падает уровень и других форм АТ, которые также имеют определенную биологическую активность (табл. 1) [4, 5].
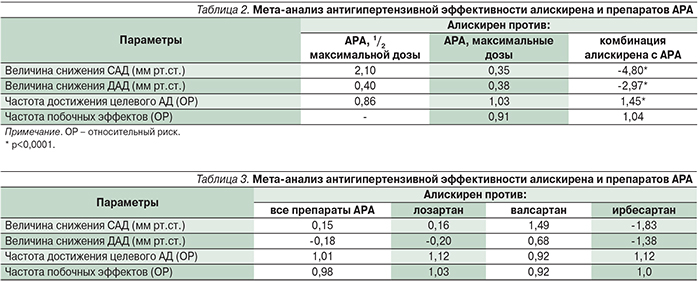
Так, в последние годы большое внимание уделяется изучению роли этих веществ в регуляции сосудистых и пролиферативных эффектов, связанных с РААС. Были открыты альтернативные нерениновые пути образования АТI и АТII через тканевую форму ангиотензина 1–12 и альтернативная АПФ2 (АТ1-7) MAS-система, выступающая в качестве противовеса уровню АТII (рис. 2) [5]. АПФ2 выполняет функцию, противоположную таковой АПФ: участвует в альтернативном пути деградации АТII в АТ1-7 и в меньшей степени – АТI в АТ1-9. Показано, что АПФ2 играет доминирующую роль в регуляции уровня АТII в тканях (сердце, почках, легких, желудочно-кишечном тракте); он не повергается действию ИАПФ. Активности АПФ и АПФ2 определяют баланс между прессорно-пролиферативными и депрессорно-антипролиферативными компонентами системы, что контролирует кардиоваскулярный гомеостаз. АТ1-7 взаимодействует с собственными рецепторами – АТ3 и MAS, а также с АТ2-рецепторами, опосредуя вазодилатацию и антипролиферацию. Подчеркивается, что баланс АТ1-7/АТII важен для поддержания кардиоваскулярного гомеостаза [6]. Алискирен, блокирующий активность ренина, снижает уровни АТI и АТII в плазме, но не влияет на альтернативный (нерениновый) путь образования пептидов в тканях, в результате может нарушаться баланс АТ1-7/АТII за счет снижения уровня АТ1-7 [7].
Кроме того, ренин может взаимодействовать с открытыми ранее прорениновыми рецепторами и осуществлять независимое влияние в отношении down-регуляции ключевых пептидов системы РААС. Алискирен оказывает влияние на экспрессию гена прорениновых рецепторов в почках (но не в миокарде и сосудистой стенке), что объясняет дополнительный независимый механизм развития благоприятных эффектов препарата при заболеваниях почек [5, 7].
Антигипертензивная эффективность
По данным объединенного анализа 7 многоцентровых плацебо-контролируемых клинических исследований (КИ), у 7045 пациентов с артериальной гипертензией (АГ) 1–2-й степени алискирен в дозе 150 мг/сут приводил к снижению систолического артериального давления (САД) на 8,7–13,0 мм рт.ст. и диастолического АД (ДАД) на 7,8–10,3 мм рт.ст., а в дозе 300 мг/сут – на 14,1–15,8 и 10,3–12,3 мм рт.ст. соответственно [8].
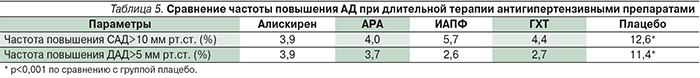
За последние годы было проведено большое число сравнительных КИ по изучению антигипертензивной эффективности алискирена, результаты которых представлены в ряде систематических обзоров и мета-анализов. В первую очередь сравнивались эффекты алискирена и АРА как в монотерапии, так и в комбинациях. В мета-анализ Z. Zheng и соавт. было включено 7 КИ (n=5488) продолжительностью 4–8 недель, в которых алискирен назначался в дозах 150–300 мг/сут, препараты АРА (лозартан, валсартан, ирбесартан) – в половинных и максимальных дозах [9]. Оценивали степень снижения САД и ДАД, частоту достижения целевого АД, а также переносимость терапии по частоте развития побочных эффектов (табл. 2). Достоверных различий в выраженности антигипертензивного эффекта между алискиреном и препаратами АРА не было выявлено; не отмечено и различий по уровню контроля АД у больных АГ. В то же время комбинация алискирена с АРА вызывала достоверно более выраженное снижение АД и почти в полтора раза повышала частоту достижения целевого уровня АД. Изучение переносимости не показало значимых различий между препаратами как по всем случаям побочных эффектов, отдельным реакциям, так и по частоте отмены из-за побочных эффектов. Вместе с тем наблюдалось статистически значимое повышение частоты случаев слабости и гиперкалиемии на фоне комбинации алискирена и АРА.
Опубликованы результаты мета-анализа D. Gao и соавт., объединившего 10 сравнительных КИ (n=3732) алискирена с препаратами АРА (лозартан, валсартан, ирбесартан) продолжительностью 4–12 недель; препараты применялись в эквивалентных терапевтических дозах в режиме монотерапии [10]. Не было получено достоверных различий в степени снижения АД между алискиреном и препаратами АРА как при офисном измерении АД (табл. 3), так и при амбулаторном мониторировании АД. Сопоставимыми при монотерапии алискиреном и АРА оказались и показатели частоты достижения целевого уровня АД, причем не было выявлено преимуществ алискирина ни перед каким-либо препаратом класса АРА (ОР около 1,0). Переносимость препаратов также не различалась.
Эффективность алискирена сравнивалась и с другими антигипертензивными препаратами. Так, в мета-анализе Y. Chen и соавт. (14 КИ, n=6741) алискирен сравнивался с АРА (лозартан, валсартан, ирбесартан), ИАПФ (рамиприл, лизиноприл), антагонистом кальция (амлодипин), БАБ (атенолол) и диуретиком (гидрохлоротиазид), а также с плацебо [11]. По антигипертензивной эффективности алискирен оказался сопоставимым с АРА, как и в предшествующих мета-анализах, и гидрохлоротиазидом, превосходил ИАПФ и БАБ, но уступал антагонисту кальция амлодипину (табл. 4).
Проблема сравнения антигипертензивной эффективности алискирена с другими препаратами возникла ввиду сообщений о парадоксальном повышении уровня АД при длительной терапии (ускользание эффекта), что, возможно, связано с реактивным повышением концентрации ренина в плазме крови [12]. Для изучения этого вопроса A.V. Stanton и соавт. провели специальный мета-анализ 8 плацебо-контролируемых КИ (n=4877), в которых применялись алискирен, препараты АРА (лозартан, валсартан, ирбесартан), ИАПФ (рамиприл) или гидрохлоротиазид в терапевтически эквивалентных дозах и оценивалась частота повышения АД (по критериям САД>10 и ДАД>5 мм рт.ст.) на фоне монотерапии через 4–12 недель [13]. Частота случаев парадоксального повышения САД и ДАД на фоне применения алискирена статистически не превышала таковую при применении других классов антигипертензивных препаратов, которые могут активировать ренин плазмы при длительном использовании, и была достоверно меньшей по сравнению с группой плацебо (табл. 5). Причем ни у одного из 536 больных, полчавших алискирен в дозе 300 мг/сут, повышение АД не ассоциировалось с увеличением активности ренина плазмы на 0,1 нг/млхч.
Таким образом, алискирен демонстрирует высокую клиническую эффективности в лечении больных АГ 1–2-й степеней, имея хорошую переносимость и сходную частоту побочных эффектов с другими антигипертензивными препаратами.
Органопротективные и отдаленные клинические эффекты
Изучение более широких возможностей применения алискирена в лечении сердечно-сосудистых заболеваний запланировано в крупномасштабной исследовательской программе ASPIRE HIGHER, состоящей из 14 КИ с включением 35 тыс. пациентов (табл. 6) [14].
В ряде КИ были показаны органопротективные эффекты препарата: регресс ГЛЖ у пациентов с АГ (ALLAY) [15], антипротеинурический эффект у пациентов с АГ и диабетической нефропатией (AVOID) [16].
Так, в исследовании ALLAY у пациентов с АГ и ГЛЖ (толщина задней стенки ЛЖ более 1,3 см по данным ЭХО-КГ) применение алискирена ассоциировалось со сходной степенью регресса индекса ММЛЖ по сравнению с лозартаном и комбинацией алискирена с лозартаном: на 5,7±10,6, 5,4±10,8 и 7,9±9,6 г/м2 соответственно [15]. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект на альдостерон отсутствовал, а на активность ренина был противоположным.
В исследовании AVOID больных АГ и СД с протеинурией после 3-месячного лечения лозартаном в дозе 100 мг/сут и достижения целевого уровня АД (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин – 8%) рандомизировали к приему алискирена в дозах 150 –300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 месяца и на 20% через 6 месяцев по сравнению с группой плацебо (p<0,001) на фоне сопоставимого снижения уровня АД; доля пациентов со снижением индекса альбумин/креатинин в моче на 50% и более была вдвое большей по сравнению с плацебо (24,7 против 12,5%; р<0,0005) [16]. Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений нефропротективного эффекта алискирена авторы cчитают полученные ранее на моделях СД экспериментальные данные о способности препарата уменьшать количество рениновых и прорениновых рецепторов в почках, а также ослаблять профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект по сравнению с ИАПФ [17].
В исследовании ALOFT у пожилых пациентов с ХСН и АГ алискирен в дозе 150 мг добавляли к стандартной терапии (ИАПФ или АРА, БАБ) [19]. В качестве первичной конечной точки оценивали переносимость и безопасность применения алискирена при ХСН: не было выявлено различий в частоте случаев ухудшения функции почек, гиперкалиемии и гипотонии в группе альскирена по сравнению со стандартной терапией. Добавление алискирена к стандартной терапии сопровождалось достоверным снижением уровней BNP, NT-proBNP и альдостерона в моче. Именно такая динамика BNP и NT-proBNP ассоциируется с улучшением долгосрочного прогноза у больных ХСН.
В исследовании AVANT-GARDE изучалась динамика NT-proBNP через 8 недель (первичная конечная точка) у пациентов с ОКС и сохраненной ФВ на фоне добавления алискирена к стандартной терапии [20]. Снижение уровня NT-proBNP составило 42, 44, 39 и 36% в группах плацебо, алискирена, валсартана и комбинации алискирен+валсартан соответственно. При исследовании динамики уровня альдостерона отмечено его увеличение в указанных группах на 19,7, 10%, 9,9 и 9,3% соответственно; степень увеличения уровня альдостерона была достоверно меньшей на фоне применения блокаторов РААС. Различий по частоте клинических исходов между группами не было. Вместе с тем была выявлена большая частота серьезных побочных эффектов (гипотония, гиперкалиемия) во всех группах по сравнению с плацебо.
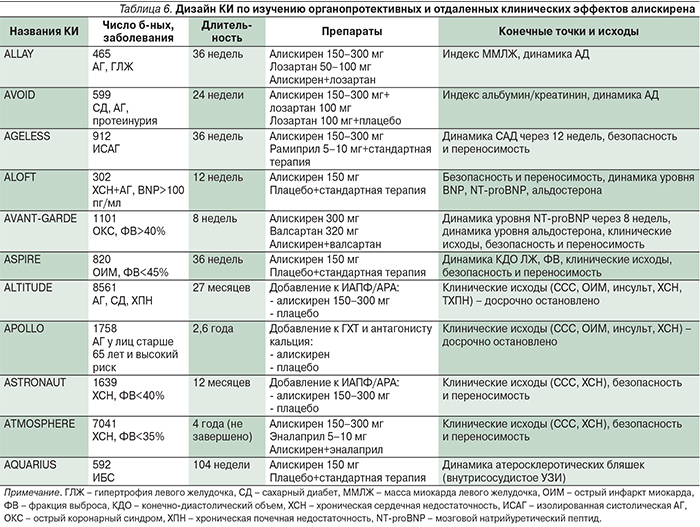
В исследовании ASPIRE на 820 пациентах с ОИМ изучалась эффективность алискирена в плане предупреждении постинфарктного ремоделирования [21]. Не было выявлено дополнительного эффекта снижения КДО ЛЖ (первичная конечная точка) после добавления к стандартной терапии алискирена (-4,4 против -3,5 мл в группе плацебо), а также в отношении динамики ФВ и клинических исходов. При этом при применении алискирена была отмечена достоверно большая частота побочных эффектов, особенно случаев гипотонии, дисфункции почек и гиперкалиемии.
В 4 специально спланированных крупных КИ проводилось изучение отдаленных клинических эффектов алискирена: у пациентов с АГ и высоким риском сердечно-сосудистых осложнений (APOLLO, ALTITUDE) и пациентов с ХСН (ASTRONAUT, ATMOSPHERE). Результаты трех завершенных КИ не выявили преимуществ препарата в комбинации со стандартной терапией (включая сочетание с ИАПФ/АРА) в предупреждении ССС, ОИМ, инсульта, прогрессирования ХСН, но продемонстрировали худшие данные в отношении безопасности [14]. Результаты последнего КИ ATMOSPHERE еще не опубликованы. Полученные результаты могут объясняться особенностями проксимальной блокады РААС, вследствие которой происходит уменьшение образования не только АТII и АТIII, оказывающих неблагоприятное влияние на сердечно-сосудистый гомеостаз, но и АТ1-7, способствующего поддержанию в нем баланса.
В исследовании AQUARIUS изучалась возможность влияния алискирена на прогресиирование коронарного атеросклероза у 592 пациентов с ИБС [22]. Динамика изменения объема атером (первичная конечная точка) как в процентном отношении, так и по абсолютной величине между группами алискирена и плацебо статистически не различалась (-0,33 против 0,11% и -4,1 против -2,1 мм3 соответственно); не было достоверных различий и по доле пациентов с регрессом атером (64,4 против 57,5% соответственно). Вместе с тем в группе алискирена отмечалась меньшая частота основных неблагоприятных клинических исходов: частота первого кардиоваскулярного исхода наблюдалась в 2 раза реже, чем в контрольной группе (ОР=0,50; р=0,004); статистически реже наблюдались и случаи ОИМ (ОР=0,13; р=0,02). Поэтому возможность протективного влияния алискирена на атеросклеротический процесс требует дальнейшего изучения.
Безопасность и побочные эффекты
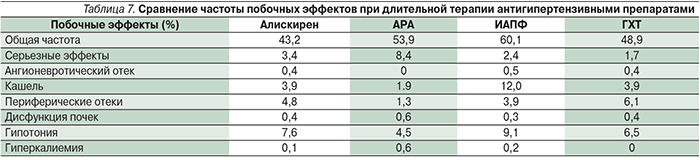
Применение алискирена в монотерапии у больных АГ по результатам мета-анализов КИ хорошо переносится, и его безопасность сопоставима с плацебо [9–11]. Эти данные нашли подтверждение в специально выполненном мета-анализе W.B. White и соавт. (12 КИ, n=12 188), в котором сравнивали частоту развития побочных эффектов при использовании алискирена и атигипертензивных препаратов других групп пациентами с АГ [23]. Общая частота побочных эффектов и частота развития и серьезных побочных эффектов алискирена в длительных КИ не отличались достоверно от таковых препаратов других групп (табл. 7).
Однако комбинация алискирена с другими блокаторами РААС, как и комбинация двух блокаторов РААС (ИАПФ и АРА), особенно для пациентов с сопутствующими нарушениями функции почек, может сопровождаться повышением риска серьезных побочных эффектов: дисфункции почек, гиперкалиемии, гипотонии.
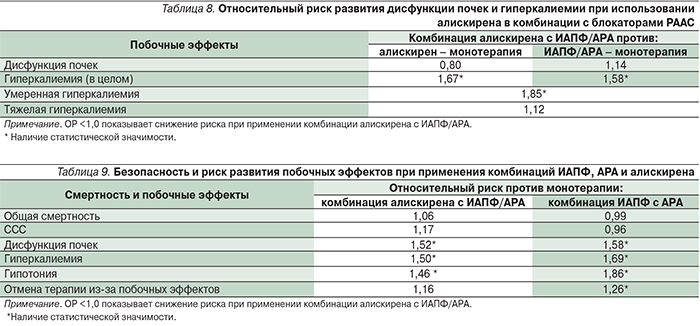
В мета-анализе Z. Harel и соавт. (10 КИ, n=4814) получены обобщенные данные по частоте побочных эффектов комбинированной терапии алискиреном и ИАПФ/АРА по сравнению с монотерапией алискиреном или ИАПФ/АРА [24]. Риск развития дисфункции почек (сывороточный креатинин >176,8 ммоль/л) при использовании комбинации алискирена с ИАПФ/АРА по сравнению с монотерапией алискиреном не увеличивался, но по сравнению с монотерапией ИАПФ/АРА возрастал на 17%, хотя статистической значимости различий достигнуто не было (табл. 8). Риск гиперкалиемии (>5,5 ммоль/л) был достоверно выше при использовании комбинации алискирена с ИАПФ/АРА по сравнению с монотерапией любым блокатором РААС, причем преимущественно за счет случаев умеренной гиперкалиемии (5,55,9 ммоль/л).
В другом мета-анализе проводилась общая оценка безопасности и риска развития побочных эффектов при использовании комбинации алискирена с ИАПФ/АРА или комбинации ИАПФ с АРА по сравнению с монотерапией блокаторами РААС по результатам 50 КИ [25]. Так, риск общей смертности и ССС при использовании комбинации препаратов, блокирующих РААС, не увеличивался; вместе с тем риск развития дисфункции почек, гиперкалиемии и гипотонии достоверно возрастал более чем на 50% вне зависимости от включения в комбинации алискирена (табл. 9).
Таким образом, применение комбинации препаратов, блокирующих РААС, сопровождается серьезными нежелательными эффектами на функцию почек и резким усилением риска гипотензии, что требует безусловной осторожности для обеспечения безопасности.
Заключение
Алисикрен является еще одним препаратом, блокирующим РААС, и представляет собой эффективное антигипертензивное средство, сопоставимое по эффективности и безопасности с препаратами других классов. Доказательная база в отношении действия алискирена за последние годы существенно дополнилась результатами массы большого числа крупных КИ. В них показано, что при монотерапии алисикрен обеспечивает выраженный антигипертензивный эффект и хорошо переносится пациентами с АГ разных возрастных групп; может комбинироваться с другими антигипертензивными препаратами (диуретиками, антагонистами кальция), кроме ИАПФ/АРА. В крупных исследованиях показаны органопротективные эффекты алискирена – регресс ГЛЖ у пациентов с АГ и протеинурии у больных АГ и диабетической нефропатией. Изучение отдаленной эффективности алискирена для пациентов с АГ не выявило ухудшения прогноза (сердечно-сосудистой и общей смертности). Вместе с тем исследование возможностей применения алискирена при других сердечно-сосудистых заболеваниях (ХСН, ОКС, ОИМ, ИБС) не выявило особых клинических преимуществ препарата.


