В1898 г. два профессора стокгольмского Каролинского университета, Robert Tigerstedt и его ученик Per Gunnan Bergman, выделили из почек вещество, которое они назвали ренин, что послужило началом нового периода в истории физиологии. Это открытие привело к пониманию многих механизмов регуляции артериального давления (АД), процессов компенсации и декомпенсации в сердечно-сосудистой системе. После открытия в 1965 г. S. Perreira ингибирующего фактора в составе яда южноамериканской змеи Bothrops jararaca истории разработки ингибиторов ангиотензинпревращающего фермента (ИАПФ) и блокаторов рецепторов 1-го типа к ангиотензину (БРА) шли параллельными путями [1]. Первым был получен препарат класса БРА – саралазин, однако непредсказуемость его эффектов при клиническом применении притормозила процесс изучения БРА (сартанов), поэтому первыми нашли свое место в практической кардиологии ИАПФ. В 1971 г. был синтезирован первый ИАПФ – тепротид.
В 1975 г. в лабораториях компании Squibb появился первый ИАПФ перорального приема – каптоприл.
В 1978 г. в журнале New England Journal of Medicine опубликована первая работа по применению каптоприла больными артериальной гипертензией – АГ [2]. Создание и активное клиническое применение новых классов лекарственных препаратов в последней четверти ХХ в. позволили изменить течение и прогноз тяжелейших заболеваний сердечно-сосудистой системы.
Известно, что активация ренин-ангиотензин-альдостероновой системы (РААС) играет ключевую роль в патогенезе сердечной недостаточности и многих других сердечно-сосудистых заболеваний [3]. Помимо этого долгосрочные эффекты повышенной продукции ренина, ангиотензина II (АII) и симпатического гипертонуса включают развитие дислипидемии, нарушений сердечного ритма, гиперкоагуляции, эндотелиальной дисфункции, инсулинорезистентности, увеличения массы тела.
Для эффективного противодействия негативным влияниям РААС существует несколько классов антигипертензивных средств: β-адреноблокаторы (БАБ), ИАПФ, БРА и антагонисты альдостерона. Совсем недавно был синтезирован первый прямой ингибитор ренина – алискирен.
Устранить все негативные эффекты AII в настоящий момент можно двумя способами – снижением активности АПФ и блокадой рецепторов 1-го типа к AII без нарушения синтеза АПФ. Первая цель достигается применением ИАПФ, которые почти за 30 лет изучения и успешного клинического применения стали “золотым” стандартом лечения хронической сердечной недостаточность (ХСН), препаратом первого ряда в лечении АГ, в т. ч. и симптоматической, заболеваний почек и сахарного диабета – СД [4–6]. Вторая задача успешно решается с помощью БРА. История применения сартанов более сложная: препараты находятся в тени своих более изученных “коллег” – ИАПФ [1]. И каждый раз возникает неизбежный вопрос: что лучше применять в конкретной клинической ситуации – ИАПФ или БРА II (сартаны)? В связи с этим особо показательны попытки сравнения этих двух самых мощных по влиянию на РААС классов препаратов.
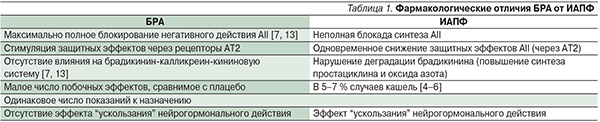
Каждая группа препаратов имеет свои плюсы и минусы (табл. 1). Уникальность ИАПФ – в обеспечении двойного терапевтического эффекта: ослабляют агрессивное воздействие AII (прессорное звено) и усиливают защитное действие брадикинина (депрессорное звено). Однако именно брадикининовый механизм действия ИАПФ, играющий важную роль в ремоделировании сердца и сосудов, лежит в основе возникновения кашля (5–7 % пациентов, длительно получающих ИАПФ), что иногда является причиной вынужденного прекращения лечения [4–6].
Главные отличительные черты БРА – высокая безопасность и малое число побочных эффектов, сравнимое с плацебо, из-за отсутствия влияния на распад брадикинина. Отсутствие кашля и ничтожно малое количество аллергических реакций являются безусловным преимуществом сартанов по сравнению с ИАПФ [7–12].
Казалось, что еще может скомпрометировать доброе, проверенное временем имя ИАПФ? Им оказался пресловутый “эффект ускользания” действия ИАПФ, а значит, снижение их эффективности с течением времени. Действительно, в норме около 75 % АII образуются при помощи химаз и некоторых других ферментов. При кратковременной терапии ИАПФ блокирует АПФ-зависимый путь образования AII и, следовательно, его эффекты, направленные на вазоконстрикцию, патологическое ремоделирование органов и синтез альдостерона [8–12]. Вместе с тем при длительном применении ИАПФ (месяцы и годы) постепенно начинает активироваться не-АПФ-зависимый путь синтеза AII c частичным восстановлением его эффектов. Указанный механизм может приводить к “ускользанию” части нейрогуморальных эффектов ИАПФ при длительном лечении больных сердечно-сосудистыми заболеваниями. При продолжительной терапии ИАПФ не способны стабильно контролировать концентрацию альдостерона, вызывающего развитие фиброза в миокарде и сосудах, что лежит в основе их ремоделирования. Этот эффект получил название феномена выскальзывания блокады альдостерона ИАПФ [5, 6].
Но, несмотря на это, на протяжении долгого времени ИАПФ владели “пальмой первенства”, найдя признание и популярность среди врачей. История популярности началась в 1987 г.,
когда в Скандинавии было проведено исследование CONSENSUS. В нем впервые больным тяжелой ХСН был назначен ИАПФ эналаприл, который снизил по сравнению с плацебо риск смерти больных через 6 и 12 месяцев [14]. С этого момента ИАПФ стали считаться препаратами, способными улучшить выживаемость больных ХСН.
Тем не менее после более чем 20-летнего затишья в отечественных и зарубежных изданиях вновь возрос интерес к применению сартанов, обладающих длительным эффектом, применяемых перорально и имеющих фармакологические отличия от ИАПФ. Вторым после саралазина в группе сартанов появился лозартан, синтезированный лишь в 1995 г. С его открытием начался новый эпизод в поединке двух лидеров терапии сердечно-сосудистых заболеваний. Уже через 4 года после регистрации лозартана БРА заняли прочные позиции во всех национальных и международных консенсусах по лечению АГ, а в 2005 г. были включены в рекомендации по лечению ХСН. Различные представители этого класса препаратов имеют свои особенности – фармакокинетические (биодоступность, распределение, период полувыведения) и фармакодинамические (сродство к ангиотензиновым рецепторам 1-го и 2-го типов, обратимость и конкурентность их связывания), а некоторые обладают дополнительными свойствами: агонизмом к PPAR-γ (peroxisome proliferator-activated receptor γ) – рецепторам, ответственным за чувствительность периферических тканей к инсулину, урикозурическим эффектом или способностью угнетать симпатическую нервную систему. В ряде клинических исследований были выявлены дополнительные органопротективные эффекты сартанов – это кардио- (LIFE, JIKEI-HEART), нефро- (IRMA II, IDNT, MARVAL, RENAAL, DROP), нейропротекции (MOSES, LIFE), улучшение гликемического профиля (LIFE, VALUE, NAVIGATOR) [15–24].
В национальных рекомендациях по диагностике и лечению АГ Всероссийского научного общества кардиологов (2010) отмечены ситуации, в которых применение сартанов и ИАПФ особенно целесообразно [25] (табл. 2).
При прямом сравнении БРА с ИАПФ получена схожая способность контролировать АД при лучшей переносимости сартанов пациентами с симптомной ХСН (ELITE II) и ИМ (OPTIMAAL, VALIANT) [26–28]. Однако сартаны оказались оптимальным решением для пациентов с непереносимостью ИАПФ и ХСН в исследованиях Val-HeFT и CHARM-Alternative [29, 30]. В нескольких крупных мета-анализах, посвященных сравнению эффективности и безопасности сартанов и ИАПФ для пациентов с АГ, ИБС, протеинурией, не было получено ни одного вразумительного ответа на вопросы классовых преимуществ БРА или ИАПФ [31–33]. Согласно результатам одного из мета-анализов, прямое сравнение эффективности двух классов препаратов на пациентов с АГ не выявило разницы между показателями смертности, сердечно-сосудистых событий, признаков прогрессирования СД, а также функции левого желудочка или функции почек. Однако частота случаев возникновения кашля была выше в группе применения ИАПФ [32].
В другом мета-анализе с включением 49 рандомизированных исследований с участием пациентов с микроальбуминурией или протеинурией, вызванных СД и другими заболеваниями, ИАПФ и БРА в равной степени способствовали уменьшению уровня протеинурии. При сравнимом гипотензивном эффекте, влиянии на выраженность протеинурии, а также снижении риска общей смертности, сердечно-сосудистой смертности, риска развития сердечно-сосудистых событий ИАПФ уступали БРА по частоте возникновения нежелательных явлений, среди которых преобладал кашель. Применение комбинации ИАПФ и сартанов повышало частоту случаев развития гипотензии и ухудшения функции почек [33].
Р. Verdecchia [34] и соавт. в Европейском кардиологическом журнале анализируют различия влияния обеих стратегий на системный уровень АД. Было выявлено, что сартаны достоверно слабее (на 9 %) снижали АД в 1-й линии монотерапии против ИАПФ (3–14 %) [34]. Однако следует отметить, что в 2000–2005 гг. доказательная база сартанов только набирала силу и в первых исследованиях дозы сартанов были более низкими по сравнению с уже исследованными высокими дозами ИАПФ.
Напротив, у ИАПФ накапливались отрицательные результаты по профилактике острого ИМ в исследованиях QUIET и PEACE, повышению смертности после острого ИМ на фоне применения эналаприла в исследовании CONSENSUS II [35–37].
В последнем мета-анализе M. Law и J. Morris (2009) при сравнительном анализе интенсивности снижения АД среднетерапевтических доз препаратов основных антигипертензивных групп достоверных различий выявлено не было. Наиболее важным результатом данного анализа было то, что у больных АГ при применении сартанов против других антигипертензивных средств, включая ИАПФ, не было получено менее эффективного влияния на профилактику сердечно-сосудистых осложнений у больных ИБС и АГ [38]. Таким образом, можно утверждать, что после проведенных мета-анализов разными коллективами исследователей специалисты приходят к единому мнению: сартаны, так же как и ИАПФ, влияют на прогноз больных ИБС и/или АГ в плане профилактики острого ИМ.
Одним из ярких примеров отсутствия преимуществ одной из групп препаратов является исследование ONTARGET (Ongoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial), спланированное специально для окончательного прояснения ситуации с соперничеством БРА и ИАПФ. Одна из задач ONTARGET состояла в оценке дополнительных преимуществ совместного назначения БРА телмисартана в дозе 80 мг/сут и ИАПФ рамиприла в дозе 10 мг/сут по сравнению с монотерапией рамиприлом или телмисартаном в отношении снижения сердечно-сосудистой смертности, риска развития ИМ, мозгового инсульта и госпитализации по поводу СН у пациентов высокого риска. Кроме того, в цели исследования входило подтверждение следующей гипотезы: телмисартан в дозе 80 мг/сут так же эффективен в плане влияния на прогноз, как и рамиприл в дозе 10 мг/сут [39].
По влиянию на АД телмисартан оказался несколько эффективнее, чем рамиприл. Исходя из предпосылки, будто выраженность органопротективных эффектов антигипертензивных средств в основном зависит от степени снижения АД, естественно было бы ожидать столь же значительных различий между исследуемыми стратегиями блокады РААС по влиянию на конечные точки, однако таких различий в ONTARGET получено не было. Кривые кумулятивного риска наступления первичных исходов (сердечно-сосудистой смерти, ИМ, мозгового инсульта и госпитализации по поводу СН) за все четыре года наблюдения для телмисартана и рамиприла выстроились почти параллельно, так же как и кривые для рамиприла и комбинированной терапии. При дополнительном анализе с учетом первичной конечной точки (сердечно-сосудистая смерть, ИМ, инсульт) были получены схожие результаты [39].
Схожие результаты были получены и в исследовании VALIANT (Valsartan in Acute Myocardial Infarction Trial), целью которого стало сравнение способности ИАПФ и сартанов предотвращать повторные сердечно-сосудистые события. Члены группы, проводившей исследование VALIANT, выполнили ретроспективный анализ вторичных конечных точек, включивших сердечно-сосудистую смертность и ее сочетание с нефатальными сердечно-сосудистыми событиями: ИМ, госпитализациями в связи со стенокардией, инсультом, процедурами реваскуляризации. В исследование были включены 14 703 пациента, которые между 12 часами и 10 сутками от начала ИМ при наличии систолической дисфункции левого желудочка и/или признаков СН (кроме шока, гипотензии и клинической нестабильности) были рандомизированы на получение каптоприла, валсартана или их комбинаций. Число установленных фатальных и нефатальных ИМ за последующее наблюдение в группах оказалось сопоставимым: для первого события – 559, 587 и 554 случая (р = 0,651), для суммы событий – 798, 796 и 756 случаев (р = 0,965) соответственно в группах ИАПФ, БРА и их комбинации. Схожая картина получена при анализе частоты реваскуляризаций, инсультов, госпитализаций по поводу стенокардии, а также сочетания сердечно-сосудистой смерти с этими сосудистыми собы-тиями [28].
 Эндотелиальной дисфункции придается исключительная роль в становлении и прогрессировании сердечно-сосудистых заболеваний. Выраженная дисфункция эндотелия при АГ и ХСН обусловлена гиперактивацией РААС. Следовательно, фармакологическая блокада рецепторов 1-го типа к АII может сопровождаться коррекцией нарушений функции эндотелиоцитов, что в свою очередь должно обусловливать дальнейшее снижение риска сердечно-сосудистых осложнений.
Эндотелиальной дисфункции придается исключительная роль в становлении и прогрессировании сердечно-сосудистых заболеваний. Выраженная дисфункция эндотелия при АГ и ХСН обусловлена гиперактивацией РААС. Следовательно, фармакологическая блокада рецепторов 1-го типа к АII может сопровождаться коррекцией нарушений функции эндотелиоцитов, что в свою очередь должно обусловливать дальнейшее снижение риска сердечно-сосудистых осложнений.
В сравнительном исследовании, посвященном оценке влияния ИАПФ рамиприла (n = 99) и БРА ирбесартана (n = 25) на эндотелиальную функцию пациентов с СД 2 типа и атеросклерозом, преимуществ какого-либо из классов препаратов выявлено не было. В группе ИАПФ через три месяца терапии показатели эндотелийзависимой вазодилатации плечевой артерии изменились с начального (3,55 ± 2,8) до 05,62 ± 4,18, тогда как показатели эндотелийнезависимой дилатации – с начального (12,62 ± 7,48) до 12,8 ± 7,04; p = 0,835. В группе БРА изменения показателей функции эндотелия носили следующий характер: показатели эндотелийзависимой дилатации повысились с 4,42 ± 2,95 в начале терапии до 6,28 ± 3,26; p = 0,039, а показатели эндотелийнезависимой дилатации снизились с 10,69 ± 5,85 до 9,54 ± 4,78; p = 0,229, однако эти изменения статистически недостоверны [40].
Таким образом, можно сделать такой вывод: ИАПФ и БРА оказывают практически одинаковое влияние на функцию эндотелия пациентов с СД 2 типа и атеросклерозом. Однако в данном и в ряде других исследований не проводилась оценка маркеров дисфункции эндотелия, таких как эндотелин-1, оксид азота, асимметричный диметиларгинин и др. Определение данных маркеров у пациентов с сердечно-сосудистыми заболеваниями позволит сделать новые выводы о влиянии фармакотерапии ИАПФ и БРА на функцию эндотелия лиц с сердечно-сосудистой патологией.
За период времени, прошедший с момента издания последней версии Европейских рекомендаций по лечению и диагностике АГ, показания к назначению БРА значительно расширились. К ранее имевшимся показаниям (АГ, нефропатия при СД 2 типа, диабетическая микроальбуминурия, гипертрофия левого желудочка и непереносимость ИАПФ) добавились такие заболевания, как ХСН, перенесенный ИМ, фибрилляция предсердий, метаболический синдром и СД. Поэтому сложившиеся ранее представления врачей о сартанах как о препаратах, назначаемых лишь при непереносимости ИАПФ, уходят в историю. Сдадут ли свои позиции ИАПФ или, наоборот, докажут свои неоспоримые преимущества перед БРА, покажут практика и новые специально спланированные рандомизированные клинические исследования.


