Введение
Несмотря на колоссальный прогресс в терапии хронического гепатита С (ХГС) за последние десятилетия, актуальность данной проблемы не снижается. Стабильно высокий уровень заболеваемости, отсутствие вакцины, верификация заболевания на поздних стадиях, формирование гепатоцеллюлярной карциномы (ГЦК), необходимость в трансплантации печени влекут за собой существенные экономические затраты государства на диагностику и лечение основного заболевания и его осложнений [1, 2]. Кроме того, выраженный фиброз снижает шансы пациента на вероятность перенести противовирусную терапию (ПВТ) без развития серьезных осложнений, декомпенсации цирроза печени и в конечном счете – излечение от гепатита С.
В настоящее время в России для лечения хронической HCV-(hepatitis C virus)-инфекции 1-го генотипа доступны различные схемы. К вариантам, содержащим интерферон (ИФН), относится тройная комбинированная терапия пегилированным интерфероном α и рибавирином (ПЕГ-ИФН-α+РБВ) с применением ингибиторов протеазы (ИП) 1-го поколения (боцепревир или телапревир) и ИП 2-го поколения – симепревир. Внедрение в практику схем с препаратами прямого противовирусного действия (ПППД) позволило повысить устойчивый вирусологический ответ (УВО) с 45–50% на ПЕГ-ИФН-α+РБВ до 63–66% для пациентов, ранее не получавших лечения, 69–75% – c рецидивом, 40–52% – с предшествующим частичным и 38% – с «нулевым» ответом при применении боцепревира [3, 4]. В российской популяции применение телапревира пациентами с фиброзом и циррозом позволило достигнуть 82% УВО больным, ранее не получавшим лечения, 96% – с рецидивом и 67% пациентам с «нулевым» ответом. По мнению авторов, высокая эффективность обусловлена преобладанием в России пациентов с генотипом 1b, при котором ИП более эффективны по сравнению с генотипом 1а [5]. ИП 2-го поколения (симепревир) обладает более высоким профилем безопасности и не менее высокой эффективностью: частота УВО достигает 80,4% для пациентов, ранее не получавших лечения, 79–85% – c рецидивом, 75% – с предшествующим частичным и 51% – с «нулевым» ответом.
Согласно последним международным рекомендациям по лечению гепатита С, телапревир и боцепревир не применяются, т.к. зарегистрированы более эффективные и безопасные комбинации препаратов [6]. Кроме того, с 2015 г. доступны безинтерфероновые комбинации омбитасвир, паритапревир, дасабувир+ритонавир, а также даклатасвир и асунапревир. По результатам клинических исследований, УВО в данных комбинациях был достигнут в 90–100% и 82–91% случаев соответственно [7]. Однако во многих странах, в т.ч. и в России, для подавляющего большинства больных с учетом экономической составляющей данные комбинации оказываются недоступными. В связи с этим необходимо выделять группы больных, нуждающихся в безотлагательной терапии, и обеспечивать их доступными ИФН-содержащими схемами.
Схемы, содержащие ИФН и рибавирин в процессе лечения, могут приводить к нежелательным явлениям (НЯ), которые могут потребовать либо модификации дозировки лекарств, либо полной отмены [8]. Наиболее распространенные причины для снижения дозы – депрессии, цитопении, нарушения функции щитовидной железы [9].
Особое место среди этих НЯ занимают лейкопения (ЛП) и нейтропения (НП), развивающиеся из-за миелосупрессивного эффекта ПЕГ-ИФН-α+РБВ [10]. Гематологические НЯ не только ухудшают качество жизни пациентов, но и могут быть причиной развития инфекционных осложнений, которые требуют коррекции или отмены ПВТ, сопровождаются снижением частоты достижения УВО [11].
Результаты многочисленных исследований показывают, что ЛП и НП служат наиболее частой причиной модификации ПЕГ-ИФН-α+РБВ во время ПВТ. Частота возникновения НП (<750×109/л) на фоне терапии ПЕГ-ИФН-α+РБВ, по разным данным, составляет 18–21%. Согласно российским инструкциям к препаратам, коррекция ПЕГ-ИФН-α+РБВ необходима при снижении абсолютного числа нейтрофилов ниже 750/мм3 (снижение дозы), ниже 500/мм3 (отмена препарата с возможным возобновлением при увеличении числа нейтрофилов). Альтернативной лечебной тактикой может быть применение факторов роста – гранулоцитарного колониестимулирующего фактора (ГКСФ) [12]. Стоит отметить, что данные препараты широко используются в химиотерапии онкологических и гематологических заболеваний, однако проспективных исследований, достоверно демонстрирующих снижение риска инфекционных осложнений и повышение частоты УВО при применении ГКСФ, нет, поэтому решение о назначении принимается врачом индивидуально [13]. По данным ряда авторов, развитие ЛП и НП является фактором риска развития инфекционных осложнений при проведении ПВТ [14]. С другой стороны, приводятся данные об отсутствии корреляции между ЛП и НП и частотой инфекционных осложнений [15, 16]. Кроме того, указывается, что ИП 1-го поколения по-разному влияют на развитие гематологических НЯ при ПВТ в зависимости от исходных клинико-лабораторных показателей [17].
Таким образом, высокая частота и клиническое значение ЛП и НП на фоне ПВТ в реальной клинической практике при различных вариантах ПВТ остаются недостаточно изученными, подходы к коррекции ЛП и НП не до конца отработаны, что и послужило поводом для настоящего исследования.
Цель исследования – изучение частоты, степени тяжести и динамики содержания лейкоцитов и нейтрофилов в крови больных ХГС на фоне ПВТ с применением ИП 1-го и 2-го поколений.
Материал и методы
В исследование были включены 117 больных ХГС в возрасте от 21 года до 66 лет (в среднем 41,5±11,6 года). Все пациенты были инфицированы генотипом 1b ХГС. Большинство обследованных – лица мужского пола (69 [59%]), женщины составили 48 (41%) человек. Основные исходные характеристики пациентов представлены в табл. 1.
Все пациенты в зависимости от типа комбинированной терапии были разделены на 2 группы: 1-я группа получала тройную ПВТ в составе ПЕГ-ИФН-α+РБВ с применением ИП – 64 (54,7%) человека, 2-я – ПВТ с применением ПЭГ-ИФН-α+РБВ (53 [45,3%]). В 1-й группе ПВТ с применением боцепревира получали 24, телапревира – 27 и симепревира – 13 человек соответственно (табл. 2). Продолжительность ПВТ составила 24–48 недель. Дозы препаратов ПЕГ-ИФН-α, РБВ и ИП назначались согласно инструкции к ним.
Изучение уровня лейкоцитов и нейтрофилов проведено до терапии, на 4-й, 12, 24, 48-й неделях терапии и через 24 недели после окончания терапии. Несмотря на существование различных классификаций ЛП и НП, в данной работе уменьшение числа лейкоцитов и нейтрофилов классифицировалось по четырем степеням тяжести (табл. 3) [18]. Норма была определена исходя из референсных значений лабораторного метода и составила для лейкоцитов 4–11×109/л, для нейтрофилов 1,8–7,5×109/л [19]. Варианты ЛП и НП, включившие т.н. латентную ЛП и НП, отнесены к норме. Эффективность лечения оценивалась по УВО на 24-й неделе по окончании терапии.
Статистическая обработка данных была выполнена на персональном компьютере с помощью электронных таблиц Microsoft Excel и пакета прикладных программ IBM SPSS for Windows, v.21.0 (США). Для каждого количественного параметра были определены среднее значение (M), среднеквадратическое отклонение (SD), ошибка среднего (m), медиана (Me), интерквартильный размах (Q1–Q2), 95% доверительный интервал (ДИ). Для качественных данных определены показатели частоты (%). Перед проведением сравнительного анализа количественных данных в исследуемых группах определен вид распределения данных (тест Колмогорова–Смирнова, графический анализ данных), для оценки различий в группах применены методы параметрической статистики для количественных признаков с нормальным распределением (t-критерий Стьюдента), χ2-критерий с поправкой Йетса для качественных признаков и непараметрической статистики – U-тест Манна–Уитни; для небольших выборок – точный критерий Фишера. Статистически значимыми считались различия при р<0,05 (95%-ный уровень значимости). Связь между изучаемыми показателями оценена по результатам корреляционного анализа с вычислением коэффициента корреляции Пирсона (r) или Спирмена (R) и последующим установлением его значимости по t-критерию. Относительный риск (ОР) заболеваемости вычислен по методу Katz. Для исследования влияния нескольких независимых переменных на одну зависимую переменную использован одномерный дискриминантный анализ – метод бинарной логистической регрессии. Кроме того, применен ROC-анализ для выявления показателей, в качестве прогностического фактора – вычисление площади по кривой AUC (Area Under Curve) для определения качества модели.

Результаты и обсуждение
Из 117 пациентов, включенных в исследование, полностью окончил курс лечения 101 (86,3%) человек, 16 прервали ПВТ: 1 пациент – по причине развития НЯ (криптогенной самоорганизующейся пневмонии, ИФН-индуцированной); 1 – по причине декомпенсации основного заболевания (кровотечения из варикозно расширенных вен пищевода); в отношении троих был сокращен курс ПВТ по причине наличия продленного быстрого вирусологического ответа (пБВО) и отсутствия неблагоприятных прогностических факторов УВО, плохой переносимости ПВТ, а также по причине наличия бактериального осложнения; 11 пациентов – из-за неэффективности ПВТ.
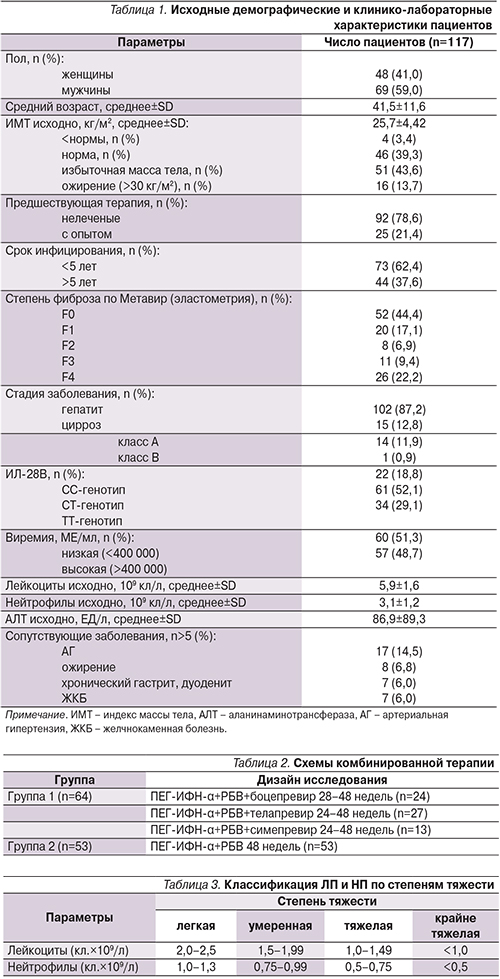
Профиль НЯ во время ПВТ не отличался от таковых в доступных литературных источниках, за исключением развития редкого ИФН-индуцированного НЯ – криптогенной самоорганизующейся пневмонии [20]. Были получены данные о наличии инфекционных осложнений у 5 пациентов и развитии двух НЯ у 1 пациента. При оценке динамики содержания лейкоцитов и нейтрофилов у больных ХГС на фоне ПВТ независимо от ИП установлено, что все пациенты исходно имели нормальные показатели уровня лейкоцитов и нейтрофилов. Следует отметить, что абсолютные значения числа лейкоцитов и нейтрофилов статистически значимо снижались после четырех недель терапии независимо от ИП (p<0,05) (рис. 1).
Ряду больных проведена коррекция дозы ПЕГ-ИФН-α. Дозы снижены в 8 (6,8%) случаях, из них 4 пациентам – по причине снижения массы тела, 3 – по причине развития тяжелой и крайне тяжелой HП, 1 пациенту осуществлена временная отмена с последующим возобновлением по причине развития бактериального осложнения (цистита), в 16 (13,6%) случаях – отмена по причинам, не связанным с развитием ЛП и НП. В результате комбинированной ПВТ больных ХГС УВО был достигнут у 88 (75,2%) (табл. 4).
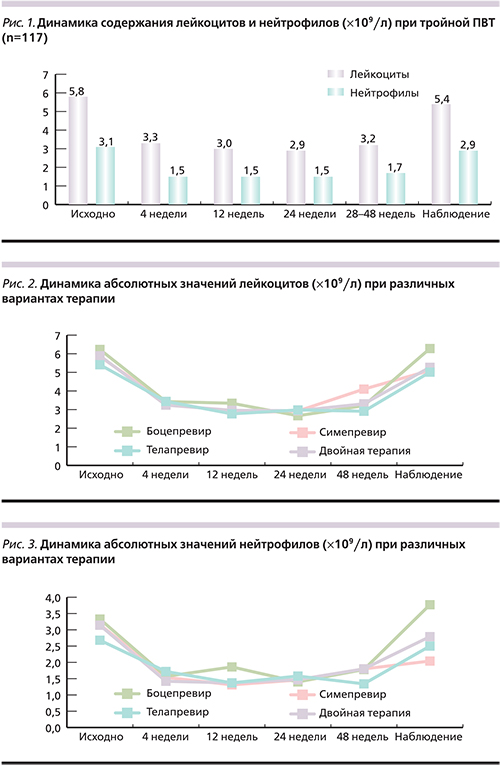
Анализ динамики показателей лейкоцитов и нейтрофилов 64 пациентов на тройной ПВТ с применением ИП показал, что наиболее значительное снижение числа лейкоцитов зафиксировано до значений 1,1×109/л, что соответствует тяжелой степени ЛП; минимальный уровень нейтрофилов составил 0,3×109/л, что соответствует крайне тяжелой степени НП. Необходимо отметить, что наименьшее количество лейкоцитов и нейтрофилов определено в период с 12-й по 24-ю неделю ПВТ (рис. 2, 3).
При оценке ЛП и НП в зависимости от сроков лечения отмечено, что наибольшая частота развития ЛП была зафиксирована на 24-й неделе – 25 (39,0%) человек. НП встречалась с наибольшей частотой на 4–12-й неделях – 29 (45,3%) человек.
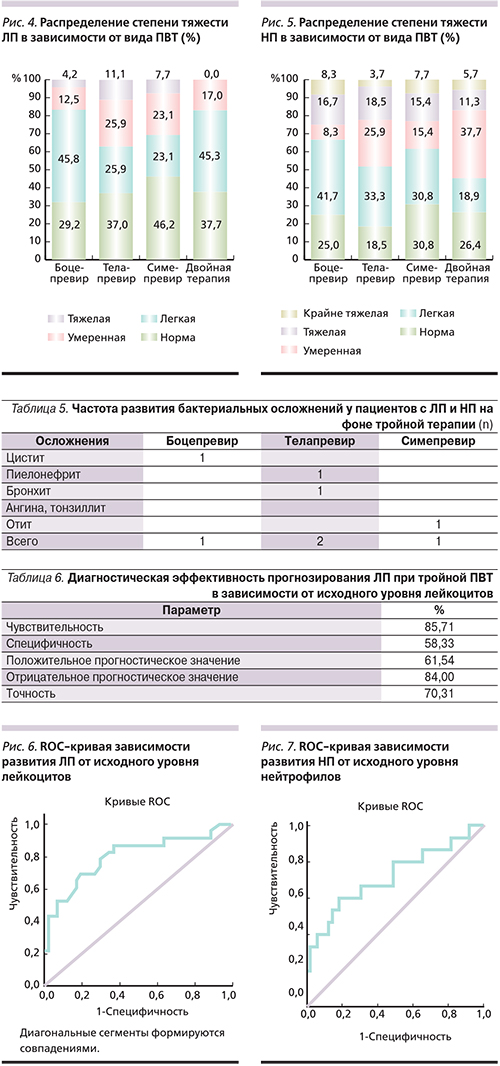
Распределение степеней тяжести ЛП и НП демонстрирует наличие тяжелой ЛП у 5 (7,8%) пациентов, в то же время тяжелая и крайне тяжелая НП зафиксированы у 11 (17,2%) и 4 (6,3%) пациентов соответственно (рис. 4, 5). Двоим проведена коррекция НП ГКСФ филграстимом в дозе 150 и 300 мкг/нед. В общей сложности у 41 (64,1%) из 64 пациентов в течение всей терапии хотя бы один раз диагностировалась ЛП какой-либо степени тяжести. НП была диагностирована хотя бы один раз у 49 (76,6%) пациентов.
Необходимо отметить, что, несмотря на развитие бактериальных осложнений на фоне различных вариантов комбинированной ПВТ, клинического значения ЛП и НП не имели (табл. 5).
Для выявления показателей в качестве прогностического фактора применялся ROC-анализ. Для этого вычисляли параметр – площадь по кривой (AUC) для определения качества модели (рис. 6, 7).
AUC=0,801±0,062, что свидетельствует об очень хорошем качестве модели, при которой точкой «cut off» определено значение лейкоцитов – 5,665×109/л (табл. 6).
Риск развития ЛП у пациентов при исходном уровне лейкоцитов менее 5,7 в 2,1 раза выше по сравнению с пациентами, у которых уровень лейкоцитов исходно был выше 5,7 (ОР=2,06; 95% ДИ – 1,36–3,12).
AUC=0,801±0,062, что свидетельствует об очень хорошем качестве модели, при которой точкой «cut off» определено значение нейтрофилов – 3,429×109/л (табл. 7).
Риск развития НП у пациентов при исходном уровне нейтрофилов менее 3,4 в 1,7 раза выше по сравнению с пациентами, у которых уровень нейтрофилов исходно был выше 3,4 (ОР=1,7; 95% ДИ – 1,08–2,80).
Получены данные, согласно которым 53 пациента завершили терапию, частота УВО составила 82,8%. Корреляционный анализ показал, что достижение УВО было связано с исходно более низким уровнем тиреотропного гормона – ТТГ (р=0,0086), СС-генотипом полиморфизма гена ИЛ-28В (p=0,0226), наличием БВО (отсутствие РНК после 4 недель тройной ПВТ; р=0,0030), более низким ИМТ на 4-й неделе ПВТ (ОР=0,67; 95% ДИ – 0,43–1,06; р=0,0129)), более низким уровнем АЛТ на 4-й неделе ПВТ (р=0,0068), к концу (р=0,0093) и после окончания ПВТ (р=0,0110), более высоким уровнем тромбоцитов после окончания ПВТ (р=0,0439) (табл. 8). Кроме того, были выявлены негативные прогностические факторы, как то мужской пол (р=0,0660), опыт предшествовавшей терапии (р=0,0670), ТТ-генотип ИЛ-28В (ОР=2,89; 95% ДИ – 1,33–6,28; р=0,0129). Таким образом, ТТ-генотип ИЛ-28В повышает риск неудачи при ПВТ с ПЕГ-ИФН-α+РБВ и ИП в 2,89 раза по сравнению с другими вариантами данного гена.
Другие факторы, в т.ч. возраст, вирусная нагрузка, срок инфицирования, стадия заболевания, уровень фиброза, исходные уровни лейкоцитов и нейтрофилов, анемия, ЛП и НП, во время ПВТ не достигли статистической значимости.
Выводы
- ЛП и НП – частые НЯ при проведении тройной ПВТ. Частота в анализируемой группе составила 64,1 и 76,6% соответственно. При этом в группе с телапревиром частота ЛП и НП составила 63,0 и 77,8%, с боцепревиром – 70,9 и 75,0%, с симепревиром – 53,8 и 61,5% соответственно. Частота развития ЛП и НП при тройной ПВТ была сопоставимой с таковой при ПВТ ПЕГ-ИФН-α+РБВ – 62,3 и 67,9%.
- Тяжелая степень ЛП отмечена в 7,8%, тогда как крайне тяжелая и тяжелая степень НП – в 17,2 и 6,3% соответственно.
- Развитие ЛП и НП достоверно зависит от исходных характеристик пациента: ЛП – женский пол, низкая виремия, исходный уровень лейкоцитов ниже 5,6×109/л, и НП – женский пол, исходный уровень нейтрофилов ниже 3,4×109/л.
- Частота инфекционных осложнений составила 4,7% (n=3). Наличие и степень ЛП и НП не влияют на развитие инфекционных осложнений при тройной ПВТ.
- Выявлены неблагоприятные предикторы эффективности тройной ПВТ с применением ИП: ТТ-генотип ИЛ-28В достоверно снижает частоту УВО – в 2,89 раза. Кроме того, мужской пол и неэффективность предшествующей терапии чаще встречаются среди лиц, не достигших УВО.



