Хронический гепатит С (ХГС) занимает одно из ведущих мест в структуре инфекционной патологии. Сложившаяся во всем мире неблагоприятная эпидемиологическая ситуация характеризуется неуклонным ростом заболеваемости ХГС во всех возрастных группах, в т.ч. среди лиц трудоспособного возраста. Так, в мире вирусом гепатита С инфицированы 200 млн человек. Темпы инфицирования вирусом гепатита С в России с каждым годом растут: показатель заболеваемости гепатитом С вырос с 3,2 на 100 тыс. населения в 1994 г., до 20,73 на 100 тыс. населения – в 2000-м. Эпидемиологические закономерности вирусных гепатитов в России позволяют предполагать, что в ближайшие годы будет продолжаться рост заболеваемости гепатитом С. Такая широкая распространенность инфекции объясняется тем, что у 75–80 % больных, перенесших острый вирусный гепатит С, развивается хроническое поражение печени. Цирроз печени (ЦП) развивается у трети больных ХГС в среднем через 30 лет после инфицирования. Дальнейшее прогрессирование заболевания приводит к развитию гепатоцеллюлярной карциномы у части (около 20 %) больных.
Вирусные ЦП (в исходе хронических гепатитов В, С, В + D) составляют от 10,0 до 23,5 % всех циррозов [1]. В последние годы структура вирусных циррозов несколько изменилась: увеличилась доля циррозов в исходе ВГС до 30,3 % [2, 3]. Это согласуется с данными Европейской ассоциации по изучению болезней печени (1999), согласно которым ведущую роль в формировании ЦП играет хроническая инфекция вируса гепатита С, которая является причиной 40 % случаев ЦП [4]. И видимо, особенности течения ЦП определяются не только этиологическим фактором, но и другими дополнительными регулирующими механизмами, не вполне изученными на настоящий момент.
Что же определяет кроме этиологического фактора тяжесть течения заболевания у пациентов с ХГС или ЦП вирусной этиологии? Может быть, большая продолжительность жизни связана со степенью компенсаторных возможностей регуляторных систем адаптации, основой которых служит функционирование вегетативной нервной системы. Вегетативная нервная система регулирует сердечно-сосудистую деятельность, температуру тела, работу желудочно-кишечного тракта (атонические запоры, слабая перистальтика при симпатикотонии, гипермоторные дисфункции, спастические запоры, поносы при ваготонии), мочеиспускание, половую функцию, все виды обмена веществ, эндокринную систему, сон и др. Усиление функционирования одного отдела (например, симпатического) в нормальных физических условиях приводит к компенсаторному напряжению аппарата другого отдела (парасимпа-тического), возвращая функциональную систему к нормальному гомеостазу [5].
При формировании хронического заболевания печени еще до развития цирроза происходит нарушение в нейрогуморальной вегетативной регуляции, выраженное напряжение регуляторных систем с целью поддержания гомеостаза. Работ по выявлению этих изменений чрезвычайно мало [6–9]. Вегетативная дисфункция ВД встречается при хронических заболеваниях печени, причем проявления этого синдрома универсальны независимо от причины, вызвавшей данное заболевание.
Начиная с 1990 г. активно стала разрабатываться методика исследования вегетативных нарушений путем изучения вариабельности ритма сердца. Благодаря усилиям группы экспертов Европейского кардиологического общества и Североамериканского общества электростимуляции и электрофизиологии данный метод был стандартизован в 1996 г. и сегодня широко используется во всем мире [10]. Несмотря на кажущуюся простоту проведения обследования, на выходе врач получает совокупность графиков и числовых показателей, которые являются результатом сложной математической обработки записанных кривых, проведенной специальной компьютерной программой. Эти графики и показатели позволяют оценивать уровень вегетативного обеспечения, степень истощения систем внутренней регуляции, а значит, получать ответ на главный вопрос: есть ли у организма «запас прочности», готов ли он к адекватной реакции на внешние воздействия? Был сделан вывод о потенциальной возможности и перспективе применения этой методики [11].
Целью настоящего исследования стала оценка адаптационных возможностей больных ХГС и ЦП вирусной этиологии разной степени тяжести.
Материал и методы
В исследование были включены 62 пациента с ХГС и 103 – с ЦП вирусной этиологии. Контрольную группу составили 35 пациентов аналогичного пола и возраста. Для изучения частоты клинических проявлений, наличия и выраженности вегетативной дисфункции пациенты с ЦП были разделены на 3 группы в зависимости от степени тяжести цирроза печени по критериям Child–Pugh. В группу ЦП-А вошли 36 (34,0 %) пациентов с компенсированным ЦП (5–6 баллов по критериям Child–Pugh), в группу ЦП-В были включены 34 (33 %) пациента с субкомпенсированным ЦП (7–9 баллов по критериям Child–Pugh), группу ЦП-С составили 33 (32,1 %) пациента с декомпенсированным циррозом (10–15 баллов по Child–Pugh).
У всех исследуемых изучалась вариабельность ритма сердца в покое и активном ортостазе с помощью программы «Корвег» [12]. Вычислялись показатели, характеризующие активность различных звеньев вегетативной нервной системы: мода (гуморальный канал центральной регуляции сердечного ритма); амплитуда моды (центральное нервное звено симпатической регуляции); вариационный размах (автономное, парасимпатическое звено). Вычислялись интегральные показатели (индексы), характеризующие соотношения первичных показателей: индекс напряжения (отражает степень централизации управления ритмом сердца); индекс вегетативного равновесия (соотношение активности симпатического и парасимпатического звеньев); индекс ортостатической пробы (направленность и степень изменения функционирования вегетативной нервной системы, преимущественно симпатического ее отдела).
В покое показатели маркировались цифрой 1, в ортостазе – 2.
Для решения задач были использованы параметрические методы анализа, метод ранжирования предикторов – результатов математического анализа ритма сердца. Различия между параметрами сравнения считались статистически значимыми при р ≤ 0,05. Исследование проведено в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации (в редакции 2000 г. с разъяснениями, данными на Генеральной ассамблее ВМА; Токио, 2004), Правилами качественной клинической практики Международной конференции по гармонизации (ICH GCP), этическими принципами, изложенными в Директиве Европейского Союза 2001/20/ЕС, и требованиями национального российского законодательства. Протокол исследования одобрен Комитетом по этике ГБОУ ВПО КемГМА МЗ РФ. Процедуры рассмотрения и одобрения исследования соответствовали требованиям национального законодательства. Каждый больной подписал информированное согласие на участие в исследованиях.
Результаты и обсуждение
При сборе жалоб пациенты жаловались на слабость, быструю утомляемость. Снижение работоспособности, нарушения сна в виде сонливости днем и бессонницы ночью; периодически отмечались головокружения в ортостазе. Из других вегетативных жалоб реже встречались нарушения моторики кишечника в виде чередования запоров и поносов, нарушения мочеиспускания (поллакиурия, недержание мочи).
Индексы регуляторных систем вегетативной нервной системы (индекс напряжения и индекс вегетативной регуляции) достоверно указывали на преобладание симпатикотонии в покое и в активном ортостазе. Индекс напряжения регуляторных систем был статистически значимо (р < 0,05) выше: в 5 раз – в группе ХГС, в 11 – в группе ЦП-А, в 14 – в группе ЦП-В и в 31 раз – в группе ЦП-С в покое по сравнению с контрольной группой; соответственно в 5, 7, 11,9 и 29 раз выше в группах ХГС, ЦП-А, ЦП-В, ЦП-С статистически значимо (р < 0,05) в ортостазе по сравнению с контрольной группой, что указывало на выраженное смещение вегетативного баланса в сторону симпатической системы. Индекс вегетативного показателя ритма был статистически значимо (р < 0,05) выше в группах ХГС, ЦП-А, ЦП-В, ЦП-С по сравнению с результатами контрольной группы в обоих положениях, что указывает на смещение вегетативного баланса в сторону преобладания симпатического отдела. Индекс вегетативного равновесия в покое и при нагрузке во всех группах был статистически значимо (р < 0,05) – в десятки раз – выше (в покое в 5, 10, 12 и в 22,6 раза, в ортостазе в 5, 5, 11 и 22,9 раза выше в группах ХГС, ЦП-А, ЦП-В и ЦП-С соответственно), чем в контрольной группе, что соответствует усилению симпатической регуляии.
Сравнительные данные математического анализа сердечного ритма представлены в таблице.
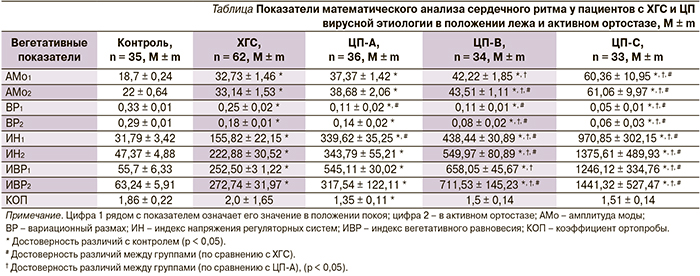
Полученные нами данные говорят о том, что степень выраженности проявлений ЦП сопровождается специфическими изменениями вегетативного статуса каждого пациента. Однако для более точного определения соотношения этих признаков необходимо определить их количественное соотношение, при котором происходит формирование патологии со всеми ее клиническими проявлениями. Это определение представляет большой практический интерес в плане оценки возможности прогрессирования патологии печени у конкретного пациента. На основании полученных в ходе исследования результатов нами была произведена оценка значимости каждого физиологического показателя в прогнозировании утяжеления течения цирроза печени.
Всем больным проведена патогенетическая и симптоматическая терапия в зависимости от степени тяжести цирроза печени, выраженности печеночной энцефалопатии и портальной гипертензии. В качестве препарата, снижающего давление в воротной вене, использован пропранолол, который отменялся перед записью кардиоинтервалографии за 3 дня. В качестве мочегонных – верошпирон в дозе от 25 до 200 мг в день; фуросемид от 40 до 80 мг в день при наличии асцита. При наличии портальной гастропатии назначался омепразол 20–40 мг/сут. Для профилактики и лечения печеночной энцефалопатии использована лактулоза в средней дозе 15 мл внутрь и орнитина аспартат 10–20 мл в/в капельно, а также проведена деконтаминация кишечника фторхинолонами или рифаксимином курсом 5–6 дней. В качестве заместительной терапии печеночной недостаточности использован альбумин 10–20 % – 100 в/в капельно. Большинство пациентов в качестве адъювантной терапии получали гепатопротекторы: S-аденозил-L-метионин и силимарин в дозировке 90 мг. Силимарин (Карсил Форте®) является основным активным комплексом из семян чертополоха или расторопши пятнистой, который использовался травниками в Европе более 2000 лет. Результаты многочисленных исследований за последние несколько десятилетий указывают на потенциальные терапевтические преимущества силимарина при гепатитах, фиброзе и ЦП. Силимарин доказал антиоксидантный, противовоспалительный, иммуномодулирующий и антифибротический эффекты, а также способность селективно стимулировать пролиферацию гепатоцитов в различных исследованиях [13].
Описаны основные гепатопротекторные свойства силимарина [14–17]:
- угнетение липопероксидации свободных радикалов и способность увеличивать клеточное содержание глутатиона;
- способность регулировать проницаемость мембран гепатоцитов и увеличивать их стабильность при повреждении ксенобиотиками;
- способность регулировать экспрессию генов за счет стероидоподобных эффектов;
- ингибирование трансформации звездчатых клеток печени в миофибробласты, опосредованно стимулирующие деградацию коллагеновых волокон, что приводит к ЦП.
Окислительный стресс является одной из ключевых особенностей активности заболевания у пациентов с HCV-инфекцией. Повышенный уровень маркеров окислительного стресса связан со степенью и стадией заболевания печени у больных гепатитом С [18], который предполагает, что антиоксидантная терапия может быть эффективной в замедлении прогрессирования заболевания в отсутствие противовирусного эффекта. Антиоксидантный и антитоксический эффекты Карсила Форте® предполагают его применение при HCV-инфекции.
На сегодняшний день существуют разноречивые данные относительно того, является ли силимарин полезным для лечения ХГС [19–24]. У пациентов с ЦП, вызванным HCV-инфекцией с неэффективными результатами тройной терапии, последнее исследование, проведенное с силимарином, не доказало его прямого противовирусного эффекта [25]. Но этот препарат способен ингибировать пролиферацию и секрецию провоспалительных цитокинов Т-клеток и может применяться пациентами с ХГС и вирусным ЦП в качестве адъювантной терапии за счет описанных выше эффектов, доказанных более чем в 300 исследованиях [26].
Выводы
Показатели частотного анализа сердечного ритма у исследуемых пациентов с ХГС и ЦП вирусной этиологии подтвердили усиление симпатической активности и ослабление парасимпатической активности по всем параметрам, при этом симпатические влияния усиливаются в активном ортостазе.
Индексы регуляторных систем вегетативной нервной системы (индекс напряжения и индекс вегетативной регуляции) также статистически значимо указывали на преобладание симпатикотонии в покое и активном ортостазе, что говорит о серьезных нарушениях адаптации у обследованных пациентов с ХГС и ЦП вирусной этиологии.
Использование неселективного β-блокатора (пропранолола) снижает частоту сердечных сокращений, но не влияет на вариабельность сердечного ритма. Комплексное применение неселективных β-блокаторов вместе с нейротропными гепатопротекторами (адеметионин, L-оринитин-L-аспартат) служит перспективным направлением коррекции адаптационных возможностей пациентов с ХГС и ЦП вирусной этиологии. Применение Карсила Форте® пациентами ХГС и ЦП вирусной этиологии эффективно и обоснованно.



