«Нужно научиться стрелять по микробам волшебными пулями», – говорил немецкий ученый, лауреат нобелевской премии Пауль Эрлих в начале прошлого века. Им была сформирована концепция «мишени», которая изначально предназначалась для разработки антибактериальных препаратов. Ученый поставил перед собой задачу изобрести препарат, который будет смертельным для микроорганизмов, но при этом безопасным для человека за счет его воздействия на определенную «мишень», присутствующую лишь в патогенном микроорганизме. И в 1907 г. был получен «Ehrlichschen Präparat 606» – «препарат 606», активный в отношении Treponema pallidum — возбудителя сифилиса, что, несомненно, стало прорывом в лечении этого заболевания. Препарат был назван сальварсаном, что в переводе означает «спасительный мышьяк» (лат. salv(are), спасать+arsen, мышьяк].
 П. Эрлих со своим учеником испытали новый препарат в 1909 г. Дальнейшие исследования показали, что сальварсан не идеален, были даже зафиксированы летальные исходы вследствие его применения. Позже П. Эрлих синтезировал более безопасный неосальварсан [1].
П. Эрлих со своим учеником испытали новый препарат в 1909 г. Дальнейшие исследования показали, что сальварсан не идеален, были даже зафиксированы летальные исходы вследствие его применения. Позже П. Эрлих синтезировал более безопасный неосальварсан [1].
На заре развития лекарственного лечения онкологических заболеваний предполагалось, что эффективные противоопухолевые препараты также будут угнетать рост лишь опухолевых клеток и не оказывать никакого влияния на нормальные ткани. Однако не все так просто, как хотелось бы, и появление лекарственных препаратов подобного «таргетного» действия в онкологии стало возможным лишь в конце XX в. благодаря прогрессу в области молекулярной онкологии.
В 2002 г. H. Davies и соавт. представили данные о наличии активирующей мутации в гене BRAF при различных злокачественных новообразованиях [1]. Такой вид мутации был определен при меланоме кожи, колоректальном раке, глиоме, аденокарциноме легкого, саркоме, опухолях яичника, при раке молочной железы и раке печени. Мутации не были обнаружены при исследовании нейробластомы, рака мочевого пузыря, лейкоза и лимфомы, рака шейки матки, почечно-клеточного рака, рака поджелудочной железы, рака предстательной железы, рака желудка и других видов рака [2].
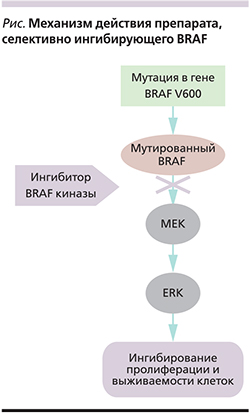
Доклинические и ранние клинические данные подтвердили, что эффект препарата, селективно ингибирующего BRAF, реализуется в опухолях, которые имеют мутацию в гене BRAF (см. рисунок). Воздействие этих молекул на опухолевые клетки с нормальным BRAF, напротив, может сопровождаться патологической активацией каскада BRAF–MEK–ERK и провоцировать рост меланомы. По этой причине перед началом терапии ингибиторами BRAF необходимо обязательно проводить тестирование образца опухоли пациента на BRAF-мутацию.
В 2011 г. вемурафениб (BRAFi – ингибитор BRAF) был зарегистрирован в США и странах Европейского Союза для лечения пациентов с метастатической меланомой кожи (мМК). В 2013 г. вемурафениб получил одобрение для использования на территории РФ [3]. Основанием стали результаты клинического исследования III фазы, BRIM-3, в котором была оценена эффективность вемурафениба по сравнению со стандартной химиотерапией дакарбазином при лечении пациентов с мМК, ранее не получавших системного лечения [4]. В исследование были включены 675 пациентов с мутацией BRAF V600, имеющих неоперабельную IIIC или IV стадию мМК. Пациентов случайным образом распределили в отношении 1:1. В группу вемурафениба (960 мг внутрь, два раза в сутки per os) были включены 337 пациентов, в группу дакарбазина (1000 мг/м2 в/в каждые 3 недели) – 338. Лечение продолжали до прогрессирования заболевания, неприемлемой токсичности или до отзыва согласия пациентом по любой причине. Вемурафениб продемонстрировал статистически значимое увеличение общей выживаемости у пациентов с мМК при наличии мутации BRAF V600, ранее не получавших системной терапии. Показано, что по сравнению с химиотерапией вемурафениб на 30% снижает риск смерти (отношение рисков [ОР]=0,70; p=0,0008) и кроме того, на 62% (ОР=0,38; p<0,0001) уменьшает риск прогрессирования заболевания. В ходе исследования было продемонстрировано значительное увеличение частоты объективного ответа на лечение в группе вемурафениба (57%, включая 5,6% полных ответов) по сравнению с группой дакарбазина, где частота объективного ответа на лечение составила 8,6% (1,2% полных ответов). Медиана выживаемости без прогрессирования для группы пациентов, получавших вемурафениб, составила 6,9 месяца против 1,6 для группы сравнения (р<0,001). Медиана общей выживаемости при использовании вемурафениба составила 13,6 месяца и была значимо выше, чем в группе дакарбазина, – 9,7 месяца (р<0,001). Возможность увеличения медианы общей выживаемости до 18 месяцев была показана в более поздних исследованиях, например в исследовании COMBI-V, где вемурафениб использовали в качестве препарата сравнения [5].
Таким образом, вемурафениб стал первым препаратом персонализированной терапии мМК, блокирующим патологический сигнальный каскад, который запускается мутацией BRAF V600. Препарат назначается в дозе 960 мг дважды в день per os (суточная доза – 1920 мг) для пациентов с метастатической и неоперабельной МК при наличии мутации BRAF V600. Лечение проводят до прогрессирования заболевания или развития непереносимости терапии.
При метастатическом колоректальном раке BRAF мутации встречаются в 10% случаев и ассоциированы с плохим прогнозом [6]. В клиническом исследовании II фазы (NCT00405587) когорта из 21 пациента получала терапию вемурафенибом в рекомендованной дозе 960 мг перорально два раза в сутки. Однако результатов, сопоставимых с эффективностью вемурафениба при лечении мМК, не было получено. Лишь у одного пациента был зарегистрирован частичный ответ [7]. Это говорит о том, что мутация BRAF играет разную роль в канцерогенезе различных опухолей.
D. Hyman и соавт. (2015) представили результаты исследования II фазы (NCT01524978, набор пациентов: апрель 2012 – июнь 2014), в которое были включены 122 пациента с различными «немеланомными» злокачественными новообразованиями, имеющими активирующую мутацию в гене BRAF [8]. Это исследование было ориентировано не на набор пациентов по нозологическим формам опухолей, а напротив, на включение всех разновидностей новообразований на основе единственного критерия – наличия активирующей мутации в гене BRAF. Для таких исследований недавно появился новый термин: «basket trials» («корзинное исследование»). В ходе исследования была показана активность вемурафениба при немелкоклеточном раке легкого, а также у пациентов с гистиоцитозом из клеток Лангерганса (болезнь Erdheim–Chester). Помимо этого в некоторых случаях наблюдались ответы BRAF-мутированных опухолей других локализаций – последние были представлены единичными пациентами, поэтому в отношении них какой-либо убедительной статистики получить не удалось (табл. 1).
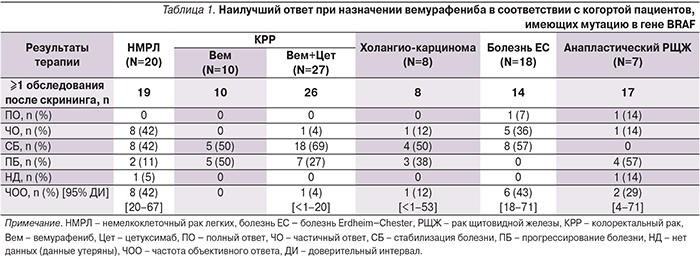
Монотерапия вемурафенибом оказалась неэффективной в отношении колоректального рака, при этом добавление цетуксимаба лишь в незначительной мере улучшало результаты лечения. Результаты исследования убедительно показывают, что успех таргетной терапии зависит не только от присутствия в опухоли белка-мишени, но и от сопутствующих биологических факторов [9].
В 2015 г. вышла статья С.А. Проценко и соавт. (Invest New Drugs), в которой впервые продемонстрирована значительная активность вемурафениба в отношении BRAF-мутированной светлоклеточной саркомы [10].
В публикации был представлен клинический пример лечения пациента 46 лет, страдающего светлоклеточной саркомой и имеющего прогрессирование болезни на фоне стандартной химиотерапии. При изучении молекулярно-генетических характеристик опухоли пациента была выявлена мутация в гене BRAF V600E. Попытка терапии вемурафенибом в дозе 960 мг два раза в сутки перорально привела к полному исчезновению метастазов в легких через 2 месяца терапии.
Вемурафениб продемонстрировал эффективность также при волосатоклеточном лейкозе (ВКЛ). В 2014 г. J. Samuel и соавт. опубликовали клинический пример успешного использования вемурафениба при лечении ВКЛ у пациента с мутацией BRAF [11]. Далее были представлены данные клинического исследования II фазы, в которое были включены 26 пациентов, переставших отвечать на стандартную химиотерапию. Все пациенты получали вемурафениб в дозе 960 мг два раза в сутки перорально. Частота объективного ответа составила 96% (из них 34,6% полных ответов, 61,4% частичных) [12]. Стоит также отметить, что данные, которыми мы располагаем сегодня, говорят о том, что мутация BRAF встречается почти у всех пациентов с ВКЛ [13].
Описаны случаи успешного лечения вемурафенибом детей с мультиформной глиобластомой [15] и астроцитомой [16]. При первичных опухолях центральной нервной системы мутация BRAF V600E встречается с частотой до 16% в зависимости от типа опухоли [14]. У мальчика в возрасте 9 лет была диагностирована мультиформная глиобластома. Очередной рецидив опухоли отмечен через 3 года – в возрасте 12 лет. При проведении молекулярно-генетического анализа выявлена мутация BRAF V600E. Была предпринята попытка лечения вемурафенибом и спустя 4 месяца зарегистрирован полный ответ, который сохраняется уже 6 месяцев. Этот клинический пример был описан в литературе как первый случай полного ответа рецидивирующей глиобластомы на таргетную терапию ингибитором BRAF [15].
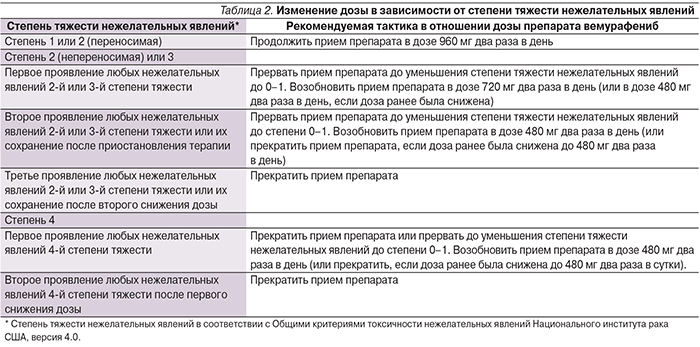
Нежелательные явления вемурафениба и других ингибиторов BRAF обусловлены их механизмом действия и включают развитие кератоакантом и плоскоклеточного рака, которые подвергаются хирургическому иссечению и поэтому не требуют отмены препарата/перерыва в лечении. Кроме того, встречаются дерматиты, повышенная фоточувствительность кожи, артралгии, слабость, выпадение волос, нарушение функции печени. Разработаны критерии модификации дозы вемурафениба в зависимости от степени нежелательного явления, однако не рекомендуется уменьшать дозу препарата ниже 480 мг два раза в день (табл. 2) [17].
На сегодняшний день роль BRAF мутации в MAPK (англ. mitogen-activated protein kinase, митоген-активируемая протеинкиназа) сигнальном пути при МК хорошо изучена. Терапия ингибиторами BRAF является стандартом лечения мМК с мутацией гена BRAF V600. В то же время значение этой мутации при других злокачественных новообразованиях требует дальнейшего изучения. Так, описаны случаи успешного применения вемурафениба при ВКЛ (резистентном к стандартной химиотерапии), НМРЛ, первичных опухолях центральной нервной системы у детей с использованием вемурафениба. Однако остается ряд злокачественных новообразований, при которых его использование не продемонстрировало ожидаемых результатов. Это еще раз позволяет нам высказаться в пользу того, что успех таргетной терапии определяется не только «мишенью», но и значением этой мишени в канцерогенезе данного новообразования и другими сопутствующими биологическими факторами.


