Одной из актуальных проблем современной онкологии является лечение больных метастатическим колоректальным раком (мКРР). Интерес к этой патологии объясняется ее сложностью и тяжестью течения, высокими показателями заболеваемости и смертности, имеющими тенденцию к возрастанию.
В структуре онкологической заболеваемости КРР занимает 3-е место в мире после рака легкого и рака молочной железы. В 2012 г. зарегистрировано около 1,4 млн новых случаев КРР и около 700 тыс. смертей от этого заболевания [1]. Отмечается ежегодное увеличение заболеваемости КРР в нашей стране. С 2003 по 2013 г. зарегистрирован прирост показателей заболеваемости раком ободочной кишки на 12,76% и раком прямой кишки на 8,95% [2].
В структуре смертности населения РФ от злокачественных новообразований КРР занимает 2-е место после рака легкого [3].
Несмотря на совершенствование ранней диагностики и использование скрининговых программ, не более 20% больных КРР на момент установления диагноза имеют I–II стадии. У 40% регистрируется вовлечение в процесс регионарных лимфоузлов, а у каждого третьего пациента определяются отдаленные метастазы. Дополнительно к этому у 40–60% больных, которым были выполнены радикальные операции, в процессе наблюдения наступает диссеминация процесса, что расширяет группу пациентов, требующих проведения лекарственной терапии [4]. Из этого следует, что необходимость рассмотрения вопроса о системном лекарственном противоопухолевом лечении возникает не менее чем у половины больных КРР. Поэтому выбор адекватной схемы лечения КРР – крайне важная задача для улучшения показателей выживаемости среди этой категории пациентов.
В настоящее время продолжается поиск наиболее оптимальных режимов химиотерапии (ХТ), в результате использования которых предполагается увеличение времени до прогрессирования (ВДП) и общей выживаемости (ОВ), улучшение качества жизни пациентов. Благодаря значительному прогрессу в ХТ и хирургическом лечении мКРР, использованию мультидисциплинарного подхода алгоритмы лечения больных изменились.
В 2004 г. А. Grothey и соавт. [5] представили результаты мета-анализа 11 рандомизированных исследований, в котором была показана прямая корреляция между продолжительностью жизни больных и использованием всех трех препаратов, активных при КРР (оксалиплатин, иринотекан, фторпиримидины): коэффициент корреляции – 0,85; р=0,0008 (результаты оценивали независимо от последовательности применения препаратов). Было обнаружено, что пациенты, получившие в 1-й линии лечения терапию дуплетами, имеют больше шансов получить все три активных препарата за весь период лечения. Однако в том же мета-анализе показано, что только половине больных проведена терапия всеми тремя препаратами. Невозможность проведения 2-й линии ХТ почти половине больных с прогрессированием после 1-й линии ХТ с включением современных дуплетов привела исследователей к мысли о назначении трехкомпонентных схем ХТ, которые включали бы все активные компоненты в 1-й линии лечения.
Во многих исследованиях [6–10, 12–17, 24, 25, 27] с использованием трехкомпонентных схем ХТ, включающих оксалиплатин, иринотекан и фторпиримидины (±анти-EGFR-препараты), в 1-й линии лечения мКРР продемонстрированы более высокие частота объективного ответа (ЧОО), ВБП и ОВ по сравнению с двухкомпонентными режимами. Так, в рандомизированном исследовании III фазы The Gruppo Oncologico Nord Ovest (GONO) [8, 9] (медиана наблюдения 18,4 месяца) 6-месячная индукционная ХТ в режиме FOLFOXIRI (оксалиплатин 85 мг/м2, иринотекан 165 мг/м2, лейковорин 200 мг/м2 в 1-й день, 5-фторурацил (5-ФУ) 3,2 г/м2 – 48-часовая инфузия начиная с 1-го дня каждые 2 недели) [8, 10] обеспечила статистически значимое увеличение ЧОО, частоты радикальных резекций метастазов, ВБП и ОВ по сравнению с 6-месячной индукционной ХТ в режиме FOLFIRI. В исследование были включены 244 пациента с мКРР. Наблюдали увеличение медианы ВБП до 9,8 против 6,8 месяца (р<0,001) и медианы ОВ до 23,4 против 16,7 месяца (р=0,026) с 5-летней выживаемостью 15 против 8% для пациентов, получавших FOLFIRI. ЧОО в группе FOLFOXIRI составила 60 против 34% в группе FOLFIRI (р<0,0001) [11]. Частота выполнения резекций метастазов R0 в группе FOLFOXIRI составила 15 против 6% (p=0,033) среди всех 244 пациентов и 36 против 12% (p=0,017) среди пациентов с наличием метастазов только в печени. Однако этот выигрыш сопровождался существенным увеличением частоты нежелательных явлений. Так, периферическая полинейропатия 2–3-й степеней отсутствовала у больных группы FOLFIRI и регистрировалась у 19% пациентов группы FOLFOXIRI (р=0,0001), нейтропения 3–4-й степеней имела место у 28 и 50% больных соответственно (р=0,0006). Частота фебрильной нейтропении (5% в группе FOLFOXIRI против 3% в группе FOLFIRI) и диареи 3–4-й степеней (20 против 12%) существенно не различались. При этом продолжительность лечения в обеих группах была приблизительно одинаковой (11 и 10 месяцев соответственно). Высокие показатели эффективности при добавлении третьего препарата, возможно, были связаны с низкой инфузионной дозой 5-ФУ (1200 мг/м2/46 ч) в режиме FOLFIRI, тогда как в режиме FOLFOXIRI доза 5-ФУ составила 3200 мг/м2/72 ч. Эта разница могла оказать существенное влияние на результаты лечения, особенно на ЧОО. Результаты этого исследования еще раз подтвердили, что для достижения медианы продолжительности жизни 18–20 месяцев больные мКРР должны получать все 3 препарата: оксалиплатин, иринотекан, фторпиримидины.
Представляет интерес работа G. Masi и соавт. [12], которые проанализировали результаты применения режима FOLFOXIRI у 196 пациентов с первично неоперабельным диссеминированным КРР, лечившихся в рамках исследований II и III фаз. Метастатическое поражение включило печень – 68%, легкие – 11%, печень+лимфоузлы – 13%, печень+брюшина – 3%, печень + легкие – 5%. Общий ответ составил от 66 до 72%, в 37 (19%) случаях удалось выполнить радикальное хирургическое удаление метастатических очагов R0. При средней длительности наблюдения 55 месяцев медиана ОВ составила 41 месяц, 5-летняя выживаемость от начала ХТ – 45%, 8-летняя – 33%. В настоящее время некоторые исследователи предлагают данный режим в качестве стандартной терапии при первично нерезектабельном КРР.
Как уже было показано, повышение эффективности ХТ часто сопряжено с высокой токсичностью 3-й или 4-й степени, такой как нейтропения и диарея, иногда даже приводящей к гибели пациентов. Было проведено исследование II фазы [13] у ранее не леченных больных мКРР с целью оценки безопасности и эффективности режима FUFOXIRI (еженедельное введение оксалиплатина 50 мг/м2, иринотекана 70 мг/м2, лейковорина 500 мг/м2 и 5-ФУ 2000 мг/м2, дни 1, 8, 15 и 22 каждые 36 дней). В исследование были включены 22 пациента. Режим FUFOXIRI переносился хорошо, без фебрильной нейтропении или токсичности 4-й степени. Наиболее распространенными побочными эффектами 3-й степени были диарея и нейтропения, которые наблюдались у 24% больных. Редукции доз из-за токсичности были проведены 48% пациентов и 60% больных, получивших как минимум два цикла FUFOXIRI. ЧОО составила 55%, медиана ВБП – 10 месяцев, медиана ОВ – 18. Данное исследование продемонстрировало превосходную эффективность режима FUFOXIRI для пациентов с мКРР.
Комбинация цетуксимаба с режимом FOLFOXIRI (оксалиплатин 85 мг/м2, иринотекан 180 мг/м2, лейковорин 200 мг/м2 в 1-й день+5-ФУ 400 мг/м2 внутривенно струйно, день 1 с последующей инфузией 1800 мг/м2/46 ч каждые 2 недели) использовалась в 1-й линии лечения 42 пациентов при нерезектабельных метастазах КРР в печени [14]. ЧОО составила 80,9%, а у 11,9% пациентов был зарегистрирован полный регресс опухолевых очагов. Медиана ВДП составила 10 месяцев, медиана ОВ – 27,2, одногодичная выживаемость – 79%.
Исследование POCHER включило 43 больных мКРР, имевших исходно нерезектабельные метастазы в печени, у некоторых из них одновременно были выявлены метастазы в легких [15, 16]. Пациентам назначали цикловую ХТ цетуксимабом в комбинации с режимом FOLFOXIRI. После проведения 8 циклов лечения производили оценку резектабельности процесса. В зависимости от результатов либо продолжали лекарственную терапию в течение 3 месяцев, либо выполняли резекцию метастазов в печени с последующей лекарственной терапией на протяжении 3–5 месяцев. Объективный эффект зарегистрирован у 79% больных, радикальная резекция метастазов в печени выполнена 58% пациентов, 2-годичная выживаемость составила 63%.
Еще более интересными оказались результаты исследования цетуксимаба в комбинации с режимом FOLFIRINOX (n=42). В 1-й линии терапии мКРР общая эффективность лечения составила 92%, включая 14% полных и 78% частичных регрессов. Контроль над болезнью был достигнут в 97% случаев (!), медиана ВДП составила 10 месяцев, медиана ОВ – 27,2. Особенно важно, что предварительный отбор больных по статусу KRAS не проводился.
В рандомизированном исследовании III фазы TRIBE, представленном на ASCO GI-2013, а затем на ASCO-2013, сравнили эффективность тройного режима FOLFOXIRI+бевацизумаб и FOLFIRI+бевацизумаб в терапии 1-й линии мКРР [17]. В TRIBE были включены 508 больных. В соответствии с современным алгоритмом после 6 месяцев интенсивной комбинированной терапии оксалиплатин/иринотекан отменили и больных перевели на поддерживающее лечение по схеме 5-ФУ/лейковорин+бевацизумаб. Показано, что тройная комбинация FOLFOXIRI+бевацизумаб имеет достоверные преимущества перед режимом FOLFIRI+бевацизумаб по медиане ВБП: 12,2 месяца (более 1 года!) против 9,7 (относительный риск [ОР] – 0,73; 95% доверительный интервал – 0,60–0,88; р=0,0012). Преимущество при проведении терапии по схеме FOLFOXIRI+бевацизумаб не зависело от наличия или отсутствия мутации KRAS и реализовывалось в 2 подгруппах: у больных с KRASwt ОР составил 0,83, с KRASmut – 0,84. Отмечено достоверное увеличение ЧОО (53 против 65%; р=0,006). Различия в частоте выполнения резекций R0 были незначимыми как для всей популяции (12 против 15%; р=0,327), так и для подгруппы с изолированным поражением печени (28 против 32%; р=0,823). Отмечена тенденция к увеличению продолжительности жизни в группе FOLFOXIRI+бевацизумаб, где медиана ОВ достигла 31 месяца (в группе FOLFIRI+бевацизумаб медиана ОВ – 25,8 месяца, стратифицированный ОР – 0,79; р=0,054). Особого внимания заслуживают впечатляющие данные о высокой эффективности комбинации FOLFOXIRI+бевацизумаб в подгруппе больных с мутацией BRAF, т.к. известно, что ее наличие служит фактором негативного прогноза мКРР и коррелирует с уменьшением продолжительности жизни: медиана ОВ таких больных составляет всего 9–14 месяцев [18–22]. Комбинация FOLFOXIRI+бевацизумаб снижает риск прогрессирования и смерти среди пациентов с BRAFmut на 45% по сравнению с режимом FOLFIRI+бевацизумаб: ОР – 0,55, различия недостоверны (p=0,323), возможно из-за небольшого числа пациентов (n=28). Выигрыш от проведения высокоинтенсивного лечения в прогностически неблагоприятной подгруппе с мутацией BRAF был даже выше, чем у больных без мутации.
Кроме того, был проведен анализ результатов патоморфологического исследования метастазов в печени после выполнения резекций в объединенной когорте из 499 пациентов с КРР, получавших в исследованиях II–III фаз режим FOLFOXIRI±бевацизумаб [23]. Показано, что добавление бевацизумаба к режиму FOLFOXIRI увеличивает частоту патоморфологического ответа со стороны опухоли, не повышая токсичности в отношении паренхимы печени. Таким образом, вариантом выбора для пациентов, нуждающихся в проведении высокоинтенсивной терапии, может быть режим FOLFOXIRI+бевацизумаб с последующей поддержкой терапией 5-ФУ/лейковорин+бевацизумаб.

5-ФУ может быть заменен в режиме FOLFOXIRI на капецитабин. За последнее время проведено много исследований, которые продемонстрировали эффективность комбинации XELOXIRI (оксалиплатин, иринотекан и капецитабин) и позволили установить оптимальные дозы для данных препаратов. Результаты пилотного исследования по изучению режима XELOXIRI (оксалиплатин 85 мг/м2, иринотекан 165 мг/м2 в 1-й день, капецитабин от 2 до 3 г/м2, дни 1–7 каждые 2 недели) при мКРР оказались вполне обнадеживающими. Общий ответ составил 70%, однако такой результат был достигнут за счет высокого уровня токсичности 3–4-й степеней. Дозолимитирующими оказались диарея – 23%, нейтропения – 27%, фебрильная нейтропения – 8%, тромбоцитопения – 7% и нейротоксичность – 3%. В связи с этим рекомендованная доза капецитабина для данной схемы составляет 2000 мг/м2 [24].
Е. Bajetta и соавт. [25] сообщили о результатах исследования I–II фаз, проведенного с целью определения эффективности и безопасности режима ХТ, включившего оксалиплатин+иринотекан+капецитабин (каждые 2 недели), для пациентов с мКРР, ранее не получавших лечения по поводу метастатической болезни. В ходе исследования 38 больным проведено в среднем по 6 циклов ХТ. Все пациенты получали иринотекан в 1-й день, оксалиплатин (85 мг/м2) во 2-й и капецитабин 1000 мг/м2 перорально 2 раза в день, дни 2–6, каждые 2 недели. Три уровня дозы от 150 до 180 мг/м2 были изучены для иринотекана. Рекомендованная доза для данного препарата в исследовании II фазы составила 180 мг/м2. Из 27 пациентов, получивших лечение с использованием такой дозы, 17 достигли частичного регресса (общая ЧОО – 63%), 8 больным выполнена радикальная резекция метастазов в печени. Медианы ВБП и ОВ составили 8,5 и 23,5 месяца соответственно. Токсичность была управляемой. Хорошая переносимость и удобство в использовании позволили рекомендовать данный режим ХТ для уменьшения размеров метастазов КРР в печени перед выполнением радикальной операции (т.е. в качестве варианта выбора для больных потенциально резектабельными метастазами в соответствии с консенсусом экспертов ESMO) [26].
Целью исследования Е. Vasile и соавт. [27] была оценка эффективности режима XELOXIRI. Тридцть шесть пациентов с неоперабельным мКРР получили иринотекан 165 мг/м2 и оксалиплатин 85 мг/м2 в 1-й день+капецитабин 2000 мг/м2 ежедневно, дни 1–7, каждые 2 недели. Нейтропения и диарея наблюдались у 30% больных. Зарегистрировано 2 полных и 22 частичных ответов, что соответствовало общей ЧОО – 67%. При медиане наблюдения 17,7 месяца медианы ВБП и ОВ составили 10,1 и 17,9 месяца соответственно. Показано, что замена 5-ФУ на капецитабин в комбинации с оксалиплатином и иринотеканом не снижает эффективности режима, однако комбинация XELOXIRI ассоциируется с высокой частотой диареи и, следовательно, не должна рассматриваться как альтернатива FOLFOXIRI.
Клинический случай
Представляем клинический случай успешного лечения мКРР с достижением полного патоморфологического ответа при одновременном использовании в 1-й линии ХТ трехкомпонентной схемы (оксалиплатин+иринотекан+5-ФУ) и анти-EGFR-терапии.
Больному П. 1956 г. р. по поводу морфологически верифицированного рака сигмовидной кишки T2N1M1 с множественными метастазами в обеих долях печени и c учетом наличия кровоточащей опухоли сигмовидной кишки 07.02.2013 в ФГБУ «РОНЦ им. Н.Н. Блохина» Минздрава России на первом этапе была выполнена резекция сигмовидной кишки с формированием аппаратного сигморектоанастомоза по типу «конец в конец». Гистологически: умеренно дифференцированная аденокарцинома, врастающая в наружную пластинку мышечного слоя, без врастания в клетчатку. Края резекции в пределах здоровых тканей. В одном лимфоузле – метастаз аденокарциномы.
При обследовании до начала ХТ: опухолевые маркеры РЭА – 81,56 нг/мл (N<5 нг/мл), СА 19,9 – 42,07 ЕД/мл (N<37 ЕД/мл). Рентгенография органов грудной клетки (ОГК) от 19.03.2013: в легких, корнях, синусах патологических изменений не выявлено. При ультразвуковом исследовании (УЗИ) органов брюшной полости (ОБП) от 20.03.2013: в центральных отделах правой доли печени с переходом на левую долю – сливающиеся между собой 2 конгломерата 9×8,3 см и 12×10 см общим размером до 18,3×15,3 см; в S4-2 – очаг 4,4×4,0 см. ПЦР-секвенирование 2-го экзона гена KRAS (04.03.2013): в 12-м и 13-м кодонах 2-го экзона гена KRAS мутации не обнаружено.
Имплантация подкожного венозного порта – 22.03.2013.
С 25.03.2013 проведена химиотаргетная терапия в режиме иринотекан 100 мг/м2 внутривенно капельно, 90-минутная инфузия, оксалиплатин 65 мг/м2 внутривенно капельно, 2-часовая инфузия, дни 1 и 15; 2 недели – перерыв; 5-ФУ 200 мг/м2/сут внутривенно непрерывно, дни 1–14; 2 недели – перерыв, с использованием помпы со скоростью 2 мл/ч; панитумумаб 6 мг/кг внутривенно капельно, 1-часовая инфузия, дни 1 и 15, каждые 2 недели. Терапия без клинически значимых осложнений.
В процессе лечения проведена модификация режима ХТ: 5-ФУ 375 мг/м2 внутривенно струйно, дни 1 и 15; 2 недели – перерыв. В остальном – без изменений.
Контрольное обследование проводили после каждых 2 курсов лечения (каждые 2 месяца), при необходимости – каждый месяц.
Динамика опухолевых маркеров РЭА и СА 19,9 на фоне лечения представлена в таблице.
При контрольном обследовании после 2 курсов ХТ – значительное уменьшение метастатических узлов в печени в размерах в рамках частичного регресса (УЗИ от 07.06.2013: в S8 печени – гиперэхогенное образо-вание 6,8×5,6 см, в S8 поддиафрагмально – образование 7,0×6,5 см, рядом – очаг 2,8×2,6 см).
С июня по декабрь 2013 г. проведены 3–8-й курсы химиотаргетной терапии в режиме: иринотекан 100 мг/м2 внутривенно капельно, 90-минутная инфузия, оксалиплатин 65 мг/м2 внутривенно капельно, 2-часовая инфузия; 5-ФУ 375 мг/м2 внутривенно струйно, дни 1 и 15; 2 недели – перерыв; панитумумаб 6 мг/кг, внутривенно капельно, 1-часовая инфузия, дни 1 и 15, каждые 2 недели. Терапия без клинически значимых осложнений.
При контрольном обследовании после 4 курсов ХТ – дальнейшее уменьшение размеров метастатических узлов в печени (УЗИ ОБП от 13.08.2013) до 6×4,3; 6,9×5 и 2,1×1,9 см.
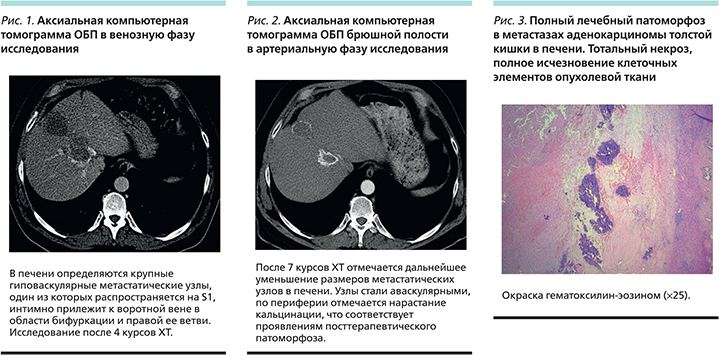
Для решения вопроса о возможности хирургического лечения метастазов в печени 14.08.2013 пациенту была выполнена компьютерная томография (КТ) ОБП с внутривенным контрастированием, при которой установлено, что один из опухолевых узлов достигает ворот печени, распространяется на S1 и тесно прилежит к воротной вене в области бифуркации и к правой ее ветви (рис. 1). Был сделан вывод, согласно которому на данном этапе выполнение радикальной операции не представляется возможным.
При контрольном обследовании после 7 курсов ХТ – дальнейшее значительное уменьшение метастатических узлов в печени в размерах (УЗИ от 29.11.2013) до 3,5×3; 4,5×4,9 и 1,8×1,3 см (очаги кальцинированные). По данным КТ ОБП с внутривенным контрастированием от 12.11.2013, помимо уменьшения размеров метастазов в печени отмечено нарастание кальцинации в периферических отделах метастатических узлов, особенно в узле, прилежащем к воротной вене (рис. 2).
По данным магнитно-резонансной томографии (МРТ) ОБП с внутривенным контрастированием (28.11.2013), в S5 (с частичным вовлечением S8) печени образование 3,5×3,13×2,62 см; в верхушке S8 (с частичным вовлечением S1 и S7) печени образование 2,78×3,44×2,61 см. После введения контрастного препарата образование в S8 неравномерно накапливает препарат, преимущественно по периферии. Образование в S5 формирует кольцевидный ободок по периферии, без достоверных признаков проникновения контраста в толщу образования к отсроченным фазам. Заключение: метастазы в печени в стадии посттерапевтического патоморфоза.
С целью гипертрофии левой доли печени 03.12.2013 выполнена эмболизация правой ветви воротной вены (липоидол+бициллин).
По данным МРТ ОБП с внутривенным контрастированием от 09.01.2014 (по сравнению с 28.11.2013), соотношение долей печени изменилось за счет умеренной гипертрофии левой доли печени. Объемное образование в S5 (с частичным вовлечением S8) уменьшилось в объеме с 3,5×3,13×2,62 до 3,52×2,42×2,4 см. Образование в S8 сократилось с 2,78×3,44×2,61 до 2,59×1,18×1,1 см. После введения контрастного препарата образования в S5 и S8 печени формируют кольцевидный ободок по периферии к равновесной фазе без признаков проникновения контраста в толщу образования к отсроченным фазам.
Радикальная операция «Расширенная правосторонняя гемигепатэктомия; холецистэктомия» проведена 16.01.2014. При гистологическом исследовании узлы в печени на всем протяжении представлены некротической тканью без элементов опухоли (полный лечебный патоморфоз).
В паренхиме печени вне узлов – фиброзное расширение портальных трактов с формированием немногочисленных коротких портопортальных септ с умеренно выраженной лимфоидной инфильтрацией, очаговый крупнокапельный стеатоз гепатоцитов (рис. 3).
С учетом результатов морфологического исследования, длительности предоперационной ХТ пациент был оставлен под динамическим наблюдением.
При очередном контрольном обследовании (октябрь–ноябрь 2014 г.) – прогрессирование заболевания в виде появления метастаза (цитологически верифицированного) в зоне резекции печени (МРТ ОБП с внутривенным контрастированием – образование 8×3 см по линии резекции печени, не исключено распространение на S1-сегмент.
Проведена реиндукция: с ноября 2014 по апрель 2015 г. проведено 5 курсов (10 введений) химиотаргетной терапии в режиме: иринотекан 100 мг/м2 внутривенно капельно, 90-минутная инфузия, оксалиплатин 65 мг/ м2 внутривенно капельно, 2-часовая инфузия, 5-ФУ 375 мг/ м2 внутривенно струйно, дни 1 и 15; 2 недели – перерыв; панитумумаб 6 мг/кг внутривенно капельно, 1-часовая инфузия, дни 1 и 15, каждые 2 недели. Начиная со 2-го курса в связи с аллергической реакцией на оксалиплатин (бронхоспазм) этот препарат не применялся.
При контрольном обследовании после 2 курсов ХТ в режиме реиндукции (МРТ ОБП с внутривенным контрастированием 02.02.2015) значительное уменьшение размеров рецидивного узла по линии резекции печени – с 8×3 до 3×2 см.
При контрольном обследовании после 4 курсов ХТ в режиме реиндукции достигнутый частичный эффект сохранялся (МРТ ОБП с внутривенным контрастированием 27.03.2015): образование по краю резекции печени не изменилось (3×2 см). УЗИ от 30.03.2015: структура оставшейся части левой доли печени неоднородная, на этом фоне очаговые образования отчетливо не визуализируются.
С 07.05.2015 по 14.05.2015 – курс стереотаксической радиотерапии на метастатический очаг по краю резекции печени (РОД – 6 Гр, 5 раз в неделю, СД – 30 Гр).
По данным МРТ ОБП с внутривенным контрастированием от 04.06.2015, в оставшейся левой доле печени метастазов не выявлено. В поддиафрагмальных отделах в крае резекции – участок кальцинации до 1,4 см в диаметре. УЗИ от 30.07.2015. Не выявило убедительных признаков метастазов. По краю резекции печени – зона пониженной эхогенности с участками фиброза, предположительно дистрофические изменения, на этом фоне крайне нечетко определяется изо-гиперэхогенный участок 1,5 см – более вероятно, участок паренхимы с жировой дистрофией.
По данным МРТ ОБП с внутривенным контрастированием от 17.09.2015 при сравнении с 08.07.2015 определяемый ранее очаг в S2 печени (по краю резекции) уменьшился в размерах с 1,3× см до 0,8×0,9 см.
При контрольном обследовании в декабре 2015 г. (МРТ ОБП с внутривенным контрастированием 21.12.2015) размеры ранее выявленного очага по краю резекции культи печени существенно не изменились и составляют 0,9×0,8 см (слабо визуализируется на ДВИ).
В настоящее время (апрель 2016 г.) пациент под динамическим наблюдением. При многократных (каждые 2–3 месяца) комплексных контрольных обследованиях (с июня 2015 по апрель 2016 г. – опухолевые маркеры РЭА и СА 19,9; рентгенография ОГК; УЗИ ОБП, забрюшинного пространства, таза; КТ ОГК, ОБП, забрюшинного пространства, таза с внутривенным контрастированием; МРТ ОБП, забрюшинного пространства, таза с внутривенным контрастированием; колоноскопия) – признаков прогрессирования основного заболевания не выявлено.
Таким образом, время до прогрессирования составило 19,6 месяца. Достигнутый эффект – полный патоморфологический регресс множественных метастазов в печени больших размеров. Длительность наблюдения – 37,2 месяца.
Заключение
Завершая рассмотрение представленного случая, необходимо отметить, что ХТ мКРР прошла большой путь от эмпирического назначения тех или иных режимов к стройной системе персонализированных лечебных алгоритмов, базирующихся на клиническом течении заболевания и учете молекулярно-генетических особенностей опухоли. Эта стратегия привела к значительному (с 6 месяцев до 2 лет) увеличению медианы продолжительности жизни больных мКРР. Таких результатов можно достичь, если пациенту проводить терапию тремя активными химиопрепаратами (оксалиплатин, иринотекан, фторпиримидины) в сочетании с моноклональными антителами. В настоящее время необходим дифференцированный подход к выбору тактики лечения больных диссеминированным КРР. Основываясь на клинических данных и данных молекулярного анализа, можно приблизиться к понятию индивидуализации лечения и приведенное нами клиническое наблюдение ярко это продемонстрировало.


