Введение
Рак легкого (РЛ) является ведущей причиной смертности от рака во всем мире, что составляет 1,38 млн смертей в год, т.е. 18,2% от общего числа смертей от рака [1]. Немелкоклеточный рак составляет 80–85% от всех гистологических форм РЛ. В течение болезни у 40% больных этой формой РЛ развивается метастатическое поражение головного мозга [2], причем у 7,4 – 10,0% пациентов внутричерепные очаги выявляются на момент первичного обращения [3]. Активирующие мутации EGFR присутствуют у 10–15% больных аденокарциномой легкого в Северной Америке и до 60% пациентов в Азии [4].
Метастазы в головном мозге (МГМ) всегда ассоциируются с плохим прогнозом и трактуются как финальный этап болезни. Продолжительность жизни пациентов без специфического лечения составляет 6 недель [5]. Применение комплексного подхода, включающего хирургическое и лучевое воздействия, а также химиотерапию, привело к росту общей выживаемости (ОВ) до 3–15 месяцев. Несмотря на терапевтические достижения, отдаленный прогноз остается неблагоприятным: по оценкам, общая 5-летняя выживаемость при метастатическом поражении головного мозга составляет менее 5%.
В наступившую около 25 лет назад «эру таргетной терапии» при индивидуализации назначения лекарственных средств наблюдается значительный рост выживаемости больных РЛ. Активирующие мутации в гене EGFR (epidermal grown factor receptor) усиливают чувствительность к тирозинкиназам, что способствует прогрессированию эпителиальных опухолей. Наличие мутации ассоциировано с чувствительностью к таргетным препаратам – ингибиторам тирозинкиназ. Подавляющее большинство мутаций, связанных с чувствительностью, – это делеции в 19-м экзоне (Del19) или замена L858R в 21-м экзоне, при этом торможение роста и ангиогенеза происходит при применении таких препаратов, как гефитиниб, эрлотиниб и афатиниб. При амплификации рецепторов другой киназы – ALK (anaplastic lymphoma kinase), эффективен селективный низкомолекулярный ингибитор рецепторов тирозинкиназы – кризотиниб. Так, в работах N.K. Gerber, W.J. Magnuson и соавт. [6, 7] в группе больных с мутацией EGFR, получавших таргетную терапию, достигнута медиана ОВ 19–58 месяцев. Применение эрлотиниба при метастатическом поражении головного мозга, по данным ряда авторов, привело к значительному повышению ОВ с 15,9 до 22,9 месяца, медианы времени без прогрессирования – с 5,8 до 14,5 месяцев, а частота объективного ответа по измеряемым очагам в ЦНС составила от 55 до 89% [8–10]. В целом, по данным массы серий, наблюдается от 66 до 89% объективных ответов, время до прогрессирования болезни составило от 6,6 до 10,0 месяцев.
Данные ретроспективных исследований указывают на более низкие показатели (6%) появления МГМ в 12-месячный срок у пациентов с мутацией EGFR, получавших ингибиторы тирозинкиназ в первой линии терапии, по сравнению с группой больных, получавших химиотерапию (19%) [11]. Приведенные цифры демонстрируют, что применение таргетных препаратов позволяет контролировать как экстракраниальное прогрессирование, так и интракраниальный процесс. С другой стороны, показано, что аденокарцинома с мутацией EGFR чаще метастазирует в головной мозг [12, 13]. Группы больных, представленных в многочисленных исследованиях, посвященных оценке таргетной терапии, разнородны и включают пациентов с впервые синхронно выявленными метастазами РЛ и первичным очагом, с метастазированием в отдаленном периоде; таргетная терапия пациентов, получающих лучевую терапию в виде облучения всего объема головного мозга либо стереотаксическую радиохирургию, также достаточно освещена. Данные методы лечения применимы к пациентам с мелкими солитарными либо множественными очагами без выраженной неврологической симптоматики. Однако зачастую при первичном обращении у больных выявляется гипертензионная, общемозговая и очаговая симптоматика, обусловленная масс-эффектом, окклюзией ликвороотводящих путей, что требует нейрохирургического лечения на первом этапе. Вопрос об объеме комплексного лечения данной группы больных остается до конца не решенным. Хирургическое лечение приводит к быстрому регрессу неврологической симптоматики после удаления крупных очагов, улучшая качество жизни, обеспечивая получение морфологического материала и создавая условия для дальнейшего адъювантного лечения. Продолжение лечения проведением таргетной терапии ограничивает дальнейшее метастазирование и рост уже имеющихся очагов.

Материал и методы
В нейрохирургическом отделении НМИРЦ им. П.А. Герцена в 2008–2016 гг. проведено микрохирургическое удаление МГМ РЛ 147 больным. Отслежены 129 пациентов. Стандартом диагностики МГМ является выполнение магнитно-резонансной томографии с внутривенным контрастным усилением. Нейрохирургическое лечение проведено пациентам при наличии очага более 2,5 см с масс-эффектом (проявляющимся нарушениями ликвородинамики, смещением срединных структур, объемным воздействием на прилежащие структуры и перифокальным отеком). Средний возраст больных составил 57,8±8,6 года (34–79 лет). Мужчины (103 пациента, 79,8%) преобладали над женщинами (26 пациенток, 20,1%). Субтенториальную локализацию МГМ выявили у 23 (17,8%) больных, у 90 (69,7%) пациентов были поражены полушария большого мозга, у 16 (12,4%) – и полушария, и мозжечок. Экстракраниальные метастазы выявлены у 74 (57,3%) больных, наиболее часто диагностировали метастазы в легкие и кости. У 58 (44,9%) пациентов обнаружено более одного МГМ. В группе больных с множественными метастазами (34 [26,3%]) было от 3 до 10 внутричерепных очагов. У 80 (62,0%) пациентов гистологически верифицирован аденогенный рак, у 36 (27,9%) – плоскоклеточный, у 7 (5,4%) – мелкоклеточный, у 6 (4,6 %) – крупноклеточный. Среди всех пациентов с аденокарциномой 18 пациентам проведено ПЦР-исследование на наличие активирующих мутаций в 21-м экзоне гена EGFR типа L858R (e.2573T>G) (NM 005228.3), предполагающих чувствительность опухоли к терапии гефитинибом и эрлонитинибом, а также транслокации гена ALK, предполагающих чувствительность к кризотинибу. Выявлено лишь 7 пациентов с наличием активирующей мутации гена EGFR либо ALK, у 11 ее не обнаружено. Важно отметить, что у 50 пациентов метастазирование в головной мозг стало первым проявлением РЛ.
Результаты исследования
Медиана времени наблюдения составила 13,9 (0–96) месяца. За время наблюдения умерли 95 (72,8%) больных, в т.ч. в результате прогрессирования опухоли – 83 (87,4%), от других причин – 12 (12,6%). Только у 28 (29,5%) из 95 умерших пациентов причиной смерти стало интракраниальное прогрессирование. Повторные операции в связи с интракраниальным прогрессированием опухоли были выполнены 20 (15,5%) больным: 11 (8,5%) – в связи с появлением новых очагов, 9 (6,9%) – по поводу рецидивов. Медиана ОВ составила 12,4 месяца (интерквартильный размах – 6–19 месяцев; рис. 1), медиана безрецидивной выживаемости (в отношении контроля зоны операции в головном мозге) – 11,0 месяцев (интерквартильный размах – 5–17 месяцев).
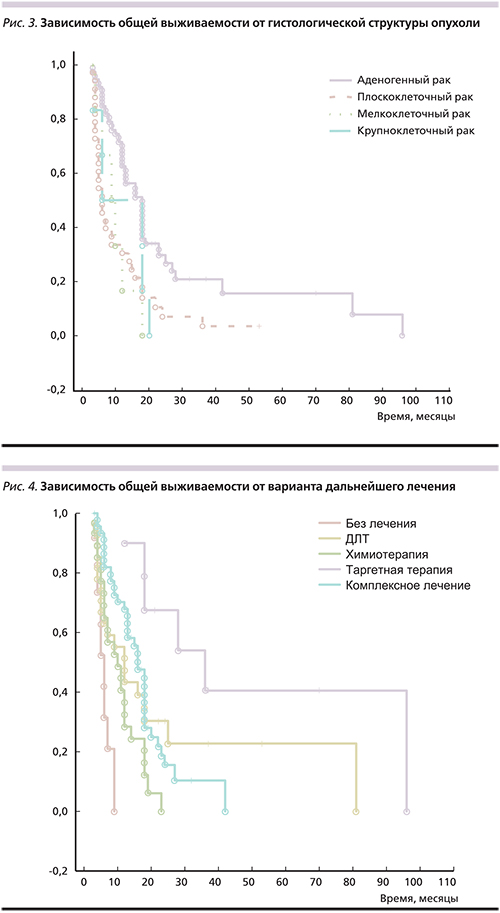
При поступлении всех больных стратифицировали на 3 класса по RPA, исходя из возраста, наличия экстракраниальных очагов либо рецидива опухоли и индекса Карнофского (по RTOG 1997– excursive partitioning analysis of prognostic factors [14]). ОВ достоверно зависела от RPA-класса (р=0,01; рис. 2). В отсутствие экстракраниальных очагов в возрасте <65 лет и с индексом Карновского >60 баллов ОВ составила 19 месяцев. При индексе Карновского на момент поступления <60 баллов медиана ОВ составила всего 6,5 месяцев. В группе пациентов 2-го RPA-класса, т.е. больных с наличием экстракраниальных очагов либо >65 лет, но с индексом Карновского >60 баллов, ОВ составила 12 месяцев. Гистологическая природа опухоли также достоверно (р=0,00039) влияла на ОВ (рис. 3). Так, медиана ОВ пациентов с аденокарциномой составила 13 месяцев, с плоскоклеточным раком – 5,5; с мелкоклеточным раком – 9, а с крупноклеточным раком – 12 месяцев. Радикальный характер выполненной нейрохирургической операции также достоверно (р=0,001) увеличивал выживаемость. В отсутствие экстракраниальных очагов на момент обращения ОВ составила 13 месяцев, при их наличии – только 9 (р=0,027).
Проведенное лечение после нейрохирургической операции также значимо (р=0,00004) влияло на ОВ (рис. 4). Без адъювантной терапии ОВ составила лишь 5,4 месяца. В случае завершения полихимиотерапии после операции ОВ составила 7 месяцев. При проведении после операции только облучения головного мозга либо радиохирургического лечения ОВ составила 10,5 месяцев. При комплексном лечении ОВ составила 13 месяцев. В случае наличия мутации EGFR либо ALK при проведении таргетной терапии (в т.ч. в сочетании с дистанционной лучевой терапией либо радиохирургическим лечением) опухоль-специфическая выживаемость составила 24,5 месяцев. Также значимое (р=0,01) влияние на ОВ оказывала длительность безрецидивного периода.
Так, при синхронном выявлении РЛ и МГМ ОВ составила 9 месяцев. Аналогичная ОВ была при интервале менее года между выявлением первичного очага и МГМ. При безрецидивном промежутке от года до двух лет медиана ОВ составила 17, при безрецидивном промежутке более двух лет – 19 месяцев (максимальный срок безрецидивного промежутка между выявлением первичного очага и МГМ составил 240 месяцев, т.е. 20 лет).
У 10 пациентов с впервые выявленным РЛ и изолированным солитарным МГМ выполнено последовательное лечение: на первом этапе метастазэктомия из головного мозга, вторым этапом – хирургическое лечение на первичном очаге. Послеоперационной летальности не было. Медиана опухоль-специфической выживаемости составила 13,1 месяца. В одном случае выполнена симультанная операция (микрохирургическое удаление опухоли левой теменной доли и нижняя лобэктомия справа), послеоперационный период осложнился ограниченной эмпиемой плевры, купированной консервативно.
Исходя из анализа наших данных, на ОВ не оказали значимого влияния такие факторы, как количество очагов в головном мозге и вид противоопухолевого лечения до выявления МГМ.
Обсуждение и практические рекомендации
Хирургическое лечение солитарных МРМ РЛ улучшает качество жизни этой неблагоприятной прогностической группы пациентов и создает условия для их дальнейшего лечения. В случае невозможности проведения хирургического лечения при наличии очагов более 25 мм возможно использование стереотаксической радиотерапии в режиме гипофракционирования [5]. При удалении очагов можно получить морфологический материал для последующего гистологического и молекулярно-генетического исследования. Остается неоднозначным вопрос: есть ли смысл в повторном определении мутации EGFR в случае известного его статуса в первичной опухоли? Известно, что отдаленные метастазы рака молочной железы в 30% случаев имеют биологический подтип, отличающийся от первичной опухоли, ввиду ее гетерогенности.
В отношении РЛ такие данные до сих пор отсутствуют, но, вероятно, уровень экспрессии EGFR у первичной и метастатической опухоли может отличаться, в связи с чем, с нашей точки зрения, повторное молекулярно-генетическое исследование оправданно. Хирургическое лечение в отношении солитарного очага должно дополняться облучением ложа удаленной опухоли. При наличии других интракраниальных очагов применяется облучение всего объема головного мозга с бустом на контрастируемые очаги либо (при наличии олигометастазов) – стереотаксическая радиохирургия. Режим облучения всего объема головного мозга включает 14 фракций по 2,5 Гр до суммарной очаговой дозы 35 Гр или 10 фракций по 3,0 Гр до суммарной очаговой дозы 30 Гр. В дальнейшем пациент должен продолжать лечение проведением лекарственной терапии, вариант которой определяется гистологической структурой и молекулярно-генетическим подтипом опухоли. При плоскоклеточном раке в первой линии лечения применяется химиотерапия по следующей схеме: гемцитабин 1000 мг/м2 внутривенно в 1-й и 8-й дни+цисплатин 50 мг/м2 внутривенно в 1-й и 8-й дни каждые 3–4 недели.
У пожилых и ослабленных больных или при ECOG=2 в первой линии лечения может быть использован карбоплатин вместо цисплатина, AUC=5 внутривенно в 1-й день каждые 3–4 недели. При аденокарциноме легкого в первой линии лечения (без мутации EGFR без транслокации ALK) рекомендуется использовать паклитаксел 175 мг/м2 внутривенно в 1-й день+карбоплатин – AUC=5–6 внутривенно в 1-й день каждые 3 недели (в отсутствие кровоизлияний в головном мозге возможно проведение химиотерапии в сочетании с бевацизумабом 10 мг/кг внутривенно в 1-й день каждые 3 недели). Альтернативой может быть применение схемы пеметрексед 500 мг/м2 внутривенно в 1-й день+цисплатин 75 мг/м2 внутривенно в 1-й день каждые 3 недели – в первой линии лечения или монотерапии пеметрекседом 500 мг/м2 внутривенно в 1-й день каждые 3 недели (в случае невозможности применения препаратов платины). При аденокарциноме легкого (с мутацией 19-го и 21-го экзонов EGFR) рекомендуется использовать один из таргетных препаратов длительно, непрерывно, до прогрессирования или появления непереносимых побочных эффектов. Могут применяться гефитиниб 250 мг/сут или эрлотиниб 150 мг/сут внутрь ежедневно (при мутациях 19-го и 21-го экзонов EGFR); афатиниб 40 мг/сут внутрь ежедневно (при мутациях 19-го экзона EGFR). При аденокарциноме легкого (с транслокацией ALK) рекомендуется использовать кризотиниб 250 мг/сут внутрь ежедневно.
Метастатическое поражение головного мозга является чрезвычайно трудной клинической ситуацией, однако применение мультидисциплинарного подхода и современных методов инструментальной и лабораторной диагностики, а также строгое наблюдение пациента в динамике приводят к неуклонному росту общей и безрецидивной выживаемости в последние 10 лет. Хирургическое лечение создает условия для проведения системного и локального воздействия. Многие химиотерапевтические препараты плохо проникают через гематоэнцефалический барьер, в результате чего наблюдается диспропорциональный ответ на лечение, когда экстракраниальные очаги уменьшаются, а рост внутримозговых очагов ухудшает качество жизни пациента и в конечном итоге становится причиной мозговой смерти. Так, концентрация пеметрекседа в цереброспинальной жидкости составляет 0,33–1,58% от его плазменной концентрации [14], цисплатина – 3% [15]. Таргетные препараты лучше проникают через гематоэнцефалический барьер. Так, Y. Togashi и соавт. показали, что концентрация эрлотиниба в спинномозговой жидкости составляет 5,1% от его плазменной концентрации [16], для герфитиниба эта цифра ниже – 1,2%. Несмотря на низкие цифры, данные уровни превышают концентрацию полумаксимального ингибирования, приводя к клиническим ответам опухолей. Показано, что герфитиниб in vitro действует как радиомодификатор [17]. По данным van М. Vulpen и соавт., лучевая терапия помимо своих прямых эффектов повышает проницаемость гематоэнцефалического барьера для химиотерапевтических и таргетных препаратов [18]. В исследовании Y. Lu и Y. Fan пациентам с мутацией гена EGFR проведено облучение всего объема головного мозга на фоне таргетной терапии, в результате чего медиана выживаемости без церебрального прогрессирования составила 18, ОВ – 26 месяцев [19]. Таким образом, проведение комплексного лечения является единственной результативной на сегодняшний момент стратегией лечения больных РЛ с МГМ.



