Вструктуре онкологической заболеваемости в экономически развитых странах Европы и Америки колоректальный рак (КРР) составляет от 9 до 14%. Ежегодно в мире регистрируют более 1 млн 200 тыс. больных раком ободочной и прямой кишки и 700 тыс. смертных случаев от этого заболевания [1]. Так, в США в 2010 г. зарегистрировано 142 570 новых случаев КРР, из которых две трети приходятся на рак ободочной кишки [2]. В России аналогичный показатель в 2007 г. составил 54 738 [3].
Наиболее часто метастазы при КРР обнаруживают в печени, легких, паховых лимфатических узлах. Однако следует учесть тот факт, что метастазы в головном мозге в 11% случаев являются первым проявлением метастатического процесса при КРР [4].
На момент поражения головного мозга у 91,3% пациентов имеются экстракраниальные проявления заболевания, в 72,2% случаев это метастатическое поражение легких [5].
В США регистрируется до 170 тыс. новых случаев метастатических опухолей мозга ежегодно. Считается, что церебральные метастазы встречаются в 5–10 раз чаще первичных опухолей [6]. В России такие данные лишь приблизительные и составляют около 80 тыс. новых случаев в год.
Церебральные метастазы колоректального рака наряду метастазами рака легкого, молочной железы, почки, меланомы относятся к «энцефалофильным». Частота их встречаемости колеблется, по данным различных авторов, от 1–3 до 10% [7]. В головной мозг чаще метастазируют опухоли прямой, сигмовидной и нисходящей ободочной кишки. Чаще метастазы выявляются в затылочной доле и задней черепной ямке, реже – в лобной, височной долях, наиболее часто выявляются одиночные метастазы (Bartelt S., 2004).
Медиана выживаемости при метастазах КРР в головном мозге cоставляет от 4,1 до 5,4 месяца. Продолжительность жизни при проведении только симптоматической терапии стероидами составляет 1,5, при проведении облучения всего головного мозга – 4, при проведении радиохирургии – 9,5 месяцев [5]. Хирургическое вмешательство увеличивает выживаемость пациентов, а повторные операции могут продлить выживаемость. Одногодичная и двухлетняя выживаемость составляет соответственно 31,5 и 6,8% [7].
Среди факторов повышенного риска метастазирования в головной мозг Mongan отмечает такие, как опухоли толстой кишки левосторонней локализации, длительно наблюдаемые метастазы в легких, экспрессия опухолевыми клетками CXCR4. О повышенном риске метастазов в головной мозг при наличии метастазов в легких сообщает и Sundermeyer, отмечая соотношение частоты как 6,2 к 1,2% [8]. В работе Gutenberg показано, что метастазы в головном мозге при КРР имеют больше среднего хромосомных аберраций, чем первичные опухоли кишки. Поражение определенных генных областей является важной ролью в генезе энцефалотропных метастазов [9]. Схожие данные и у J. Tie, который отмечает, что мутации таких онкогенов, как PIK3CA, BRAF, KRAS, выше в легких и головном мозге, а KRAS-мутации связаны с метастазами в легких и головном мозге [10].
 В РОНЦ им. Н.Н. Блохина проведено комплексное лечение 30 пациентов с церебральными метастазами КРР. Распределение по полу было следующим: 13 мужчин и 17 женщин. Средний возраст мужчин составил 63,4 года, средний возраст женщин – 52,8 года. Средний возраст больных общей группы – 58,1 года. Из 30 пациентов 29 были прооперированы на первичном очаге. По локализации первичного очага больные расположились следующим образом (см. таблицу).
В РОНЦ им. Н.Н. Блохина проведено комплексное лечение 30 пациентов с церебральными метастазами КРР. Распределение по полу было следующим: 13 мужчин и 17 женщин. Средний возраст мужчин составил 63,4 года, средний возраст женщин – 52,8 года. Средний возраст больных общей группы – 58,1 года. Из 30 пациентов 29 были прооперированы на первичном очаге. По локализации первичного очага больные расположились следующим образом (см. таблицу).
Экстракраниальные проявления заболевания имели 84,6% пациентов. Лишь у 16,6% из них поражение головного мозга было солитарным. Чаще всего отдаленные метастазы определялись в легких (17 больных), печени (11), лимфатических узлах (5), в других органах (4 больных).
Церебральные метастазы в 10% случаев служили первым проявлением заболевания. У 43% пациентов метастазы в головной мозг были первыми отдаленными метастазами. Чаще всего церебральные метастазы наблюдались в задней черепной ямке и теменной доле, несколько реже – в височной и затылочной, реже всего – в лобной доле. Закономерность со стороной локализации выявлена не была.
По размерам чаще наблюдались метастазы от 21 до 40 мм. Несколько реже – свыше 41 мм в диаметре. По количеству очагов подавляющее большинство было единичным (21 случай), два очага наблюдались в 8 случаях.
Всем пациентам было выполнено хирургическое вмешательство по удалению метастатического узла. Только удаление метастаза было проведено 15 пациентам. Комплексное лечение с включением химиолучевой терапии проведено 8 пациентам; 2 пациентам операция была дополнена лучевой терапией, 5 – различными режимами химиотерапии.
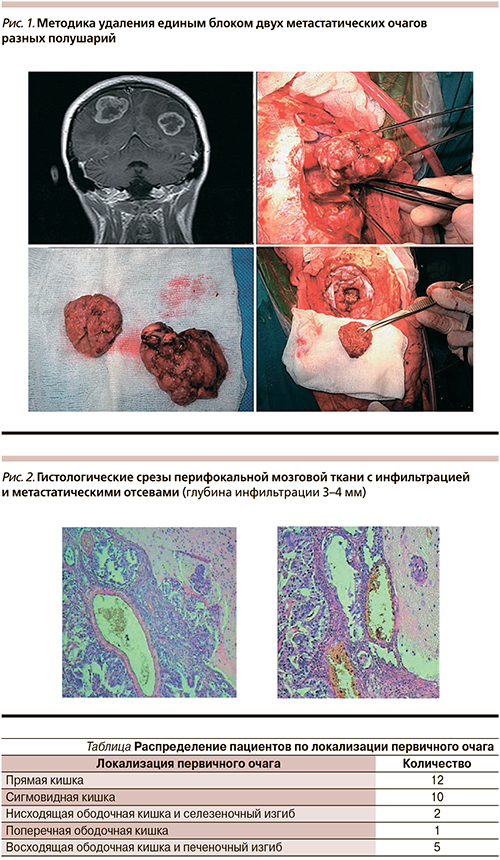
Среди всех пациентов 17 были оперированы в РОНЦ. При удалении церебральных метастазов использовалась методика блокового удаления в отношении 13 пациентов (рис. 1). К четверым применена методика тотального фрагментирования. При исследовании перифокальной мозговой ткани (при полюсной ампутации) отмечено, что инфильтрация мозговой ткани и отсевы определились на глубине до 3–4 мм (рис. 2). Захват такой толщины мозговой ткани во время удаления метастатического узла позволяет значительно снижать вероятность локального рецидива. Так, частота локальных рецидивов у пациентов, оперированных в РОНЦ, составила 5,8%, у пациентов, оперированных в других учреждениях, – 61,5%, что более чем в 10 раз превышает показатели РОНЦ.
Химиолучевое лечение в послеоперационном периоде: в 6 из 8 случаев комплексного лечения использована комбинация капецитабина с лучевой терапией локально и на весь головной мозг. В одном случае применен Фторафур с лучевой терапией. В другом – темозоломид с лучевой терапией. В случае когда операция дополнялась проведением химиотерапии, использовались следующие препараты и комбинации: 1) ралтитрексид; 2) ралтитрексид+капецитабин; 3) схема химиотерапии XELOX; 4) иринотекан+ломустин.
К факторам благоприятного прогноза относятся следующие: 1) единичные метастазы (до 3) в головном мозге; 2) контролируемые экстракраниальные очаги; 3) отсутствие рецидива первичной опухоли; 4) резервы лекарственного лечения; 5) индекс Карновского свыше 60%; 6) отсутствие грубой соматической патологии.
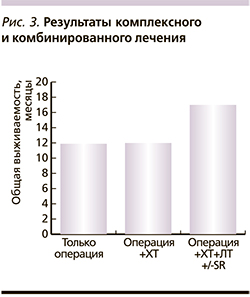
Наилучший показатель общей выживаемости был достигнут при проведении комплексного и комбинированного лечения и составил 17,3 месяца.
При проведении только операции общая выживаемость составила 13 месяцев (рис. 3), 1-годичная выживаемость – 54,1%; 2-годичная – 25%; 3-, 4-годичная выживаемость – 8,3%. В причинах летальности на первом месте стоят экстракраниальные проявления заболевания. Интракраниальные причины отмечены лишь в 7 случаях из 30.
Проведенное исследование позволило сделать следующие выводы:
- Проведение комплексного лечения при церебральных метастазах КРР увеличивает общую выживаемость до 17,3 месяца.
- Локальные рецидивы в головном мозге не уменьшают общую выживаемость, хотя существенно снижают качество жизни.
- При блоковом удалении частота локальных рецидивов меньше более чем в 10 раз.
- Использование химиолучевого лечения в послеоперационном периоде увеличивает общую выживаемость.
- Продолжительность жизни в большинстве случаев определяется экстракраниальным прогрессированием.


