Дисциркуляторная энцефалопатия (ДЭ) – синдром, включающий комплекс субъективных и объективных признаков, возникающих вследствие хронической недостаточности кровоснабжения мозга, который характеризуется постепенно нарастающими изменениями симптоматики и структурными изменениями головного мозга.
Довольно часто в качестве синонимов ДЭ используют такие термины, как хроническая ишемия мозга, церебральный атеросклероз, гипертензивная энцефалопатия, сосудистая деменция и прочие.
ДЭ является не самостоятельным заболеванием, а проявлением чаще всего таких заболеваний, как артериальная гипертензия (АГ), атеросклероз или их сочетание. Сахарный диабет, сердечная недостаточность также могут вносить неблагоприятный вклад в развитие и течение ДЭ.
При ишемии/гипоксии мозга прежде всего нарушается структурно-функциональное взаимодействие между нейронами и питающими их сосудами, следствием чего является развитие дисфункции «нейроваскулярной единицы», объединяющей астроциты, нейроны, глиальные клетки, перициты, эндотелиоциты и другие клетки мелких сосудов. В основе подобных изменений лежат поражение базальной мембраны, увеличение ее проницаемости, повреждение эндотелиальных клеток и разрушение межэндотелиальных связей, активация внеклеточных металлопротеиназ. Важную роль в этих процессах играют радикалы кислорода, продуцируемые клетками сосудов и нейронами. В результате взаимодействия супероксид-аниона с оксидом азота биодоступность последнего снижается, сужается просвет сосудов, увеличивается их сопротивление, уменьшается кровоток, усиливается ишемия. Образовавшийся пероксинитрит оказывает цитотоксическое воздействие на нейроны, клетки микроокружения, эндотелиальные клетки. Это приводит к нарушению ауторегуляции мозгового кровообращения и регуляции проницаемости гематоэнцефалического барьера. Экстравазация компонентов плазмы крови в стенку сосудов, а также прилегающие области головного мозга вызывает утолщение и дезинтеграцию стенки мелких мозговых сосудов (артерий и артериол), периваскулярный отек и поражение белого вещества мозга. Микроангиопатия приводит к диффузному или многоочаговому поражению головного мозга. В результате повреждения проводящих путей в белом веществе головного мозга происходит разобщение корковых (особенно лобных) и подкорковых структур, что обусловливает нарушение двигательных и психических функций.
Таким образом, именно нарушению межклеточного взаимодействия нейроваскулярных единиц приписывают основную роль в развитии патологических изменений при ДЭ. Диагностические трудности в начале заболевания обусловлены неспецифическими жалобами и малозначимыми объективными признаками.
В дальнейшем по мере прогрессирования заболевания признаки становятся более отчетливыми и при инструментальном обследовании выявляются более грубые признаки структурного поражения головного мозга. Следует помнить, что появление даже первых жалоб и выявление нарушений координации, неравномерности сухожильных рефлексов, признаков орального автоматизма при наличии АГ и атеросклероза сосудов головного мозга могут быть ранним проявлением ДЭ, что требует проведения соответствующих терапевтических мероприятий.
Выделяют три стадии в течении ДЭ:
- I – легкую или умеренную (стадия компенсации);
- II – выраженную (стадия субкомпенсации);
- III – резко выраженную (стадия декомпенсации).
При I стадии заболевания больные могут предъявлять жалобы на головную боль, головокружение, шум в ушах, что часто встречается и у пациентов, страдающих АГ и без признаков энцефалопатии. Однако головная боль при ДЭ не имеет четкой взаимосвязи с изменением артериального давления (АД). Характерны астенические жалобы (снижение работоспособности, повышенная утомляемость, нарушения сна). Появляются легкие когнитивно-мнестические нарушения: снижение оперативной памяти, способности запоминать и выполнять некоторые действия бытового характера, не связанные с профессиональной деятельностью. Возникает раздражительность, может развиваться депрессия. При этом симптомы часто усиливаются после напряженной или длительной работы к вечеру и проходят после отдыха. Как уже упоминалось, при неврологическом обследовании могут выявляться легкие расстройства, в частности глазодвигательных рефлексов, нарушение координации, неравномерность сухожильных рефлексов, признаки орального автоматизма.
Во II стадии заболевания количество и выраженность жалоб уменьшаются и неврологическая симптоматика становится отчетливо выраженной. Для этой стадии характерны нарушения двигательной активности: движения становятся маловыразительными, замедленными, нарушается их координация, появляется мелкоразмашистый тремор. Доминирующие неврологические синдромы: пирамидный, дискоординаторный, амиостатический. Нарастают когнитивные нарушения.
При III стадии объективная неврологическая симптоматика преобладает над субъективными проявлениями. Когнитивные нарушения достигают степени реальной деменции и сопровождаются аффективными и поведенческими нарушениями (грубым снижением критики, апатико-абулическим синдромом, расторможенностью, «взрывным» характером). Развиваются выраженные двигательные расстройства, нарушения ходьбы и постурального равновесия. Могут возникать падения, обмороки и генерализованные судорожные припадки. Следует отметить, что при АГ и гипертонической энцефалопатии риск развития деменции возрастает на 45% по сравнению с таковым у пациентов с АГ без ДЭ [1] и в 2 раза возрастает риск развития эпилепсии [2]. В этой стадии ДЭ пациенты теряют не только трудоспособность, но и способность к самостоятельному функционированию. Характерны те же неврологические синдромы, что и при II стадии, но их инвалидизирующее влияние существенно возрастает.
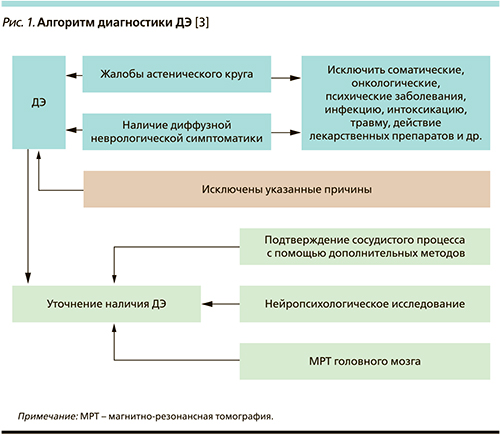
Таким образом, диагностический алгоритм для ДЭ можно представить следующим образом (рис. 1) [3].
Современные методы исследования (компьютерная или магнитно-резонансная томография) позволяют визуализировать изменения в головном мозге на разных стадиях ДЭ (табл. 1).
При проведении компьютерной томографии на I стадии может не быть явных изменений либо выявляются минимальные признаки атрофии мозга и незначительно выраженный лейкоареоз (снижение плотности белого вещества); во II стадии – мелкие очаги пониженной плотности, расширение желудочковой системы и борозд полушарий в связи с атрофическим процессом, в III стадии – множественные очаги различного размера в полушариях: постишемические кисты вследствие перенесенного лакунарного инсульта; выраженная атрофия коры больших полушарий и гиппокампа, выраженный лейкоареоз.
Поскольку развитие ДЭ не только снижает качество жизни людей, но и приводит к инвалидизирующим расстройствам, правильное лечение имеет большое не только медицинское, но и социальное значение.
Лечение при ДЭ
Основные задачи терапии могут быть сформулированы следующим образом:
- коррекция факторов риска развития ДЭ и деменции;
- предупреждение развития транзиторных ишемических атак и инсультов;
- уменьшение темпов прогрессирования ДЭ, развития и прогрессирования деменции;
- устранение или уменьшение выраженности неврологических и психических проявлений заболевания.
Главное, что на ранних стадиях заболевания можно решать поставленные задачи, переход к более тяжелым стадиям снижает эффективность проводимых мероприятий.
В первую очередь речь идет об адекватной терапии состояний – основных причин развития ДЭ: АГ, дислипидемии, сахарного диабета. Однако в отношении лечебной тактики существует много противоречивых данных и постоянно обсуждаются не только позитивные, но и, возможно, отрицательные эффекты проводимой терапии, в частности на когнитивные функции (КФ), скорость наступления деменции. В связи с чем необходимо остановиться на этом несколько подробнее.
Терапия, направленная на уменьшение проявлений атеросклероза
В настоящее время найдены неоспоримые свидетельства того, что интенсивная терапия статинами снижает риск развития макрососудистых сердечно-сосудистых осложнений (инфаркта миокарда, инсультов) как в первичной [4], так и во вторичной профилактике [5]. При этом многие из положительных эффектов связывают не только и не столько с гиполипидемическим эффектом, сколько с плейотропными эффектами статинов, в частности со снижением процессов воспаления, оксидативного стресса и др. [6]. Мета-анализ наблюдательных исследований показал, что люди, принимающие статины, страдают более низким риском развития деменции [7]. В краткосрочных клинических исследованиях не найдено влияния статинов на изменения КФ. В длительно продолжавшихся исследованиях (23 443 пациента, наблюдавшихся в среднем 3,0–24,9 года) снижение частоты случаев возникновения деменции составило 29% (отношение шансов [ОШ]=0,71, 95% доверительный интервал [ДИ] – 0,61–0,82) [8]. Это подтверждают и позже проведенные анализы [9].

В то же время прием статинов не оказывает лечебного действия на пациентов с болезнью Альцгеймера [10]. Авторы этого Кокрановского обзора указывают, что отсутствуют публикации, посвященные лечению статинами сосудистой деменции.
Терапия, направленная на нормализацию АД
АГ сама по себе значимо нарушает КФ и ведет к развитию ДЭ [11]. Причем увеличение риска развития деменции связано как с уровнем АД в течение суток, так и с выраженностью ночной гипертензии, величиной пульсового давления (как большой, так и малой), вариабельностью АД, величиной его утреннего подъема. Многие исследования доказали, что антигипертензивная терапия снижает риск развития инсультов, однако оценка ее влияния на ДЭ неоднозначна. Так, в проспективном исследовании CSHA (Canadian Study of Health and Aging) [12] в течение 5 лет оценивали связь между применением антигипертензивных препаратов различных групп и КФ у людей старше 65 лет. Показано, что использование блокаторов кальциевых каналов чаще, чем прием препаратов других групп, приводило к снижению КФ (75 против 59%). ОШ значительного снижения КФ, оцененное как снижение индекса по Modified Mini-Mental State на 10 и более пунктов, составило для людей, использующих блокаторы кальциевых каналов, 2,28 (95% ДИ – 1,12–4,66) относительно β-адреноблокаторов. Однако с учетом других переменных показано, что лишь использование недигидропиридиновых блокаторов кальциевых каналов увеличивало частоту развития когнитивного дефицита у пожилых людей – ОШ=3,72 (95% ДИ – 1,22–11,36). В то же время мета-анализ 14 наблюдательных исследований (32 658 человек, принимавших антигипертензивные препараты, и 36 905 не получавших антигипертензивной терапии) показал, что прием антигипертензивных препаратов значимо снижает риск развития любого типа деменции (относительный риск [ОР]=0,87, 95% ДИ – 0,77–0,96) и сосудистой деменции (ОР=0,67, 95% ДИ – 0,52–0,87), однако не снижает риска деменции, обусловленной болезнью Альцгеймера, и степени ее выраженности [13]. С другой стороны, в систематическом обзоре, созданном Кокрановским союзом [14], объединившим данные о 12 091 пациенте с АГ в трех крупных исследованиях, не установлено значимого влияния антигипертензивной терапии на риск развития деменции. Снижение риска развития деменции составило 11% (ОР=0,89; 95%ДИ – 0,69–1,16) и не было статистически значимым, несмотря на достоверное снижение АД у лиц пожилого возраста, ранее не страдавших снижением КФ.
Полагают, что одной из причин разноречивости полученных данных в рандомизированных клинических исследованиях может быть использование различных групп антигипертензивных препаратов. Так, тиазидоподобные диуретики, несмотря на снижение АД и риска инсульта, не приводили к протективному эффекту в отношении деменции [15, 16].
 В большинстве исследований получены данные, свидетельствующие о том, что блокаторы кальциевых каналов могут снижать частоту деменций у пациентов с АГ. Так, в исследовании Vascular Dementia Project of the Syst-Eur trial в группе пожилых людей с изолированной систолической АГ, получавших активную терапию нитрендипином, частота случаев деменции была ниже, чем у получавших плацебо [17] По данным Кокрановского обзора [18], нимодипин приводит к высокодостоверному (р<0,00001) уменьшению изменений по сравнению с плацебо по шкале SCAG (Sandoz Clinical Assessment Geriatric) в общем клиническом состоянии и КФ. Это подтверждает и исследование [19], где было показано, что блокаторы кальциевых каналов замедляют снижение КФ примерно на 0,4 балла в год (шкала MMSE – Mini-mental State Examination, p=0,001). Другие антигипертензивные препараты не обладали подобным эффектом. Активное лечение ингибиторами ангиотензинпревращающего фермента и диуретиками (более 3 лет) уменьшало частоту нарушений КФ и уменьшало прогрессирование деменции женщин старше 70 лет [20].
В большинстве исследований получены данные, свидетельствующие о том, что блокаторы кальциевых каналов могут снижать частоту деменций у пациентов с АГ. Так, в исследовании Vascular Dementia Project of the Syst-Eur trial в группе пожилых людей с изолированной систолической АГ, получавших активную терапию нитрендипином, частота случаев деменции была ниже, чем у получавших плацебо [17] По данным Кокрановского обзора [18], нимодипин приводит к высокодостоверному (р<0,00001) уменьшению изменений по сравнению с плацебо по шкале SCAG (Sandoz Clinical Assessment Geriatric) в общем клиническом состоянии и КФ. Это подтверждает и исследование [19], где было показано, что блокаторы кальциевых каналов замедляют снижение КФ примерно на 0,4 балла в год (шкала MMSE – Mini-mental State Examination, p=0,001). Другие антигипертензивные препараты не обладали подобным эффектом. Активное лечение ингибиторами ангиотензинпревращающего фермента и диуретиками (более 3 лет) уменьшало частоту нарушений КФ и уменьшало прогрессирование деменции женщин старше 70 лет [20].
Некоторые данные свидетельствуют, что сартаны (кандесартан, валсартан, телмисартан) в большей степени, чем другие препараты (лизиноприл и гидрохлоротиазид), могут улучшать КФ, в частности, у пожилых пациентов с АГ [21–23].
Как видно из приведенных данных, основные результаты антигипертензивной терапии оценивают влияние на КФ, но не на неврологические симптомы.
Следует учитывать, что возникающие при ДЭ изменения КФ и депрессия могут снижать приверженность пациентов проводимой антигипертензивной и другой терапии.
Вазоактивная и метаболическая терапия
Для уменьшения темпов прогрессирования ДЭ патогенетически обосновано применение препаратов, улучшающих мозговой кровоток и метаболизм в мозговой ткани. Эти лекарственные средства способны влиять на выраженность неврологических и психических нарушений при ДЭ. Следует подчеркнуть, что препараты, улучшающие мозговой кровоток и нейрональный метаболизм, потенциально более эффективны на ранних стадиях ДЭ.
Для улучшения мозгового кровотока используют препараты различных групп, которые оказывают сосудорасширяющее действие:
1. Ингибиторы фосфодиэстеразы:
Эуфиллин и пентоксифиллин – за счет увеличения содержания цАМФ в гладкомышечных клетках сосудистой стенки, блокируют аденозиновые (пуриновые) рецепторы; снижают поступление ионов кальция через каналы клеточных мембран, уменьшают сократительную активность гладкой мускулатуры, что приводит к расслаблению сосудов и увеличению их просвета. Эти препараты тормозят агрегацию тромбоцитов, подавляя фактор активации тромбоцитов и простагландин E2-альфа, повышают устойчивость эритроцитов к деформации и тем самым приводят к улучшению реологических свойств крови, уменьшают тромбообразование и нормализуют микроциркуляцию. При ДЭ эти препараты уменьшают головокружение, головную боль, нарушения памяти и сна.
Их следует с осторожностью использовать пациентам с поражением сердца, особенно при остром коронарном синдроме, сердечной недостаточности. Могут увеличивать эффекты антигипертензивных препаратов, антикоагулянтное действие гепарина и фибринолитических препаратов.
Винпоцетин ингибирует Ca2+-кальмодулинзависимую цГМФ-фосфодиэстеразу, повышает содержание катехоламинов (дофамина и норадреналина), увеличивает активность аденилатциклазы, уровни аденозинмонофосфата (АМФ) и циклического гуанозинмонофосфата (цГМФ) головного мозга. Повышает концентрацию АТФ в тканях головного мозга. Снижает функциональную активность клеточных трансмембранных натриевых и кальциевых каналов, глутаматных рецепторов N-метил-D-аспартат и α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (NMDA и AMPA). расслабляет гладкую мускулатуру сосудов головного мозга, увеличивает церебральный кровоток без существенного изменения показателей системного кровообращения. Причем происходит улучшение кровоснабжения, главным образом ишемизированных участков мозга, отсутствует эффект «обкрадывания». Препарат улучшает транспорт энергетических субстратов к тканям, увеличивает поглощение глюкозы, усиливает аэробный гликолиз и улучшает переносимость гипоксии клетками головного мозга. Оказывает антиоксидантное действие, уменьшает вязкость крови за счет снижения агрегации тромбоцитов и деформируемости эритроцитов. Обладает нейропротекторной активностью и усиливает нейропротекторное действие аденозина.
2. Блокаторы кальциевых каналов оказывают вазодилатирующий эффект благодаря уменьшению внутриклеточного содержания ионов кальция (Ca2+) в гладкомышечных клетках сосудистой стенки:
Циннаризин – селективный блокатор медленных кальциевых каналов прямо снижает тонус гладкой, мускулатуры артериол и уменьшает их реакцию на биогенные вещества (адреналин, норадреналин, дофамин, ангиотензин, вазопрессин). Обладает сосудорасширяющим эффектом (особенно в отношении сосудов головного мозга), не оказывая существенного влияния на АД. Проявляет умеренную антигистаминную активность, уменьшает возбудимость вестибулярного аппарата, понижает тонус симпатической нервной системы. Повышает эластичность мембран эритроцитов, их способность к деформации, снижает вязкость крови.
Флунаризин действует подобно циннаризину. Улучшает мозговое кровообращение и кислородное обеспечение мозга; уменьшает вестибулярные расстройства (нарушение координации движений). Оказывает противосудорожное действие и уменьшает частоту приступов при эпилепсии.
Нимодипин преимущественно влияет на сосуды головного мозга, нормализует мозговое кровоснабжение, увеличивает толерантность нейронов к ишемии, стабилизирует функции нервных клеток.
3. Альфа1-адреноблокатор ницерголин оказывает сосудорасширяющее действие, устраняя сосудосуживающее действие медиаторов симпатической нервной системы – адреналина и норадреналина. Помимо этого ницерголин улучшает метаболические и гемодинамические процессы в головном мозге, снижает агрегацию тромбоцитов и улучшает реологические свойства крови, оказывает прямое воздействие на церебральные нейротрансмиттерные системы – адренергическую, дофаминергическую и холинергическую, увеличивая их активность, что способствует оптимизации когнитивных процессов, уменьшает выраженность поведенческих нарушений, связанных с деменцией.
Определенный интерес представляет использование комбинированного препарата Вазобрала, содержащего α-дигидроэргокриптин – дигидрированное производное спорыньи, блокирующее α1- и α2-адренорецепторы, а также кофеин. Таким образом, препарат оказывает дофаминергическое, серотонинергическое действия, уменьшает агрегацию тромбоцитов и эритроцитов, снижает проницаемость сосудистой стенки, увеличивает количество функционирующих капилляров, улучшает кровообращение и процессы метаболизма в головном мозге, повышает устойчивость тканей мозга к гипоксии и обладает психостимулирующим и аналептическим действиями, усиливает процессы возбуждения в коре головного мозга (повышает умственную и физическую работоспособность, уменьшает усталость и сонливость, улучшает память в отношении недавних событий, внимание, уменьшает расстройства ориентации).
Для уменьшения выраженности неврологических симптомов и синдромов ДЭ, а также когнитивных нарушений используют препараты, улучшающие метаболизм в головном мозге и оказывающие нейропротективное действие:
1. ГАМКергические препараты:
Гамма-аминомасляная кислота (ГАМК) – биогенный амин, содержащийся в центральной нервной системе и принимающий участие в нейромедиаторных и метаболических процессах мозга. ГАМК служит основным медиатором, участвующим в процессах центрального торможения в результате взаимодействия со специфическими ГАМКергическими рецепторами. Под влиянием препарата восстанавливаются процессы метаболизма головного мозга: активируются энергетические процессы, улучшается утилизация глюкозы, повышается дыхательная активность тканей, улучшается кровоснабжение. ГАМК способствует удалению токсических продуктов обмена, обеспечивает нормализацию динамики нервных процессов. Повышает продуктивность мышления, улучшает память, оказывает мягкое психостимулирующее действие. Близким эффектом обладает ноотропный препарат пирацетам, который усиливает в мозге синтез дофамина, повышает содержание норадреналина, отчасти влияет на ГАМКергические рецепторы, увеличивает количество ацетилхолина на синаптическом уровне и плотность холинорецепторов. Стимулирует окислительно-восстановительные процессы, увеличивает утилизацию глюкозы, улучшает регионарный кровоток в ишемизированных участках мозга, увеличивает энергетический потенциал организма при участии АТФ и аденилатциклазы. Пирацетам, так же как и другие ноотропы, повышает устойчивость центральной нервной системы к гипоксии, улучшает интегративную деятельность мозга, способствует консолидации памяти, улучшает процессы обучения. Аналогичное действие может оказывать пиридитол.

2. Пептидергические препараты и аминокислоты:
Церебролизин содержит низкомолекулярные, биологически активные нейропептиды, которые представляют собой фрагменты ряда нейротрофических факторов головного мозга (цилиарного нейротрофического фактора – CNTF, глиального нейротрофического фактора – GDNF, инсулинового фактора роста-1 IGF-1 и инсулинового фактора роста-2 IGF-2), проникающих через гематоэнцефалический барьер и непосредственно поступающих к нервным клеткам. Препарат обладает органоспецифическим полимодальным действием на головной мозг, т.е. обеспечивает метаболическую регуляцию, нейропротекцию, функциональную нейромодуляцию и нейротрофическую активность. Повышает эффективность аэробного энергетического метаболизма головного мозга, улучшает внутриклеточный синтез белка в развивающемся и стареющем головном мозге. Препарат защищает нейроны от повреждающего действия лактоацидоза, предотвращает образование свободных радикалов, повышает выживаемость и предотвращает гибель нейронов в условиях гипоксии и ишемии, снижает повреждающее нейротоксическое действие возбуждающих аминокислот (глутамата). Оказывает положительный эффект на клинико-психический статус больных ДЭ, что подтверждено положительной динамикой показателей электроэнцефалографии, оказывает положительное влияние при нарушениях КФ, на процессы запоминания.
Выраженным ноотропным эффектом обладает эндогенный регулятор функции центральной нервной системы Семакс – синтетический гептапептид, аналог фрагмента АКТГ 4–10 (метионил-глутамил-гистидил-фенилаланил-пролил-глицил-пролин), лишенный гормональной активности. Стимулируя функцию переднего мозга, он усиливает избирательное внимание в момент восприятия информации, улучшает консолидацию памяти, повышает способность к обучению. Препарат оказывает также антиоксидантный и антигипоксический эффекты.
Довольно широко в клинической практике используют пептидный биорегулятор функций головного мозга: Кортексин в комплексной терапии больных ДЭ I–II стадий способствует улучшению функций внимания, восприятия, памяти и мышления, а также нормализации корковых нейродинамических процессов.
Препараты, влияющие на обменные процессы в клетках мозга:
Улучшение метаболических процессов (снабжение мозга кислородом и глюкозой), антигипоксантное действие на ткани, снижение оксидативного стресса за счет уменьшения образования свободных радикалов и перекисного окисления липидов клеточных мембран показано у препарата Танакан – стандартизованного препарата растительного происхождения (Ginkgo Bilobae foliorum extract). Танакан воздействует также на высвобождение, обратный захват и катаболизм нейромедиаторов (норадреналина, ацетилхолина, дофамина и серотонина) и их способность к связыванию с мембранными рецепторами. В сочетании с улучшением вазомоторных реакций нормализует тонус артерий и вен, улучшает микроциркуляцию, реологические свойства крови, способствует улучшению кровотока, препятствует агрегации эритроцитов, тормозящей влияние на фактор активации тромбоцитов. Препарат улучшает когнитивный дефицит.
Для коррекции когнитивных нарушений используют также антагонист глутаматных N-метил-D-аспартат-рецепторов Акатинол Мемантин, уменьшающий оксидативный стресс и процессы эксайтотоксичности (повреждение и гибель нервных клеток под воздействием нейромедиаторов, L-глутамата и других веществ).
Цитиколин – естественный эндогенный нуклеозид, состоящий из цитидина и холина, связанных дифосфатным мостиком, который и участвует в синтезе мембранных фосфолипидов в качестве промежуточного звена. Восстановление клеточных мембран или уменьшение их повреждения происходит также за счет снижения синтеза фосфолипазы А2 и уменьшения накопления свободных жирных кислот, нормализации функции Na+/K+-АТФазы, усиления активности антиоксидантных систем, снижения окислительного стресса. Происходит улучшение холинергической, дофамин- и глутаматергической нейротрансмиссии. Препарат обладает выраженным нейрорепаративным эффектом, уменьшая апоптоз клеток, стимулируя процессы нейро- и ангиогенеза. При хронической гипоксии головного мозга цитиколин эффективен в лечении когнитивных расстройств, таких как ухудшение памяти, безынициативность, затруднения, возникающие при выполнении повседневных действий и самообслуживании. Повышает уровень внимания и сознания, а также уменьшает проявление амнезии.
Актовегин – депротеинизированный гемодериват крови телят, в своем составе содержит более 200 компонентов. Воздействует на массу биохимических путей, оказывает многие плейотропные нейропротективные и метаболические влияния. Актовегин увеличивает утилизацию пирувата (метаболита глюкозы) в митохондриях, снижает образование лактата, стимулирует потребление кислорода, восстанавливает ионный гомеостаз, оптимизирует энергетический обмен (синтез АТФ и образование фосфокреатина), приводит к стабилизации плазматических мембран клеток при ишемии. Актовегин обладает инсулиноподобным действием – активирует аэробный гликолиз, т.е. переводит клетку на более выгодный путь утилизации глюкозы: потребление глюкозы клеткой возрастает в 5, а потребление кислорода клеткой возрастает в 6–7 раз. Таким образом, Актовегин обладает антигипоксическим действием, которое начинает проявляться самое позднее через 30 минут после парентерального введения и достигает максимума в среднем через 3 часа (2–6 часов). Актовегин благоприятно сказывается на биологических эффектах аминокислот – глутамата, аспартата и ГАМК. Актовегин не только влияет на клеточный метаболизм, но и улучшает состояние микроциркуляции.
При ДЭ обладает многочисленными свойствами: снижает вестибуломозжечковые расстройства (головокружение, шум в голове и ушах, неуверенность координации, улучшает КФ), способствует улучшению качества жизни, повышению социальной активности. Об этом свидетельствует ряд клинических исследований, проведенных в соответствии с современными требованиями. Так, в двойном слепом плацебо-контролируемом исследовании показано, что прием внутрь пожилыми больными в течение 12 недель значимо улучшал мнестико-интеллектуальные функции (память, синтетические и аналитические способности, концентрацию внимания, запоминание) [24]. В многоцентровом исследовании 1549 пациентов пожилого возраста показано, что терапия Актовегином (2 недели внутривенных инъекций 10 мл раствора Актовегина, а затем 4 недели перорального приема таблеток Актовегина, покрытых оболочкой, по 2 таблетки 3 раза в сутки) улучшала общее состояние: уменьшались (или прекращались) головная боль, головокружение, беспокойство и чувство страха, улучшалась память и концентрация внимания (по данным психологического тестирования) [25]. Аналогичные данные получены и в других исследованиях [26].
Опубликован дизайн исследования АРТЕМИДА, целью которого стало установить влияние Актовегина на когнитивные нарушения у пациентов, перенесших инсульт [27].
За последние годы большое внимание уделяют выяснению механизмов защитного действия этого препарата. Известно, что многие нейродегенеративные заболевания сопровождаются гибелью нейронов по механизму некроза и апоптоза. В случае некроза наблюдается воспалительная реакция, связанная с участием провоспалительных клеток и цитокинов. К ним в центральной нервной системе относят клетки микроглии и фагоциты крови.
На первичных культурах нейронов крыс установлено [28], что Актовегин тормозит гибель нейронов в условиях in vitro и сохраняет синаптические связи между нейронами. Помимо этого Актовегин дозозависимым образом снижает апоптоз таких нейронов. Эти защитные свойства Актовегина тесно связаны со снижением генерации радикалов кислорода, образование которых индуцировали в нейронах амилоидным десяти-аминокислотным пептидом Aβ-(25-35), а также уменьшением уровня активных форм кислорода в цитоплазме этих клеток [28].
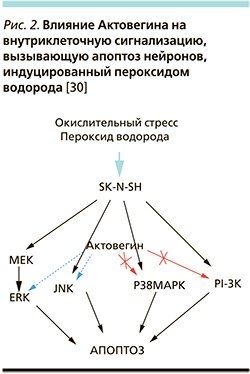
В нашей лаборатории на перевиваемых нейронах человека линии SK-N-SH было показано, что Актовегин уменьшал гибель клеток, индуцированную пероксидом водорода.
Это защитное действие Актовегина сопровождалось уменьшением уровня внутриклеточных радикалов кислорода и выраженным снижением апоптоза нейронов [29]. Развитие апоптоза нейронов контролируют различные внутриклеточные сигнальные пути. С помощью ингибиторов митоген-активируемых протеинкиназ (p38MAPK), экстраклеточных регуляторных киназ (ERK), фосфатидилинозитол-3 киназы (PI-3K) и с-Jun-N-терминальной киназы (JNK) нами впервые показано (рис. 2), что в механизме защитного действия Актовегина в отношении пероксид-индуцированного апоптоза клеток SK-N-SH доминантная роль принадлежит двум протеинкиназам: p38 MAPK и PI-3K [30]. Также на образцах цельной крови пациентов с сердечной недостаточностью II–III функциональных классов по NYHA показано, что Актовегин дозозависимым образом эффективно подавляет одно из наиболее важных проявлений системного воспаления – генерацию радикалов кислорода фагоцитами крови, индуцированную формилпептидом или форболовым эфиром, а благодаря антиоксидантным свойствам удаляет уже образовавшиеся радикалы кислорода [31, 32].
Таким образом, Актовегин корригирует энергетический обмен, оказывает антиоксидантное действие, подавляет воспалительные реакции, влияет на нейроны, клетки сосудов и клетки крови, сохраняет синаптические связи между нейронами, сохраняет целостность и улучшает функционирование «нейроваскулярных единиц».
Следует отметить, что использование нейропротективных препаратов с различным механизмом действия может увеличивать эффективность лечения. В частности, оптимальным с точки зрения эффективности считают сочетанное применение цитиколина и Актовегина (табл. 2) в условиях ишемии головного мозга.
В заключение необходимо еще раз следует подчеркнуть, что терапия наиболее эффективна при I и II стадиях заболевания.



