По данным Всемирной организации здравоохранения, сердечно-сосудистые заболевания (ССЗ), в частности артериальная гипертензия (АГ), являются наиболее частой причиной инвалидности и смертности среди взрослого населения во всем мире, в т.ч. и в Российской Федерации [1].
Согласно рекомендациям Российского медицинского общества по артериальной гипертонии (2010) [2] и Европейским рекомендациям (2013) по диагностике и лечению АГ [3], пациентам с высоким и очень высоким риском уже на старте лечения показано назначение фиксированных комбинаций (ФК) антигипертензивных препаратов (АГП). Таким образом, в настоящее время актуален не вопрос предпочтительности моно- или комбинированной терапии, а вопрос выбора наиболее эффективной комбинации АГП с точки зрения их антигипертензивного и органопротективного влияний.
Несмотря на то что классические факторы риска (ФР) играют важную роль, необходимы новые подходы к пониманию развития ССЗ для более точной оценки прогноза, повышения эффективности профилактических мероприятий и индивидуализации лечения. В связи с этим следует отметить, что в настоящее время появились новые ФР, к числу которых относятся жесткость миокарда [4, 5], вариабельность артериального давления (АД) [6], отражающая жесткость артерий, и пульсовое давление (ПД) [3, 7].
В последние годы благодаря результатам исследований ASCOT-BPLA (Anglo– Scandinavian Cardiac Outcomes Trial–Blood Pressure Lowering Arm) [8] и ACCOMPLISH (The Avoiding Cardiovascular Events through Combination Therapy in Patients Living with Systolic Hypertension) [9] широкое распространение получили ФК ингибитора ангиотензинпревращающего фермента (иАПФ) и дигидропиридинового блокатора кальциевых каналов. Первой такой зарегистрированной в России комбинацией стала ФК лизиноприла и амлодипина (ФК А/Л) – препарат Экватор® (Гедеон Рихтер, Венгрия). Однако действие данной ФК на параметры ригидности левого предсердия (ЛП), левого желудочка (ЛЖ) и вышеуказанные «новые» ФР изучены недостаточно.
В свете вышеизложенного нами было проведено исследование, одной из целей которого стала оценка антигипертензивных и органопротективных свойств ФК А/Л, в частности ее влияние на показатели жесткости миокарда ЛП и ЛЖ и выраженность гипертрофии ЛЖ (ГЛЖ) у нелеченых пациентов с гипертонической болезнью (ГБ) II стадии 1–2-й степеней в возрасте 45–65 лет без сопутствующих ССЗ. И в связи с этим хотелось бы привести следующий клинический случай.
Клинический случай
Больной П. 58 лет. Жалобы на момент обращения на головные боли преимущественно в вечернее время давящего, пульсирующего характера, повышенную утомляемость.
Анамнез заболевания: около 5 лет страдал ГБ. Лечился нерегулярно, в течение последнего года при повышении АД принимал блокатор рецепторов к ангиотензину II лозартан. Со слов больного, не наблюдал эффекта от назначенной терапии, сохранялись повышенные цифры АД при офисном измерении, жалоб при этом не было, поэтому самостоятельно бросал принимать АГП. Ухудшение самочувствия отметил примерно около 2 месяцев назад, когда появились выраженные давящие, иногда пульсирующие головные боли преимущественно в вечернее время, а также на фоне стресса, повысилась утомляемость. При самостоятельном измерении АД составляло около 160/100 мм рт.ст., пульс – 65–70 уд/мин.
Анамнез жизни: перенесенные заболевания: в детском возрасте – детские инфекционные заболевания, в зрелом возрасте – хронический гастрит. Операции: аппендэктомия. Женат, имеет взрослого сына. Аллергологический анамнез не отягощен. Не курит, никогда не курил, алкоголем, со слов пациента, не злоупотребляет. Профессиональные вредности отрицает, работает водителем. Наследственность: отец имел ГБ.
При объективном осмотре: состояние удовлетворительное. Рост – 168 см, масса тела – 82 кг. Индекс массы тела – 29,1 кг/см2, окружность талии – 102 см. Кожные покровы обычной окраски, чистые. Отеков нет. Пульс – 63 уд/ мин, ритмичный. АД сидя – 155/100 мм рт.ст. Левая граница относительной сердечной тупости расширена на 1,5 см кнаружи от левой средне-ключичной линии в 5-м межреберье. Частота дыханий – 18 в минуту. Над всей поверхностью легких ясный легочный звук. Дыхание везикулярное, хрипов нет. Живот мягкий, безболезненный. Размеры печени по Курлову– 9×8×7 см. Симптом поколачивания отрицательный с обеих сторон.
Результаты лабораторных и инструментальных методов обследования:
- клинический анализ крови – без отклонений от нормы;
- общий анализ мочи – без особенностей;
- биохимический анализ крови: креатинин – 94 мкмоль/л, глюкоза натощак – 4,6 ммоль/л, общий холестерин – 3,9, триглицериды – 0,7, липопротеиды низкой плотности – 2,4, липопротеиды высокой плотности – 1,1, натрий – 141 ммоль/л, калий – 4,6 ммоль/л.
- электрокардиограмма – синусовый ритм, 66 уд/мин, отклонение электрической оси сердца влево.
- суточное мониторирование АД (СМАД) (табл. 1, рис. 1).
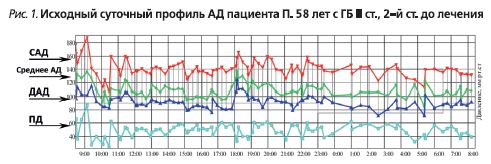
- суточный индекс САД – 4,2% (нондиппер); суточный индекс ДАД – 7,4% (нон-диппер). Величина утреннего подъема САД – 29,0 мм рт.ст., ДАД – 31,0 мм рт.ст.; скорость утреннего подъема САД – 7,4, ДАД – 7,9 мм рт.ст./ч (повышена);
- эхокардиография рутинно: аорта – стенки уплотнены, диаметр корня – 3,7 см; левое предсердие – 3,9 см; ЛЖ: конечно-диастолический размер – 5,1 см, конечно-диастолический объем – 137 мл, конечно-систолический объем – 44 мл, фракция выброса ЛЖ – 68%; толщина межжелудочковой перегородки (ТМЖП) – 1,3 см, толщина задней стенки (ТЗС) ЛЖ – 1,1 см, индекс массы миокарда ЛЖ (иММЛЖ) – 127,9 г/м2, индекс относительной толщины (ИОТ) – 0,43; нарушений локальной сократимости не выявлено; передне-задний размер правого желудочка – 2,6 см; митральный клапан – створки уплотнены, движение в противофазе, митральная регургитация 1-й ст., трехстворчатый клапан – регургитация 1-й ст.; диастолическая дисфункция 1-й стадии; признаков легочной гипертензии не выявлено (систолическое давление в легочной артерии – 23 мм рт.ст.);
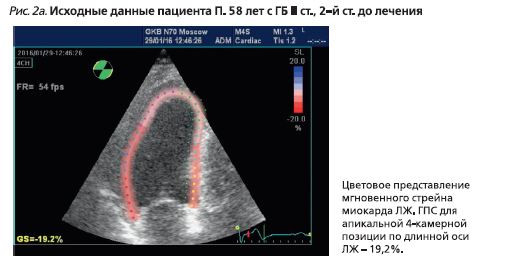
- 2D-speckle tracking миокарда ЛЖ (рис. 2): глобальный продольный систолический стрейн (ГПС) ЛЖ – 18,6% (норма ниже -19,7% [10]);
-

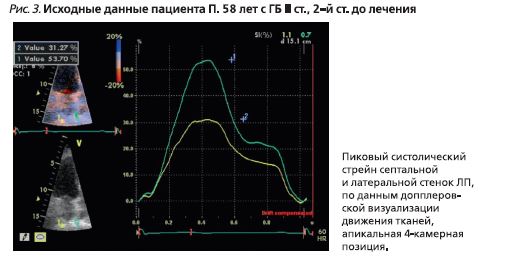
- одномерный стрейн ЛП, по данным допплеровской визуализации движения тканей (рис. 3): 39,2%;
- расчетные параметры жесткости миокарда по данным эхокардиографии: коэффициент диастолической эластичности ЛЖ 11,7×10-2; конечносистолическая эластичность ЛЖ – 5,6 мм рт.ст./мл; конечно-диастолическая жесткость ЛЖ – 0,30 мм рт.ст./мл; индекс жесткости ЛП – 0,39; индекс растяжимости ЛП – 1,7.
Пациенту была назначена ФК А/Л (Экватор®) в стартовой дозе 5/10 мг 1 раз в сутки утром. При контрольном визите через две недели на терапии пациент отметил положительную динамику – уменьшилась интенсивность головных болей, повысилась работоспособность. АД, по данным офисного измерения, составило 145/90 мм рт.ст. Поскольку целевое АД (ниже 140/90 мм рт.ст. [2, 3]) не было достигнуто, доза ФК А/Л была увеличена до 10/20 мг соответственно, и больному была назначена повторная явка еще через две недели. При втором контрольном визите пациент отметил хорошее самочувствие, головные боли не беспокоили. Кашля, отеков лодыжек, стоп и иных побочных эффектов не зафиксировано. АД при измерении во время визита составило 125/80 мм рт.ст. Исходя из положительной динамики в состоянии больного, достижении целевых цифр АД и хорошей переносимости терапии, пациенту было рекомендовано продолжить прием указанной ФК с повторением СМАД и эхокардиографии через 3 месяца.
При контрольном визите через 3 месяца: самочувствие пациента хорошее, жалоб нет. Офисное АД – 120/80 мм рт.ст. Данные СМАД (табл. 2, рис. 4).

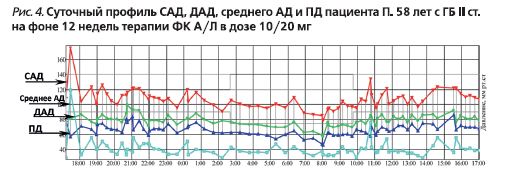
Суточный индекс САД – 13,4% (диппер); суточный индекс ДАД – 14,7% (диппер). Величина утреннего подъема САД – 30,0 мм рт.ст., ДАД – 20,0 мм рт.ст.; скорость утреннего подъема САД – 5,3 мм рт.ст./ч, ДАД – 3,5 мм рт.ст./ч.
При рутинной эхокардиографии отмечено снижение толщины стенок ЛЖ: ТМЖП – 1,2 см, ТЗС ЛЖ – 1,0 см, иММЛЖ – 113,7 г/м2, ИОТ – 0,39.
2D-speckle tracking миокарда ЛЖ (рис. 5, 6): ГПС ЛЖ – -20,8% (норма ниже -19,7% [10]).


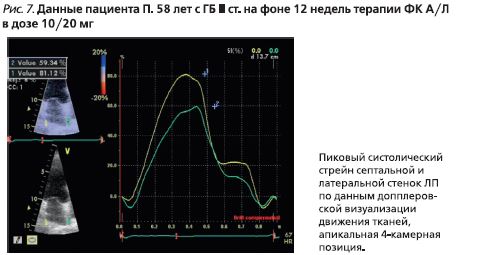
Одномерный стрейн ЛП, по данным допплеровской визуализации движения тканей, в конце периода наблюдения (рис. 7) составил 62,3%.
Расчетные параметры жесткости миокарда в конце периода наблюдения по данным эхокардиографии: коэффициент диастолической эластичности ЛЖ – 17,6×10-2; конечно-систолическая эластичность ЛЖ – 5,2 мм рт.ст./мл; конечно-диастолическая жесткость ЛЖ –0,23 мм рт.ст./мл; индекс жесткости ЛП – 0,22; индекс растяжимости ЛП – 2,3.
Таким образом, в описанном выше клиническом примере на фоне терапии ФК А/Л произошло достижение целевых цифр АД, снизились показатели его вариабельности, нормализовался суточный профиль АД, уменьшилась выраженность ГЛЖ, а также произошло улучшение упруго-эластических свойств миокарда ЛП и ЛЖ. Такие результаты согласуются с рядом литературных данных.
Так, в работе А.А. Донской и соавт. [13] оценивались эффекты терапии ФК А/Л на гемодинамические показатели у лиц с АГ. Были обследованы 69 больных от 18 до 55 лет (23 мужчины, средний возраст – 34,3±1,5 года, и 46 женщин, средний возраст – 38,4±1,1 года) с АГ I–II степеней. Период наблюдения составил 180±10 дней. На фоне терапии произошло достоверное снижение САД и ДАД, по данным рутинного измерения, как у мужчин, так и у женщин. Кроме того, существенно улучшились показатели суточного профиля АД за счет увеличения числа пациентов с диппер-типом и снижения числа больных с нон-диппер- и овер-диппер-типами суточного индекса САД и ДАД.
В наблюдении И.Р. Ерш и соавт. [14] изучали клиническую эффективность 12-месячной терапии ФК А/Л у больных АГ в амбулаторных условиях. В исследование были включены две группы больных. Первая – 34 пациента (16 женщин и 18 мужчин, средний возраст – 47±6,8 года, длительность анамнеза АГ – 12,6±6,2 года) с АГ I–II степеней, которые в течение года регулярно принимали ФК А/Л. В контрольную группу были включены 33 пациента (18 мужчин, средний возраст – 48±6,3 года, длительность АГ – 13,4±5,8 года), которые АГП принимали нерегулярно, эпизодически, при резком повышении АД или ухудшении самочувствия. Через 6 месяцев регулярной терапии ФК А/Л было отмечено достоверное снижение вариабельности АД по данным СМАД, которые в дальнейшем стали еще более выраженными.
Что касается влияния конкретных классов АГП на регресс ГЛЖ, то, например, иАПФ способны блокировать циркулирующий и/или локально синтезирующийся ангиотензин, что предупреждает его негативное влияние на миокард, а также тормозит пролиферацию фибробластов [15]. Кроме того, иАПФ, устраняя трофическое воздействие ангиотензина II, приводят к обратному развитию гипертрофии кардиомиоцитов [15], а также влияют на пролиферативный потенциал миокарда за счет снижения пролиферативной активности мелких Ki67позитивных клеток-предшественников кардиомиоцитов [16]. Уменьшение ГЛЖ на фоне лечения блокаторами кальциевых каналов может быть обусловлено снижением концентрации внутриклеточного Са2+ и ингибированием фосфориляции рецепторов эпидермального ростового фактора [17].
С.Н. Морозов и соавт. [18] уже через 90 дней применения ФК А/Л зарегистрировали высокодостоверное уменьшение признаков ГЛЖ, а по данным С.М. Кахрамановой и соавт. [19], терапия указанной ФК на протяжении 12 недель приводила к снижению иММЛЖ в среднем с 181,5 до 160,1 г/ м2. В исследовании ELVERA [20] сравнивали антигипертензивные и органопротективные эффекты амлодипина и лизиноприла у пациентов пожилого возраста с АГ. Показана хорошая способность данных препаратов приводить к регрессу ГЛЖ и улучшать диастолическую функцию ЛЖ, при этом гипотензивный эффект не сопровождался снижением кровотока в органах-мишенях (сердце, мозг, почки).
В ряде работ [21–24] получены данные о положительном влиянии иАПФ на показатели растяжимости ЛП, регресс интерстициального фиброза миокарда и электрофизиологические процессы в сердечной мышце. Так, C.G. Brilla и соавт. [21] сравнивали действие лизиноприла и гидрохлоротиазида на регресс фиброза в миокарде ЛЖ у 35 пациентов с АГ на фоне 6-месячного периода терапии данными препаратами. Анализ степени фиброза производился с помощью эндомиокардиальной биопсии и оценки общего объема фракции коллагеновых волокон, а также концентрации гидроксипролина в миокарде. Через 6 месяцев лечения в группе лизиноприла отмечено достоверное уменьшение фиброза миокарда и улучшение диастолической функции ЛЖ, чего не наблюдалось у пациентов, получавших гидрохлортиазид.
В работе J. Diez и соавт. [22] оценивали влияние 6-месячной терапии лизиноприлом 50 нелеченых пациентов с АГ на концентрацию в сыворотке крови предшественников коллагена III и I типов – N-концевого пептида проколлагена III типа и C-концевого пептида проколлагена I типа (C-КП), являющихся маркером тканевого синтеза коллагена. Как известно, гипертоническое ремоделирование сердца характеризуется накоплением в нем именно коллагена III и I типов. Было показано, что у пациентов с АГ сывороточная концентрация С-КП коррелировала с величиной иММЛЖ, а терапия лизиноприлом снижала гиперпродукцию коллагена I и III типов.
В обзоре экспериментальных работ J.P. Oliver и соавт. [23] было констатировано, что в большинстве исследований при терапии иАПФ был отмечен регресс повышенного содержания коллагена в миокарде при его хронической перегрузке повышенным АД. Нельзя не упомянуть об уникальном свойстве иАПФ: их способности повышать уровень кининов (прежде всего брадикинина), что, как было показано в экспериментальной модели, может оказывать самостоятельные антигипертрофический и антифибротический эффекты [24].
Согласно литературным данным, при терапии АГ параллельно уменьшению ГЛЖ происходит сдвиг баланса синтеза/распада коллагена в сторону регресса фиброза миокарда, о чем косвенно свидетельствует снижение концентрации вышеупомянутого С-концевого фрагмента предшественника коллагена в плазме крови [15]. Способность блокаторов ренин-ангиотензин-альдостероновой системы (РААС) уменьшать выраженность фиброза была подтверждена в ряде экспериментальных исследований. Так, у взрослых крыс со спонтанной АГ развитие ГЛЖ и фиброза миокарда ассоциировалось с повышением экспрессии гена тканевого ингибитора матриксных металлопротеиназ (ТИММП) и снижением коллагеназной активности [15], однако применение ингибиторов РААС нормализовало соотношение матриксные металлопротеиназы/ТИММП и вело к регрессу фиброза [15].
На сегодняшний день в литературе имеются единичные сведения об эффектах блокаторов кальциевых каналов на процессы фиброобразования в миокарде и его жесткость. Так, S.-S. Xing и соавт. [25] на модели крыс с индуцированным метаболическим синдромом установили, что повышенная концентрация провоспалительного интерлейкина-18 (ИЛ-18) в миокарде ассоциирована с развитием периваскулярного фиброза в нем и дигидропиридиновый блокатор кальциевых каналов фелодипин способен снижать концентрацию ИЛ-18 в ткани сердца, а также уменьшать выраженность периваскулярного фиброза сердечной мышцы. Механизм, благодаря которому ИЛ-18 индуцирует процессы образования соединительной ткани в миокарде, связан с активацией фибробластов и запуском синтеза ими экстрацеллюлярного матрикса.
Как известно [26], ИЛ-18 опосредует свое влияние на фибробласты, в т.ч. через активацию нуклеарного фактора κB. В связи с этим интересны данные исследований последних лет, в которых предполагается, что дигидропиридиновые блокаторы кальциевых каналов, такие как нифедипин, нилвадипин, бенидипин [25], могут ингибировать ядерную транслокацию и связывание с ДНК нуклеарного фактора κB, участвующего в каскаде процессов, приводящих к миграции фибробластов в миокард. Этим, вероятно, можно объяснить уменьшение образования внеклеточного соединительнотканного матрикса в сердечной мышце под влиянием вышеупомянутых блокаторов кальциевых каналов и как следствие – снижение жесткости миокарда.
К другим возможным механизмам, благодаря которым блокаторы кальциевых каналов замедляют ремоделирование миокарда, можно отнести их ингибирующие действия на симпатическую нервную систему за счет влияния на кальций-зависимые процессы освобождения и деградации катехоламинов, а также вследствие ослабления чувствительности β-адренергических рецепторов кардиомиоцитов к стимулирующим воздействиям [27]. В дополнение к этому данная группа АГП, оказывая угнетающее действие на кальций-зависимые процессы тубулогломерулярной обратной связи, может опосредованно уменьшать секрецию ренина, а снижая чувствительность клеток гломерулярной зоны надпочечников к ангиотензину II, они также нарушают продукцию альдостерона [27].
Таким образом, приведенный нами клинический пример иллюстрирует высокую гипотензивную эффективность применения ФК амлодипин/лизиноприл (в течение 4 недель достигнуто целевое АД по рутинному измерению, а также по данным СМАД, в периоды бодрствования и сна) и подтверждает изученные в ранее проведенных клинических исследованиях ее благоприятное влияние на суточный профиль АД (уменьшилась вариабельность АД), высокие органопротективные свойства (уменьшилась выраженность ГЛЖ и улучшились упругоэластические свойства левых отделов сердца).



