Препарат Рефнот, разработанный НПП «Фармаклон», представляет собой гибридную молекулу рекомбинантного фактора некроза опухоли α (ФНО-α) и тимозина α1. Он состоит из 185 аминокислотных остатков, из которых последние 28 на С-конце являются последовательностью тимозина α1. ФНО-α был идентифицирован в 1975 г. в сыворотке мышей, инфицированных BCG и инъецированных липополисахаридом (LPS), как гликопротеин, способный индуцировать геморрагический некроз сарком, трансплантированных мышам подкожно [1]. В 1984 г. после клонирования ДНК ФНО-α был создан рекомбинантный человеческий ФНО-α, который вызывал геморрагический некроз трансплантированных сарком, индуцированных метилхолантреном у сингенных мышей [2]. ФНО-α способен индуцировать апоптоз, некроз и аутофагию опухолевых клеток различного происхождения. При определенных условиях ФНО-α может вызывать избирательную деструкцию кровеносных сосудов в опухоли, что играет большую роль в его противоопухолевом эффекте [3–5]. В условиях in vitro ФНО-α усиливает цитотоксическое и апоптотическое действие химиопрепаратов в отношении клеток злокачественных опухолей [6]. Этот цитокин синтезируется главным образом иммунными клетками (макрофагами, дендритными клетками, лимфоцитами) и оказывает значительное влияние как на врожденный, так и на адаптивный иммунитет. Он способен активировать Т- и дендритные клетки, что приводит к усилению противоопухолевого адаптивного иммунного ответа [5]. ФНО-α является основным регулятором иммунного и воспалительного ответа на опухоль, обладает выраженным цитотоксическим, цитостатическим и иммуномодулирующим эффектами [7]. Однако при системном введении рекомбинантный ФНО-α высокотоксичен для человека, что не позволяет достигать необходимых терапевтических доз. Таким образом, применение ФНО-α в медицине оказалось ограниченным его побочными эффектами и было временно прекращено. Начался поиск новых гибридных молекул на его основе [8, 9]. Значимые клинические результаты были получены при применении ФНО-α в монотерапии или в комбинации с мелфаланом при изолированной регионарной перфузии у пациентов с меланомой или саркомой конечностей. При меланоме объективный ответ был достигнут более чем 90% больных [10, 11]. Имеется также сообщение о регрессе неоперабельных метастазов колоректального рака при изолированной перфузии печени ФНО-α совместно с мелфаланом [7].
Тимозин α1 – естественный лимфопоэтический фактор тимуса, был впервые идентифицирован и охарактеризован A.L. Goldstein и соавт. [12]. Тимозин α1 является эндогенным регулятором как врожденного, так и адаптивного иммунитета [13]. В экспериментальных и клинических исследованиях тимозин α1 продемонстрировал противоопухолевую активность в комбинации с другими видами иммуно- и химиотерапии [14–16].
Таким образом, Рефнот является уникальным соединением – гибридной молекулой двух биологически активных агентов: цитокина ФНО-α и тимозина α1. Рефнот в отличие от ФНО-α характеризуется низкой системной токсичностью, однако сохраняет противоопухолевую активность данного цитокина.
В данной работе представлены результаты исследования влияния Рефнота в сочетании с химиотерапией на основные показатели иммунитета у больных диссеминированной меланомой кожи (ДМК) на разных этапах лечения.
Материал и методы исследования
В исследование были включены пациенты с ДМК, ранее не получавшие лекарственного лечения по поводу диссеминации болезни (n=21). Контролем служили доноры без признаков онкологических заболеваний (n=25). Все пациенты получали лечение по следующей схеме: Рефнот вводили в дозе 100–400 тыс. МЕ в 1–5-й дни подкожно с 2-дневными перерывами в течение 2–4 недель. Начиная с 3-й или 5-й недели проводили химиотерапию (дакарбазин 250 мг/м2 внутривенно струйно в дни 1–3, ломустин 80 мг/м2 внутрь в день 1 через 3 часа после дакарбазина, цисплатин 80 мг/м2 внутривенно в день 3).
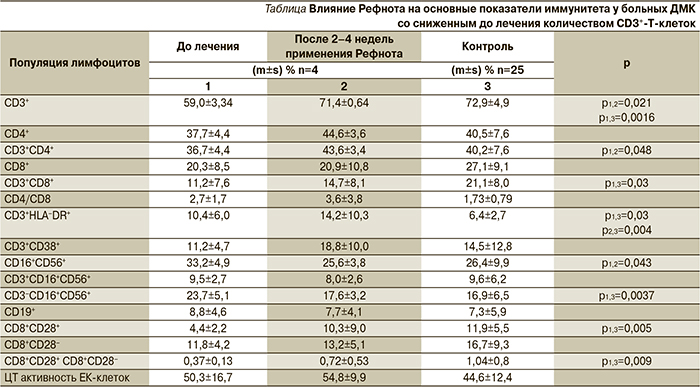
Перерыв между курсами составил 2 недели. Состояние иммунитета определяли до начала лечения, после 2–4 недель терапии Рефнотом (до химиотерапии, 1 курс) и перед 2-м курсом химиоиммунотерапии. Иммунофенотипирование лимфоцитов периферической крови проведено с помощью многопараметрового цитометрического анализа с использованием панели моноклональных антител производства компаний eBiocsience (USA) и «Сорбент» (Россия) к поверхностным маркерам лимфоцитов. Определено процентное содержание следующих популяций клеток в составе CD45+-лимфоцитов периферической крови: СD3+, CD3+CD4+, CD3+CD8+, CD3+HLA-DR+, CD3+CD38+, CD3+CD16+CD56+, CD3−CD16+CD56+, CD19+, CD8+CD28+, CD8+CD28−.
Цитотоксическая активность естественных киллеров (ЕК-клеток) определена с помощью полуавтоматического колориметрического МТТ-теста в отношении клеток К-562 [17].
Для статистической обработки результатов использован пакет статистических программ «Статистика.7». Различия между средними значениями показателей определены с помощью U-критерия Манна–Уитни и t-критерия Стьюдента. Для определения связи между изучаемыми признаками использован непараметрический корреляционный анализ Спирмена. Различия между показателями считали статистически значимыми при р≤0,05. Результаты представлены в виде среднего арифметического значения показателя±стандартное отклонение (m±s).
Результаты и обсуждение
До лечения у 10 из 21 (47,6%) больного ДМК было снижено количество CD3+-Т-лимфоцитов (55,9±3,9%) по сравнению с контролем (72,96±4,9%; p=0,0000) и с группой с их нормальным показателем (77,9±4,9%; p=0,0001). В то же время у той же группы больных отмечено значительное повышение исходного количества CD3‒CD16+CD56+ ЕК-клеток (24,0±5,1% против 16,9±6,5% в контрольной группе; p=0,004), а также снижение количества CD8+-Т-лимфоцитов, экспрессирующих коактивационный рецептор CD28 (5,4±3,0 против 11,9±5,5% в контрольной группе; р=0,0006) и величины соотношения CD8+CD28+/CD8+CD28− (0,36±0,13 против 1,04 в контрольной группе; 1,04 р=0,009). После 2–4 недель введения Рефнота сниженное количество CD3+-клеток отмечено у 7 (33,3%) из 21 больного. Перед 2-м курсом лечения обследование было проведено 11 пациентам, и сниженное по сравнению с нормой количество CD3+-Т-клеток выявлено лишь у 1 (9,1%) больного.
После 2–4 недель терапии Рефнотом у 4 из 10 пациентов со сниженным до лечения количеством CD3+-Т-клеток отмечена нормализация основных показателей иммунитета. Так, процент CD3+-Т-клеток повысился до контрольного уровня (с 59,0±3,3 до 71,4±0,6%; p=0,0003), возросло и количество CD3+CD4+ (с 36,7±4,4 до 43,6±3,4%; р=0,048) и сниженное до лечения число CD3+CD8+ Т-лимфоцитов. Повышенный у этих пациентов до лечения процент CD3‒CD16+CD56+ ЕК-клеток (23,7±5,1%) по сравнению как с группой с исходно нормальными значениями CD3+, так и с контролем (10,7±5,7%; p = 0,0006; 16,9±6,5%; p = 0,004, соответственно) после 2–4 недель терапии Рефнотом снизился до уровня контроля. В то же время на фоне снижения количества ЕК-клеток отмечена тенденция к повышению их цитотоксической активности (см. таблицу). Следует отметить, что у этих больных также повысилось сниженное по сравнению с контролем количество CD8+CD28+ Т-лимфоцитов и, соответственно, практически в 2 раза возросло соотношение CD8+CD28+/CD8+CD28−. И до и после терапии Рефнотом у данной группы больных количество активированных Т-клеток (CD3+HLA-DR+) превышало контрольные значения. У остальных 6 из 10 пациентов со сниженным до лечения количеством CD3+-
Т-лимфоцитов отмечено уменьшение основных показателей Т-клеточного звена иммунитета (включая CD8+CD28+-Т-клетки и величину соотношения CD8+CD28+/CD8+CD28−), однако происходило дальнейшее возрастание количества CD3‒CD16+CD56+-ЕК-клеток (до 36,8±11,2%), которое было повышено и до лечения. Повышение количества ЕК-клеток на фоне снижения числа CD3+-Т-клеток, по-видимому, носило компенсаторный характер. Непараметрический корреляционный анализ Спирмена выявил статистически значимую сильную обратную корреляционную связь между количеством CD3+-Т-лимфоцитов и CD3‒CD16+CD56+-ЕК-клеток (коэффициент корреляции r=-0,853; p=0,0000) у всех пациентов, включенных в исследование. У 11 пациентов с исходно нормальным количеством CD3+-Т-лимфоцитов было повышено по сравнению с контролем (9,6±6,2%) количество ЕК-клеток (ЕК-клетки – CD3+CD16+CD56+) как до лечения (16,3±11,2%; p=0,32), так и после терапии Рефнотом (16,5±11,4%; p=0,033). В данной группе терапия Рефнотом больных приводила к нормализации сниженного до лечения по сравнению с контролем (10,6±5,7%; p=0,006) количества ЕК-клеток. И до и после введения Рефнота отмечено сниженное по сравнению с контролем процентное содержание CD8+CD28+-Т-клеток, однако статистически значимого отличия величины соотношения CD8+CD28+/CD8+CD28− от контроля не наблюдалось.

Результаты определения основных показателей иммунитета у 11 пациентов до лечения, после 2–4 недель терапии Рефнотом и перед 2-м курсом иммунохимиотерапии представлены на рис. 1 и 2 (a, б). Как следует из рис. 1 и 2 (a), в процессе химиоиммунотерапии наблюдалась тенденция к нормализации некоторых показателей иммунореактивности пациентов: количества CD3+, CD3+CD8+ и CD8+CD28+ Т-клеток. Количество ЕК-клеток (CD3‒CD16+CD56+) перед 2-м курсом химиоиммунотерапии снижалось после некоторого повышения практически до уровня контроля, в то же время отмечена тенденция к постепенному возрастанию цитотоксической активности этих клеток. Это может указывать на повышение цитотоксического потенциала естественных киллеров под влиянием химиоиммунотерапии с включением Рефнота. Следует отметить, что перед 2-м курсом терапии нормализовалась величина соотношения CD8+CD28+/CD8+CD28− в среднем c 0,67 до 1,11 (в контроле – 1,04) (рис. 2б).
В проведенном ранее в нашей лаборатории исследовании влияния Рефнота на основные показатели иммунитета у пациентов с ДМК, диссеминированным раком толстого кишечника и другими злокачественными опухолями, с использованием однопараметрового цитометрического анализа было продемонстрировано, что Рефнот повышает количество CD3+, CD4+, CD8+ Т-клеток, сниженное до лечения, а также повышает цитотоксический потенциал ЕК-клеток [18]. Использование в настоящем исследовании для иммунофенотипирования лимфоцитов периферической крови пациентов с ДМК, получавших Рефнот в сочетании с химиотерапией, многопараметрового цитометрического анализа позволило более четко определить популяции лимфоцитов, на которые положительно влияет препарат. Продемонстрировано положительное воздействие Рефнота одного и в сочетании с химиотерапией на субпопуляции лимфоцитов, играющих основную роль в противоопухолевом иммунитете. Отмечена тенденция к повышению у части больных сниженного количества CD3+, CD3+CD4+, CD3+CD8+ Т-лимфоцитов, нормализация количества ЕК-клеток и повышение их цитотоксической активности. Следует отметить, что проводимое лечение вызывало повышение сниженного до лечения количества CD8+CD28+-Т-клеток, экспрессирующих костимуляторный рецептор CD28, и величины соотношения CD8+CD28+/CD8+CD28−. CD28 является наиболее важным костимуляторным рецептором Т-лимфоцитов, передача сигнала с которого необходима для эффективной активации Т-клеток через Т-клеточный рецептор, их пролиферации и продукции цитокинов, и снижение величины соотношения CD8+CD28+/CD8+CD28− при определенных патологических состояниях может являться неблагоприятным прогностическим фактором [19, 20].
Хорошо известно, что у подавляющего большинства онкологических больных, особенно при значительном распространении заболевания, обнаруживаются определенные нарушения иммунологической реактивности и проводимая иммунотерапия не всегда способна индуцировать эффективный противоопухолевый иммунный ответ. Полученные в настоящем исследовании результаты подтвердили способность Рефнота оказывать положительное воздействие на основные показатели противоопухолевого иммунитета у онкологических больных с поздними стадиями заболевания.


