Введение
Витилиго – наиболее частый дерматоз из группы заболеваний, связанных с нарушением пигментации кожи. Распространенность заболевания в общей популяции составляет 1–3% вне зависимости от пола. Высокий уровень психосоциальных аспектов витилиго предопределяет актуальность и значимость проблемы. В большинстве случаев диагностика заболевания не вызывает трудностей и требует лишь клинического осмотра.
Открытия последних лет в сфере молекулярной биологии позволили по-новому взглянуть на патогенез заболевания и добиться существенного успеха в лечении этого дерматоза. Так, установлено, что значительную роль в развитии аутоиммунного воспаления играет фактор некроза опухоли α (ФНО-α), активирующий цитотоксические Т-лимфоциты, которые в свою очередь повреждают меланоциты. В коже больных прогрессирующим витилиго число цитотоксических Т-лимфоцитов увеличивается, в то время как дефицит Т-регуляторных лимфоцитов, подавляющих цитотоксические эффекты, стремительно нарастает. Применение ингибиторов ФНО-α или инструментальных методик, снижающих его выработку, позволяет снижать CD8+-Т-клеточную активацию и пролиферацию, в результате чего разрушения меланоцитов не происходит.
Замена в коже пула цитотоксических лимфоцитов на Т-регуляторные лимфоциты с последующей стимуляцией меланогенеза позволяет усиливать репигментацию в зоне поражения уже на первых этапах лечения.
Материал и методы
Проведен анализ данных обследования 89 пациентов (49 женщин и 40 мужчин) с сегментарным витилиго во Французской клинике кожных болезней им. Пьера Волькенштейна за период с октября 2015 по декабрь 2016 г. Возраст пациентов колебался от 17 до 47 лет. Средний возраст мужчин составил 23,6, женщин – 31,8 года. На момент обращения в клинику средняя продолжительность заболевания составила 5,6 года.
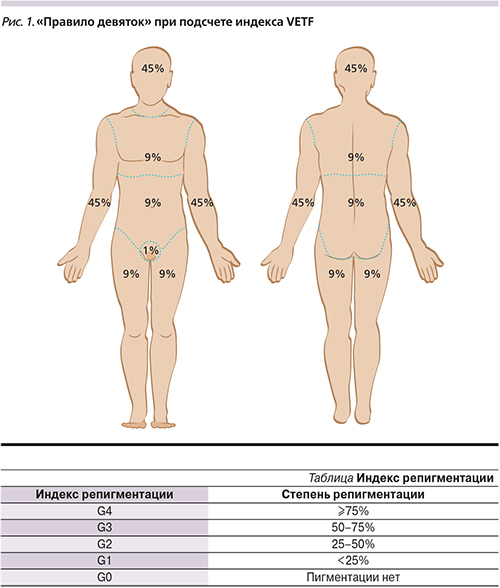
Оценку тяжести поражения кожи пациентов проводили на основании международных тестов: VETF (Vitiligo European Task Force),VIDA (Vitiligo Disease Activity Score) и VASI (Vitiligo Area Scoring Index).
VETF – система оценки тяжести поражения включает три характеристики: степень, стадию и прогрессирование заболевания [1]. Оценка степени поражения основана на «правиле девяток» (рис. 1) [2]. Стадия заболевания оценивалась на основании 3 этапов депигментации кожи и волос: 0 стадия – нормальная пигментация, 1-я – неполная депигментация, 2-я – полная депигментация кожи и волос менее 30% туловища, 3-я стадия – полная депигментация кожи и волос более 30% туловища. Коэффициент прогрессирования заболевания оценивали с помощью индекса: +1 (прогрессивный); 0 (стабильный); -1 (регрессивный) [3].
VIDA – субъективная оценка степени активности витилиго, основывается на данных, представленных самим пациентом, при ответе им на вопрос: появляются ли у Вас новые пятна? [4]:
- +4: активность ≤6 недель;
- +3: активность от 6 недель до 3 месяцев;
- +2: активность от 3 до 6 месяцев;
- +1: активность от 6 до 12 месяцев;
- 0: стабильная в течение 1 года;
- -1: стабильная в течение 1 года со спонтанной репигментацией.
Расчет VASI выполняли по формуле [1, 3]:
Оценку излечиваемости проводили на основании двух методик: индекса VASI (Vitiligo Area Scoring Index) и подсчета индекса репигментации (G).
Степень пигментации оценивалась в процентах по шкале:
- 100% – полная депигментация, пигмент отсутствует;
- 90% – частичная пигментация;
- 75% – число депигментированных участков превышает таковое пигментированных;
- 50% – число депигментированных и пигментированных участков одинаково;
- 25% – число пигментированных участков превышает таковое депигментированных;
- 10% – имеются единичные очаги депигментации.
Кроме того, оценку клинического ответа проводили при помощи индекса G (см. таблицу).
Результаты исследования
При подсчете средних коэффициентов индекса G установлено, что у 23 (27,82%) пациентов клинический ответ на проводимую терапию, как правило, отмечался на 4–8-й процедуре.
У 1 пациентки клиническое улучшение наблюдалось уже на 3-й процедуре. Индекс G3 на 30-й процедуре был зарегистрирован у 48 (84,21%) пациентов. Отсутствие клинического улучшения имело место у 6 (10,52 %) пациентов. В то же время индексы G3, G2 и G1 отмечены у 51 (89,47%) пациента на разных этапах терапии.
У 11 пациентов в иммунограммах были выявлены признаки повышения уровня цитотоксических Т-лимфоцитов.
При совокупном анализе результатов лечения по тестам VASI, VETF и VIDA было отмечено улучшение всех показателей у подавляющего большинства пациентов.
В качестве примера приводим наблюдение пациентки А. 43 лет, которая обратилась в КВД с жалобами на появление белых пятен в области лица. Врач-дерматолог поставил диагноз «сегментарное витилиго». Больной первоначально проведена терапия с применением наружных лекарственных средств – 1%-ный крем пимекролимус 2 раза в сутки в течение 2 месяцев. Улучшения от проводимой терапии отмечено не было. В течение последующих 3 лет заболевание прогрессировало: появились новые очаги депигментации в дополнительных анатомических областях, старые увеличились в размерах. При обращении во Французскую клинику кожных болезней им. Пьера Волькенштейна диагноз витилиго был подтвержден. Оценка тяжести поражения кожи на основании международных индексов составила: VETF 2%, 2, +1; VIDA +3; VASI 8,4; G0.
При иммунологическом обследовании у больной выявлено повышение дифференцировки Т-лимфоцитов в цитотоксическую субпопуляцию (44% при норме 19–35%) и снижение Т-хелперной субпопуляции до15% (при норме 35–50%); снижение относительного числа естественных киллеров до 6% (при норме 8–17%). Незначительно повышена индуцированная микробицидная активность нейтрофилов – 61% (при норме 40–60%). Уровни иммуноглобулинов находились в пределах нормы.

Гистологическое исследование кожного биоптата из очага поражения периоральной области: фрагмент кожи с атрофией эпидермиса, минимальным числом клеток меланоцитарного типа в базальном слое, а также с атрофией придатков и слабовыраженной дезорганизацией и гомогенизацией коллагеновых волокон дермы. В сосочковой части дермы выявляется полосовидный инфильтрат, местами прерывающийся, состоящий из лимфоцитов с примесью гистиоцитов. При иммунофенотипировании бóльшая часть клеток инфильтрата экспрессирует CD3+, CD8+. Гистологическая картина соответствует клиническому диагнозу витилиго.
Пациентке назначен курс терапии needling в сочетании с фототерапией в режиме NB-UVB (311 nm, TL01) № 15. Положительный клинический эффект был отмечен на ранних этапах лечения: появление пигмента в очаге поражения зарегистрировано уже на 3-й процедуре, индекс VASI на 3-й процедуре составил 6,1 (рис. 2, 3). После 10 процедур NB-UVB (311 nm, TL01) и needling отмечена практически полная репигментация пятен (VASI 3,2; рис. 4). Индекс G4, а затем полная репигментация всех очагов поражения были отмечены на 14-й процедуре (рис. 5), а VASI составил 0,32.
Обсуждение
ФНО-α, или кахектин, – полипептидный гормон [5], играет ключевую роль в развитии инфекционного и аутоиммунного воспаления кожи [6, 7]. Ген ФНО-α локализован в 6-й хромосоме, а сам полипептид существует в двух формах: трансмембранной и растворимой [8].
В коже ФНО-α продуцируется иммунокомпетентными клетками-макрофагами [6], Т-лимфоцитами и активируется рецепторами ФНО (ФНОР1 и ФНОР2). Меланоциты экспрессируют ФНОР1 [9, 10], который содержит домен смерти (ДС), связывающийся с белками РАДС (рецептор-ассоциированный ДС), ФАДС (Fas-ассоциированный ДС) и ФПИПФ (ФАДС-подобный интерлейкин-1β-превращающий фермент). Последний активирует каспазу-3 (рис. 6).
Конечным этапом этого сигнального пути активации ФНОР1 является апоптоз меланоцита [11].
ФНОР2 экспрессируется на лимфоцитах [12] и в отличие от ФНОР1 не содержит ДС, вследствие чего не может быть причиной апоптоза [13]. Напротив, при помощи ФНОР2 ФНО-α может активировать и стимулировать пролиферацию Т-регуляторных лимфоцитов [14]. Активация T-регуляторных лимфоцитов ФНО-α и их участие в патогенезе витилиго доказаны в множестве исследований [15–17]. Отвечая за иммунный гомеостаз, Т-регуляторные лимфоциты блокируют развитие цитотоксических лимфоцитов. Этот феномен с успехом может быть использован в терапевтических стратегиях для лечения аутоиммунных заболеваний [18]. Примечательно, что меланоциты могут экспрессировать ФНОР1 и ФНОР2 в ответ на индукцию первых фаз процесса воспаления в коже [19].

Известно, что соотношение CD3+/CD8+ в участках депигментации кожи у больных витилиго значительно снижено [20]. Лимфоциты, экспрессирующие CD3+, CD8+, секретируют преимущественно цитокины 1-го типа, в т.ч. ФНО-α [21]. Последний играет существенную роль в развитии цитотоксических лимфоцитов, участвующих в инициализации воспаления при витилиго [22], и усиливает экспрессию активированного лимфоцитарного интерферона [23].
Механизмом противовоспалительного действия ФНО-α является активация и индукция пролиферации Т-регуляторных лимфоцитов [15–17]. В коже Т-регуляторные лимфоциты отвечают за иммунный гомеостаз. Дистанционный механизм подавления Т-регуляторными лимфоцитами цитотоксических лимфоцитов заключается в выделении последними ФНО-α и его взаимодействии с поверхностными рецепторами цитотоксических Т-лимфоцитов. В результате снижается не только пролиферация и активация цитотоксических Т-лимфоцитов, но и сама степень иммунного ответа [24], как следствие – уменьшается повреждающее действие меланоцитов.
Терапевтический алгоритм при витилиго
К лекарственным препаратам, используемым при лечении витилиго, относят ингибиторы кальциневрина (такролимус, пимекролимус), системные и топические фотосенсибилизаторы (келлин, псоралены), системные и топические стероиды. Доказанной эффективностью обладает фототерапия в режиме NB-UVB (311 nm, TL01) и ПУВА (PUVA – Psoralen+UltraViolet A). Эффективность аппликаций кальципотриола или системного применения азатиоприна выше при сочетании с фототерапией, чем при монотерапии системными иммуносупрессорами [24].
Методика needling или терапия иглами основана на гипотезе, которая заключается в том, что множественные точечные микротравмы эпидермиса, с одной стороны, способствуют переносу меланоцитов из участков нормальной кожи в очаги депигментации, с другой – позволяют стимулировать пролиферацию и дифференцировку Т-регуляторных лимфоцитов [25]. Первый опыт использования этого метода был представлен на конгрессе EADV (European Academy of Dermatology and Venereology Congress) в Берлине в 2009 г. Ифтикхаром Шейхом (Пакистан), сейчас этот метод с успехом применяется во многих странах Европы [26].
Техника проведения манипуляции needling заключается в серийных введениях иглы определенного размера в эпидермис, избегая ее проникновения глубже дермоэпидермального соединения или сосочковой части дермы. Вколы осуществляются на небольшом расстоянии друг от друга и зависят от характеристик очага поражения, анатомической области. Игла располагается под определенным углом, формирующим условный треугольник, основание которого обращено в сторону здоровой кожи, а угол 45° ориентирован в сторону очага поражения. В норме процедура безболезненна и не требует местной анестезии, однако исключение из этого правила составляют дети, лица с низким болевым порогом, очаги поражения в области век, половых органов, боковых поверхностях туловища. Суждение о правильности выполнения процедуры needling и представление о глубине проникновения иглы в эпидермис формируются на основании визуальной оценки появления транзиторной гиперемии в очагах проведения манипуляции и отсутствии появления крови в местах вкола иглы [25].
Метод узковолновой терапии лучами спектра В применяется в Европе относительно недавно, а спустя некоторое время в 1990-х гг. он стал использоваться и для лечения витилиго [27]. Компаративная оценка методов фототерапии ПУВА и NB-UVB (311 nm, TL01) позволила доказать не только безопасность, но и высокую эффективность последнего: 67 против 46% [28].
Использование NB-UVB (311 nm, TL01) при лечении витилиго стало общепринятым, и в области его применения появляются все новые технологические разработки. Установлено, что NB-UVB (311 nm, TL01) воздействуют на определенные хромофоры в коже. В эпидермисе к ним относятся кератиноциты и меланоциты, в дерме – фибробласты, лимфоциты и гистиоциты.
Терапевтический эффект фототерапии основан, с одной стороны, на стимуляции меланогенеза путем усиленной пролиферации меланоцитов, повышении синтеза тирозиназы, формировании и усилении активности меланосом, увеличении скорости движения меланоцитов к кератиноцитам [28], с другой – на подавлении цитотоксических Т-лимфоцитов путем активации апоптоза клеток в воспалительном инфильтрате и уменьшении количества воспалительных медиаторов, цитокинов, а также снижении активности антигенов [23].
Выводы
- Сочетанное применение needling и NB-UVB (311 nm, TL01) позволяет добиваться репигментации очагов поражения у больных витилиго в подавляющем большинстве случаев (89,47%).
- Не было выявлено корреляционных связей между уровнем цитотоксических Т-лимфоцитов в периферической крови и числом очагов поражения кожи у больных витилиго. Малая выборка результатов лабораторных исследований не позволяет провести достоверную оценку указанной ассоциации, что требует продолжения исследований в этой области с использованием большего числа пациентов и количества биоматериала, а также включения в исследование контрольных групп.
- Малые сроки исследования не позволяют сформировать представление о возможных рецидивах заболевания в исследуемой группе пациентов, а также о периоде отдаленных последствий. Для получения этих данных целесообразно проведение более длительного исследования с регистрацией катамнестических данных пациентов исследуемой руппы.


