Введение
Иммунотерапия в настоящее время находит все новые показания к применению и служит компонентом терапии всех злокачественных опухолей благодаря регистрации агностических показаний к ее применению больными с микросателлитной нестабильностью [1]. Особенно актуальным в свете последних достижений становится поиск биомаркеров для определения прогноза и отбора пациентов, которым иммунотерапевтические стратегии действительно могут помочь. В то время как большинство исследователей сходятся во мнении о необходимости динамического контроля за иммунологическими маркерами, становится очевидным, что именно иммунологические показатели периферической крови могут быть удобным средством наблюдения и контроля за эффективностью терапии [2]. Однако иммунологический мониторинг до сих пор не входит ни в один из стандартов лечения злокачественных опухолей. Основной фокус внимания исследователей привлекают отдельные виды иммунных клеток, которые изучаются в качестве подобных маркеров. Мы же в своем исследовании АИСТ предприняли попытку оценить динамику основных субпопуляций лимфоцитов и оценить возможность ее использования в качестве раннего маркера ответа на терапию больных меланомой.
Цель исследования: оценка динамики основных субпопуляций лимфоцитов и возможность ее использования в качестве раннего маркера ответа на терапию больных меланомой.
Методы
Для оценки роли динамики изменений иммунологических показателей в качестве предиктивных и прогностических факторов был проведен анализ ранних изменений в показателях иммунного статуса (ИС). С этой целью отобрали пациентов с меланомой, которым была проведена оценка ИС до лечения (в течение 4 недель до начала терапии) и в процессе лечения в течение первых 12 недель терапии. При этом для анализа при наличии нескольких ИС использовались в первую очередь оценки на 2–4-й неделях терапии, в их отсутствие последовательно включались ИС на 5–12-й и 1-й неделях лечения. Характеристика пациентов, включенных в исследование АИСТ, представлена в табл. 1.

Для оцени прогностической и предиктивной роли динамики иммунологических характеристик показатель на фоне лечения сравнивали с таковыми до лечения с использованием минимально определяемых различий (MDD), определение и расчет которых описаны в разработанном нами методе оценки [3]. Изменения показателя меньше MDD трактовались как отсутствие изменений. При больших различиях результат расценивался как повышение и понижение соответственно. Нами использованы два различных размера MDD: специфический, рассчитанный на каждого конкретного показателя, и общий, полученный на основании среднего значения сравниваемых показателей в соответствии с предложенной нами методикой. Во всех случаях сравнения пациенты с отсутствием изменений показателей расценивались как референсная категория. В отсутствие различий с референсной категорией к ней допускалось добавление больных с результатами из неотличавшейся категории для увеличения мощности исследования.
При оценке связи динамики с объективным ответом на лечение использовался ответ по RECIST 1.1. При этом оценивалась вероятность развития прогрессирования (ПЗ) или стабилизации (СЗ) заболевания, или объективного ответа (ОО) на лечение, включившего полный и частичный регресс.
В исследовании проведен анализ следующих субпопуляций иммунных клеток:
- показатели врожденной иммунной системы:
- лейкоциты, лимфоциты, моноциты, нейтрофилы, эозинофилы;
- NK-клетки (CD3-CD16+CD56+), NKТ-клетки (CD3+CD16+CD56+);
- нейтрофильно-лейкоцитарный индекс (NLR, отношение нейтрофилов к лимфоцитам), лимфоцитарно-моноцитарный индекс (LMR, отношение лимфоцитов к моноцитам), индекс NMLR (отношение суммы моноцитов и нейтрофилов к лимфоцитам);
- отношении NK- и NKT-клеток к ЦТЛ;
- показатели Т-клеточного звена адаптивной иммунной системы:
- Т-лимфоциты (CD3+CD19-), Т-хелперы (Th, CD3+CD4+), ЦТЛ (CD3+CD8+);
- активированные CD25+ и HL DR+ T-хелперы, активированные HL DR+ ЦТЛ;
- иммунорегуляторный индекс (ИРИ, отношение CD4+ к CD8+ лимфоцитам), отношение ЦТЛ к Treg;
- показатели В-клеточного звена адаптивной иммунной системы – В-лимфоциты (CD3-CD19+).
У больных, получавших вакцины, дополнительно оценивались общая экспрессия HLA DR и CD25 на мононуклеарах периферической крови, двойные негативные (CD3+CD4-CD8-) лимфоциты, функциональная активность лейкоцитов (спонтанная миграция и миграция, стимулированная КонА или ФГА), характеристики фагоцитоза (НСТ-тест, фагоцитарное число и фагоцитарный индекс нейтрофилов и моноцитов).
У больных, получавших ипилимумаб, дополнительно были оценены CD38+Th, CD38+ЦТЛ, CTLA4+Th, CD1D+ лимфоциты, CD3-CD16+56+NKG2D+, популяции клеток памяти (CD3+CD27+CD62L+, CD3+CD28+CD62L+, центральные Т-клетки памяти (СD3+СD45RA-СD62L+) и эффекторные Т-клетки памяти (СD3+СD45RA-СD62L).
Анализ связи изменений с ОО проводился с использованием метода хи-квадрат. В качестве меры значимости различий использовался тест отношения правдоподобия. При этом из анализа исключались показатели с числом событий менее 10. Для построения регрессионной модели методом пропорциональных рисков Кокса с учетом ограниченности количества наблюдений использовались стандартные факторы (возраст, пол, стадия заболевания, уровень ЛДГ, наличие драйверных мутаций), вид и линия лечения. Значимыми в модели выживаемости считались лишь те показатели ИС, которые добавляли дополнительную информацию к известным факторам прогноза при многофакторном анализе.
В нашем исследовании различия считались статистически значимыми при р<0,05. В качестве референсной категории во всех анализах использовалась группа с отсутствуем изменений показателя в динамике.
Результаты исследования
Частота изменений иммунологических показателей под воздействием отдельных видов лечения
Для определения частоты изменений показателей иммунной системы все пациенты, включенные в исследование АИСТ, были объединены в три группы по методу лечения: получавшие вакцины, анти-CТLA4- и химиотерапию. Изменения иммунологических показателей на фоне данных видов лечения представлены на рисунке. Прочие показатели не имели статистически значимых различий в частотах отклонений под воздействием отдельных видов лечения.
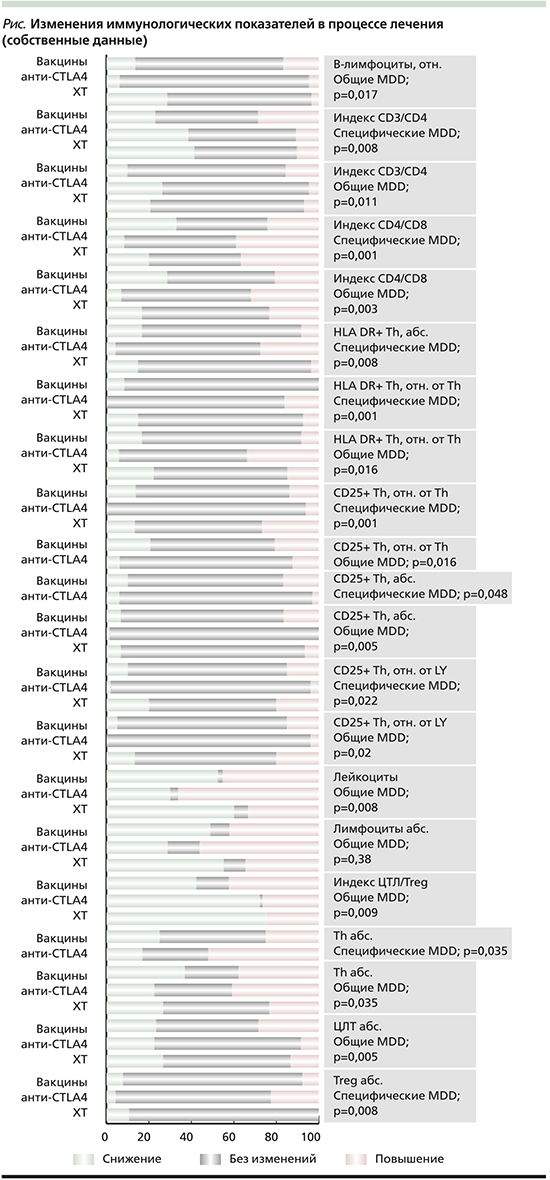
При анализе частот изменений показателей ИС на ранних этапах лечения выяснилось, что наиболее вариабельными оказались соотношения показателей иммунной системы, число лейкоцитов, лимфоцитов, показатели фагоцитарной активности и миграции лимфоцитов. Уровни Treg, Th (как общее содержание, так и экспрессирующие отдельные маркеры активации), NK- и NKT-клеток, наоборот, были среди наиболее постоянных показателей. Изменение в их уровне в нашем исследовании наблюдалось менее чем у 30% пациентов.
При сравнении частот изменений на основании специфических и общих MDD частота отклонений при использовании последних была закономерно ниже, что обусловлено более грубой оценкой этого параметра. Вместе с тем все оценки имели статистически значимую коррелляционную связь (р<0,05). При этом малые значения коэффициента коррелляции Спирмана (0,2 и 0,276) наблюдались лишь для относительного уровня CD4+CD25hidhCD127low Treg и абсолютного уровня CD3+CD4+CD8+-лимфоцитов. Для относительных уровней B- и NKT-клеток, HLA DR+Th, CD3+CD4+CD8+-лимфоцитов коэффициент корреляции составлял от 0,3 до 0,5. Для уровней NK- и NKT-клеток, HLA DR+ЦТЛ и отношение NK/ЦТЛ коэффициенты корреляции были в диапазоне от 0,5 до 0,7. Для всех остальных показателей они превышали 0,7.
Прогностическая и предиктивная роль изменений показателей врожденной иммунной системы
Результаты анализа связей между динамикой показателей врожденной иммунной системы в начале терапии и эффективностью лечения представлены в табл. 2.
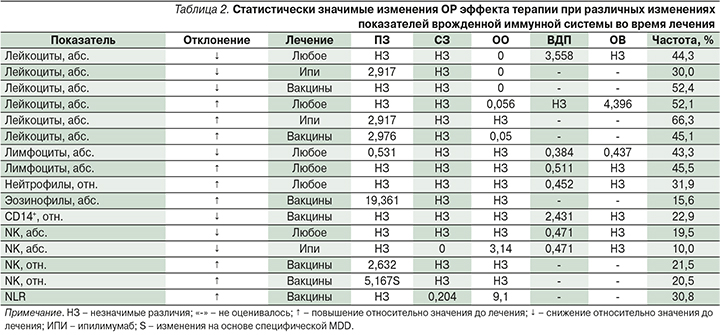
Стабильный уровень лейкоцитов в динамике ассоциировался с наибольшей эффективностью терапии (р=0,011). При этом в случае терапии ипилимумабом эффект оказался более выраженным (р=0,045) по сравнению с применением вакцин (р=0,226). Повышение уровня лейкоцитов увеличивало риск смерти (р=0,04), тогда как снижение показателя увеличивало риск ПЗ (р=0,034) у больных меланомой. Необходимо отметить, что при повышении уровня лейкоцитов в динамике также наблюдалась тенденция к увеличению риска ПЗ, однако она не достигла заданного нами уровня значимости (р=0,069).
Снижение абсолютного уровня лимфоцитов в динамике у больных меланомой было ассоциировано с меньшей частотой ПЗ (39,2 против 44,4%, р=0,026). При оценке ОВ и ВДП также отмечено статистически значимое снижение рисков (р=0,036 и р=0,002 соответственно). Повышение уровня лимфоцитов также снижало относительный риск ПЗ, но не смерти (р=0,019 и р=0,308 соответственно). Изменение относительного уровня лимфоцитов не имело связи с эффективностью лечения либо рисками наступления ПЗ или смерти (р>-0,05).
Общий уровень моноцитов, а также уровень CD14+-моноцитов, как относительный, так и абсолютный, не имел связи с частотой ОО в анализируемых группах больных (p>0,05). При оценке ОВ и ВДП у больных меланомой связи динамики уровня моноцитов с эффектом терапии также выявлено не было (р>0,05). Вместе с тем снижение относительного уровня CD14+-мононуклеаров в динамике являлось значимым негативным фактором прогноза ВДП (р=0,049) у больных, получавших вакцинотерапию (показатель больных, получавших лечение ипилимумабом, не оценивался).
Нами не было выявлено связи изменения уровня нейтрофилов с ответом на лечение в анализируемых группах больных (p>0,05). При оценке ОВ и ВДП у больных меланомой рост относительного уровня нейтрофилов в процессе лечения ассоциировался с меньшим риском ПЗ (р=0,0425), но не смерти (р=0,236). При росте уровня эозинофилов в динамике было отмечено увеличение частоты ПЗ у больных меланомой, получавших вакцины (р=0,01). Изменения относительного уровня данных клеток не имели статистически значимых связей с эффективностью лечения (р>0,05). Изменение уровня эозинофилов не было также связано с изменением риска ПЗ или смерти (p>0,05). Изменение уровня базофилов также не было связано с анализируемыми исходами (p>0,05).
Снижение в динамике абсолютного уровня NK-клеток (при использовании общих, но не специфических MDD) у больных, получавших ипилимумаб, сопровождалось повышением вероятности достижения ЧР с 3,6 до 28,6% (р<0,05). У больных с повышением данного показателя в динамике ОО не наблюдался вовсе, хотя в целом изменения оказались статистически не значимыми (р=0,213). Данные закономерности отразились и на статистически значимом снижении риска ПЗ (р=0,009). Вместе с тем при использовании специфических для NK-клеток MDD различия были более явными и достигали заданного в исследовании уровня значимости (р=0,016), однако не транслировались в изменение риска ПЗ или смерти в многофакторных моделях ОВ и ВДП (р>0,05). При оценке лечения больных в целом без учета вида лечения помимо вышеуказанной тенденции наблюдалось и статистически значимое снижение частоты ПЗ у пациентов со снижением абсолютного содержания NK-клеток в динамике (р<0,05). При этом связь относительного уровня NK при использовании специфических MDD оказалась на грани заданного нами уровня значимости (р=0,062). При оценке динамики относительного, но не абсолютного уровня показателя с использованием специфических MDD выявлялась похожая тенденция, которая проявлялась в увеличении частоты ЧР с 0 до 11% у пациентов со снижением уровня NK-клеток в динамике (р=0,026). Повышение относительного уровня NK-клеток у больных, получавших вакцины, ассоциировалось с повышенной частотой ПЗ (р=0,038).
Изменение числа NKG2D активированных NK-клеток и уровня CD1d+-лимфоцитов не имело связи с эффективностью лечения ипилимумабом (p>0,05). Связи показателей фагоцитарной активности с эффектом терапии или параметрами выживаемости больных, получавших вакцинотерапию, в нашем исследовании выявлено не было (p>0,05).
Прогностическое и предиктивное значение изменения показателей адаптивной иммунной системы
Результаты анализа связей между динамикой показателей адаптивной иммунной системы в начале терапии и эффективностью лечения представлены в табл. 3.
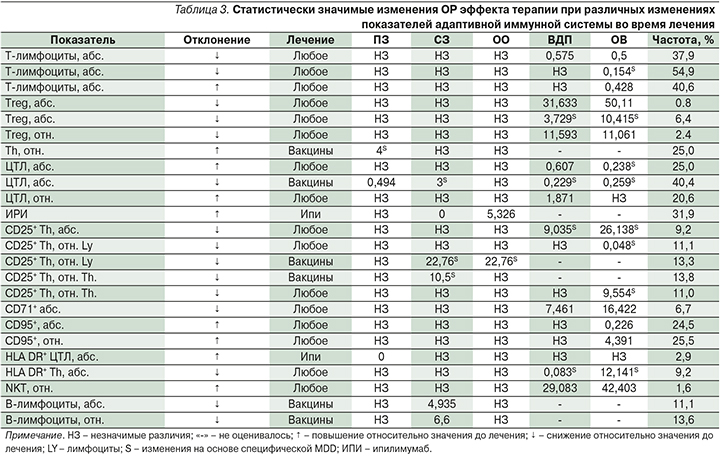
Нами не выявлено связи изменения уровня Т-лимфоцитов с эффективностью лечения в оцененных группах пациентов при использовании общих MDD (р>0,05). При оценке ОВ оказалось, что как снижение, так и повышение абсолютного, но не относительного, уровня Т-лимфоцитов в динамике при оценке на основании общих MDD служило благоприятным фактором прогноза ОВ (р=0,011 и р=0,006 соответственно). Лишь снижение абсолютного уровня Т-лимфоцитов имело статистически значимую связь с риском ПЗ (р=0,028). При оценке относительного уровня T-лимфоцитов с использованием специфических MDD наблюдалась статистически значимая тенденция к большей эффективности терапии больных с повышением данного показателя в динамике (р=0,028), но значимых различий в частоте какого-либо варианта ответа выявлено не было (р>0,05). Изменение относительного уровня Т-лимфоцитов не добавляло дополнительной информации к моделям прогнозирования ОВ и ВДП при использовании любых MDD (р>0,05).
Нами не выявлено связи изменения абсолютного уровня Th с эффективностью лечения в оцененных группах пациентов (р>0,05). При использовании специфических MDD в отношении больных, получавших вакцины, наблюдалась более высокая частота ПЗ при росте относительного содержания Th в динамике (р<0,05). Однако в целом связь между динамикой изменений и ответом на терапию оказалась статистически не значимой (р=0,193) и cохранялась таковой при использовании специфических MDD (p>0,05). При оценке выживаемости связи изменения уровня Th с ОВ и ВДП выявлено не было (р>0,05).
Снижение абсолютного уровня ЦТЛ в динамике у больных, получавших вакцины, было ассоциировано с меньшей частотой ПЗ (17,2%) по сравнению с больными с повышением значения показателя (50%). При использовании специфических MDD для сравнения наблюдалась аналогичная по сути тенденция к повышению частоты CЗ у больных, получавших вакцины (р<0,05). Однако в целом значимость связи между ответом на лечение и динамикой уровня ЦТЛ, оказалась выше заданного нами уровня значимости (р=0,084 для общих MDD и р=0,085 для специфических). Интересно отметить, что повышение, а не понижение абсолютного уровня ЦТЛ было значимым независимым благоприятным фактором прогноза ВДП (р=0,033). Повышение относительного уровня, наоборот, являлось неблагоприятным фактором (р=0,018). Как повышение, так и понижение в динамике уровня ЦТЛ при использовании специфических MDD служило благоприятным фактором прогноза (р=0,006 и р=0,009 соответственно). Снижение в динамике уровня ЦТЛ снижало также риск ПЗ (р=0,005). Относительный уровень ЦТЛ не имел значимых связей с эффективностью терапии или показателями ОВ при использовании для сравнения специфических MDD (р>0,05).
Нами не выявлено связи уровня NKT-клеток с эффективностью лечения во всех оцененных группах пациентов при использовании как общих, так и специфических MDD (р>0,05). Вместе с тем повышение относительного уровня NKT-клеток в динамике при использовании для сравнения общих MDD служило выраженным фактором неблагоприятного прогноза как ОВ, так и ВДП (р=0,002 и р=0,004 соответственно).
Динамика уровня Treg не имела связи с частотой ответов на лечение в оцененных группах пациентов (р>0,05). Между тем при оценке как ОВ, так и ВДП снижение абсолютного уровня этих клеток оказалось неблагоприятным фактором прогноза при использовании общих MDD (р=0,002 и р=0,003 соответственно). При использовании специфических MDD выявлены аналогичные изменения, но с меньшим размером относительного риска (р=0,001 и р=0,025 соответственно). При анализе изменения относительного уровня данных клеток статистически значимое влияние в многофакторной модели было выявлено лишь на показателе ОВ при использовании общих MDD (р=0,026).
Связи уровня двойных позитивных (DP) и двойных негативных (DN) Т-лимфоцитов с ответом на лечение выявлено не было (р>0,05). Изменение уровня DN не было связано с изменением риска ПЗ или смерти (p>0,05). При оценке уровня DP оказалось, что при использовании для сравнения общих MDD рост показателя в динамике был неблагоприятным фактором прогноза как ОВ, так и ВДП (р=0,042 и р=0,048 соответственно). При использовании для сравнения специфических MDD таких связей выявлено не было (р>0,05).
Изменение числа CD25+, CD38+, CD71+, CD95+, HLA DR+-лимфоцитов не имело связи с эффективностью вакцинотерапии (p>0,05). При оценке выживаемости оказалось, что снижение абсолютного уровня CD71+-лимфоцитов в динамике является неблагоприятным фактором прогноза как ОВ, так и ВДП (р=0,002 и р=0,008 соответственно). Повышение в динамике абсолютного уровня CD95+-клеток, наоборот, являлось благоприятным фактором прогноза ОВ (р=0,03), но не влияло на ВДП (р=0,559). Рост относительного содержания этих клеток, наоборот, являлся фактором неблагоприятного прогноза ОВ (р=0,02). Связи общей экспрессии CD38 и CD25 на лейкоцитах с показателями ОВ и ВДП выявлено не было (p>0,05). Связи уровня активированных CD38+Th, CD25+ Th, CTLA4+Th с эффектом терапии, а также с изменением риска прогрессирования или смерти выявлено не было (р>0,05).
При использовании для сравнения специфических MDD была выявлена значимая связь между относительным уровнем CD25+Th и эффективностью вакцинотерапии (р=0,024 относительно Th и р=0,015 относительно Ly), при снижении которых возрастала вероятность достижения клинического эффекта терапии. При анализе ОВ снижение абсолютного уровня этих клеток играло выраженную негативную роль в прогнозе ОВ (р=0,005) и ВДП (р=0,041), как и повышение их содержания относительно Th (р=0,025), тогда как снижение их содержания относительно Ly, наоборот, служило благоприятным фактором прогноза ОВ (р=0,047).
Связи показателей HLA DR+Th с эффектом терапии в нашем исследовании выявлено не было (p>0,05). При анализе ОВ снижение в динамике абсолютного уровня HLA DR+Th являлось негативным фактором прогноза ОВ (р=0,032) а при использовании специфических MDD – благоприятным фактором прогноза ВДП многофакторной модели (р=0,029).
При анализе изменений HLA DR+ЦТЛ c использованием общих MDD-связи с эффективностью терапии, а также с изменением риска ПЗ или смерти выявлено не было (р>0,05). В подавляющем большинстве наблюдений изменений показателя с использованием указанных границ не наблюдалось. Вместе с тем при использовании специфических MDD в отношении больных с повышением в динамике числа HLA DR активированных лимфоцитов не наблюдалось ПЗ (р<0,05). Однако в целом связь между изменением уровня HLA DR-активированных ЦТЛ и эффектом по системе RECIST оказалась статистически не значимой (р=0,159). Изменения относительного уровня активированных ЦТЛ не имели статистически значимых связей с эффективностью лечения при использовании любых MDD (р>0,05).
Связи уровня активированных CD38+ЦТЛ, NKG2D+ЦТЛ с эффектом терапии больных меланомой, получавших ипилимумаб, выявлено не было (р>0,05).
Изменение в динамике уровней CD3+CD27+CD62L+ и CD3+CD28+CD62L+-лимфоцитов, центральных и эффекторных клеток памяти, содержания наивных Т-лимфоцитов не было связано с эффективностью терапии ипилимумабом больных меланомой (р>0,05).
Снижение абсолютного уровня B-лимфоцитов в динамике было ассоциировано с повышенной частотой СЗ на фоне вакцинотерапии (р=0,048). При оценке относительного уровня В-лимфоцитов наблюдалась аналогичная тенденция (р=0,048). Вместе с тем использование специфичных для данного показателя MDD не позволяло выявлять статистически значимой взаимосвязи динамики данного показателя с эффективностью лечения (р->0,05). Влияния динамики уровня B-лимфоцитов на показатели выживаемости выявлено не было (р>0,05). Связи динамики содержания ЦИК с эффективностью выявлено не было (р>0,05).
Изменение соотношения CD3+- и CD4+-клеток, NK- и NKT-клеток, ЦТЛ, ЦТЛ и Treg не имело связи с эффективностью терапии или показателями выживаемости в изученных нами группах пациентов при использовании как общих, так и специфических для данного показателя MDD (р>0,05). У больных с повышением ИРИ на фоне терапии ипилимумабом отмечено увеличение частоты ОО при использовании общих, но не специфических MDD (р=0,007). Однако эти изменения не имели связи с показателями выживаемости в нашем исследовании (р>0,05).
Обсуждение
Целью противоопухолевой иммунотерапии является активация противоопухолевого иммунного ответа. Различные методы иммунотерапии имеют разные механизмы реализации этого действия. Вакцинотерапия направлена на индукцию противоопухолевого иммунного ответа путем обеспечения процесса распознавания антигена и использования прежде всего первого сигнала иммунного синапса, т.е. активации взаимодействия Т- и В-клеточных рецепторов с антиген-презентирующей клеткой [4]. Анти-CTLA4-терапия, напротив, снимает блокировку с центральных Т-клеток памяти, тем самым улучшая их активацию и созревание в эффекторные клетки [5]. Результатом такого воздействия должен быть пролиферативный ответ прежде всего,эффекторных клеток иммунной системы, к которым можно отнести ЦТЛ. NK-клетки также могут выполнять противоопухолевые функции, обеспечивая HLA-независимый иммунный ответ [6, 7]. При этом на отдельных, особенно ранних, этапах действия препарата возможно снижение содержания эффекторных популяций в крови благодаря выходу клеток в ткани и их уходу из циркуляции, как это было показано для различных форм интерлейкина-2 [8]. Таким образом, ожидаемым признаком активации противоопухолевого иммунного ответа является изменение содержания эффекторных популяций иммунных клеток на фоне лекарственного воздействия на иммунную систему. Напротив, отсутствие реакции свидетельствует об энергии иммунной системы, что было ранее описано другими авторами как негативный прогностический фактор.
В нашем исследовании прогностически наиболее благоприятными реакциями были изменения как общего уровня лимфоцитов, так и уровня эффекторных клеток – Т-лимфоцитов, за счет ЦТЛ. Это подтверждается снижением риска как ПЗ, так и смерти при анализе данных показателей. Напротив, активация неспецифических и компенсаторных механизмов иммунного ответа, таких как активация NKT-лимфоцитов и NK-клеток, изменение уровня лейкоцитов, ассоциировалась с меньшей вероятностью эффекта, более высокими рисками прогрессирования и смерти. При анализе литературных данных оказалось, что различные субпопуляции и маркеры NK-клеток могут иметь разное прогностическое значение как при отдельных заболеваниях, так и в пределах одной нозологической единицы [2, 7]. Повышение уровня лейкоцитов до лечения чаще являлось негативным прогностическим фактором или не имело связи с терапией [9]. Необходимо отметить, что стабильный уровень лейкоцитов на фоне лечения встречался относительно редко. Ввиду этого полученные нами результаты, несмотря на значимость в многофакторном анализе, требуют подтверждения в дальнейших исследованиях.
Неожиданным для нас стало снижение риска прогрессирования у больных с нарастанием относительного уровня нейтрофилов в динамике, поскольку эти клетки относятся к эффекторам врожденной иммунной системы, следовательно, обычно отражают неблагоприятный прогноз по данным многочисленных исследований [9]. Тем не менее в нашей работе как повышение относительного уровня нейтрофилов, так и рост NLR в динамике был ассоциирован с повышенной эффективностью лечения. Возможной причиной такой находки является поляризация нейтрофилов, определенные субпопуляции которых могут, по данным некоторых исследований, обладать противоопухолевыми функциями [10, 11].
Другим необычным наблюдением в нашем исследовании является негативная прогностическая роль снижения уровня регуляторных субпопуляций – как собственно Treg (CD3+CD4+CD25highCD127low), так и абсолютного уровня CD25+ активированных Th. При этом снижение относительного уровня последних клеток носило явно позитивный прогностический характер и было ассоциировано с повышенной частотой ответа на лечение и снижением риска смерти. Подобные изменения свидетельствуют о необходимости гармоничной активации иммунной системы и о негативной роли дисбаланса в ее работе при изолированном изменении количества отдельных субпопуляций лимфоцитов. Однако наше наблюдение лишь отчасти согласуется с результатами других исследователей, в которых наблюдалась противоположная по значению связь данного показателя с эффективностью лечения, не всегда подтверждавшаяся статистически [12].
Относительная редкость некоторых из приведенных значимых изменений показателей в динамике не позволяет эффективно оценить их взаимосвязь и роль в развитии тех или иных иммунологических синдромов. Вместе с тем наше исследование показало, что большинство прогностически значимых изменений иммунологических показателей отмечаются у относительно небольшого числа пациентов. С одной стороны, это отражает реальную эффективность методов иммунотерапии, включенных и наше исследование. С другой стороны, это дает возможность использования оценок состояния иммунной системы без учета их динамики для определения прогностической роли иммунологических показателей в процессе лечения.
Заключение
В заключение необходимо подчеркнуть, что мониторинг состояния иммунной системы в процессе терапии может предоставить важную информацию о развитии эффекта лечения до проведения рутинной радиологической оценки ответа по системе RECIST. Необходима комплексная оценка результата как с учетом состояния Т-клеточного звена адаптивной иммунной системы, так и с включением в анализ реакции врожденной иммунной системы и (при использовании вакцинотерапии) В-клеточного иммунного ответа.


