Введение
Исторически сложилось так, что с точки зрения поддержки функций нервной системы, потенцирования нейропластичности развивающегося мозга у новорожденных, детей школьного возраста и подростков обсуждается влияние группы витаминов В, а витамин D рассматривается лишь под углом его участия в костном метаболизме. В то же время исследования, проводимые в течение последних 10 лет, подчеркивают неуместность столь узкого понимания роли гормона-витамина D. В частности, центральная нервная система (ЦНС) получает все большее признание в качестве органа-мишени для витамина D [1]. Судя по динамике публикаций, систематическое исследование нейротропных свойств витамина началось, по всей видимости, с 2005 г. (рис. 1).
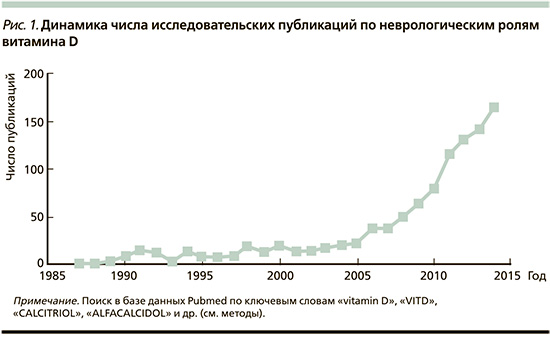
При дефиците витамина D у детей значительно чаще развивается целый спектр неврологических нарушений (головная боль, артериальная гипертензия, обморочные состояния, сложности становления речи, памяти и даже ранний инсульт, эпилепсия и демиелинизирующие заболевания, рассеянный склероз с более высокой частотой рецидивов и большей площадью поражений, устанавливаемых по данным магнитно-резонансной томографии) [2, 3]. Гиповитаминоз D, который начинается после резкого прекращения программ по профилактике рахита в детском и подростковом возрасте, обусловливает ранний старт ишемического инсульта (ИИ) [4], увеличивает риск деменции в зрелом и пожилом возрасте [5].
Фундаментальные исследования установили, что нейропротекторные, нейротрофические, антигипертензивные свойства витамина D начинают работать с внутриутробного периода и раннего детства. Эти неврологические функции витамина D развиваются по соответствующим молекулярно-клеточным механизмам [6]. Уже в фазе эмбрионального развития количество гормона-витамина D становится сравнимо с количеством такого столь важного нейроспецифического фермента, как тирозин гидроксилаза, который регулирует биосинтез катехоламинов за счет синтеза дигидроксифенилаланина (ДОФА) из тирозина (рис. 2). Гены, кодирующие ферменты, которые участвуют в метаболизме витамина D, а также экспрессируются в клетках головного мозга, осуществляют биосинтез активной формы витамина – 1,25-дигидроксивитамина D – 1,25(OH)2D3 с помощью 25-OH-D3-1α-OH-синтетазы в нейронах и активированной микроглии [7].
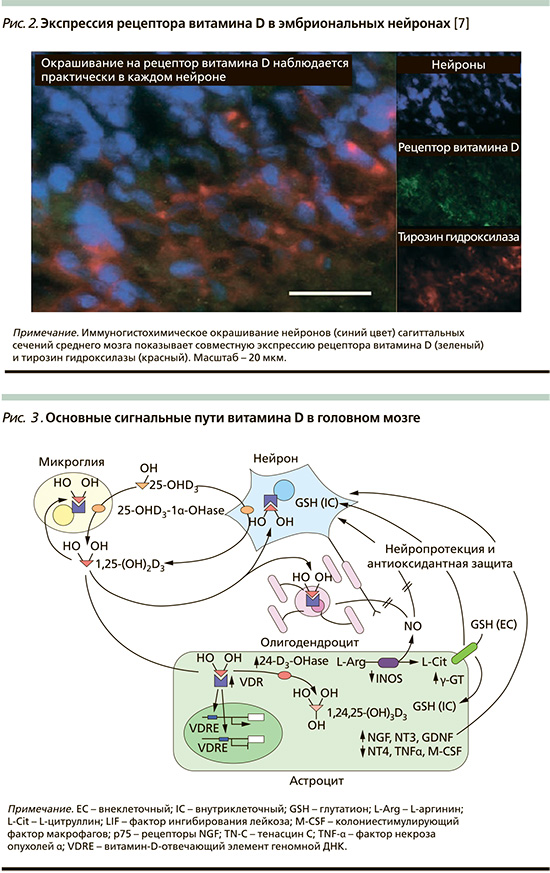
На 20–22-й неделях внутриутробного развития в нейронах и глие мозга плода формируются рецепторы к витамину D (VDR – vitamin D receptor).
В первые годы жизни плотность VDR в ЦНС возрастает в десятки раз при условии поступления витамина D с пищей или в виде препаратов. В астроцитах витамин D в форме 1,25(OH)2D3 активирует синтез нейротрофинов NGF (nerve growth factor), NT3 (neurotrophin-3) и GDNF (glial cell derived neurotrophic factor). Все вышеназванные факторы являются важнейшими факторами нейропластичности и развития мозга ребенка. Торможение синтеза INOS (inducible nitric oxide synthase) посредством 1,25(OH)2D3 оказывает нейропротекторное действие, т.к. возникающие при ишемии высокие уровни оксида азота (NO) токсичны как для нейронов, так и для олигодендроцитов (миелинизирующих клеток) [8]. Другие эффекты витамина D в ЦНС включают иммуномодуляцию (снижение воспаления и инфильтрации макрофагов, рис. 3).
Эффекты витамина D на развитие ЦНС, когнитивной и мнестической функций у детей следует рассматривать с разных сторон.

Во-первых, нейротропное действие витамина D на детей во многом опосредовано цереброваскулярными эффектами витамина. Витамин D уменьшает воспаление эндотелия сосудов; характеризуется антигипотензивным действием (в частности, воздействием на ренин-ангиотензиновую систему – РАС) и снижает уровень дислипидемии [9].
Во-вторых, витамин D обладает и самостоятельными нейропротекторным и нейротрофическим действиями, особенно в гиппокампе и стриатуме, что чрезвычайно важно для восстановления пациентов после родовой травмы, черепно-мозговой травмы (ЧМТ) инсульта и др. [10–16].

В-третьих, витамин D является нейростероидом и неотъемлемым элементом нейроэндокринной регуляции развития нервной системы с внутриутробного периода. Поэтому дефицит нейроактивного витамина D оказывает отрицательное нейрокогнитивное воздействие: например, дефицит витамина в пренатальный период ассоциирован с резким повышением риска развития алекситимии у детей (рис. 4). Заметим, что использование витамина D в терапии и профилактике болезни Альцгеймера (мемантин, β-амилоид), болезни Паркинсона, а также связь между обеспеченностью витамином и когнитивными способностями будут рассмотрены в отдельной статье. Роль витамина D как нейростероида также заслуживает отдельного рассмотрения (более 500 публикаций по данному вопросу) [17–22].
В-четвертых, дефицит витамина D стимулирует и усугубляет течение заболеваний с демиелинизирующим компонентом, связанных с инфекцией Эпштейн–Барра и энцефаломиелитом. Адекватная обеспеченность организма витамином стимулирует процессы ремиелинизации и может существенно улучшить качество жизни детей и взрослых с этими заболеваниями.
Далее в настоящей статье последовательно рассмотрены результаты исследований по взаимосвязи дефицита витамина D и риска ИИ, нейротрофических эффектов витамина D, перспективы использования препаратов витамина D для восстановления пациентов после ЧМТ, при пароксизмальном головокружении, эпилепсии и боковом амиотрофическом склерозе.
Дефицит витамина D и инсульт
У пациентов с ИИ часто отмечается сниженная минеральная плотность костной ткани [13], что само по себе указывает на дефицит и нарушения метаболизма витамина D. Считается, что формирование дефицита витамина D и рост риска инсульта начинаются за годы и даже десятки лет до эпизода острого нарушения мозгового кровообращения. Связь между низкими уровнями 25-гидроксивитамина-D – 25(OH)D и риском ИИ была подтверждена во многих клинико-эпидемиологических исследованиях, включая крупномасштабное исследование NHANES (National Health and Nutrition Survey): дефицит витамина 25(OH)D<30 нг/мл в сыворотке был отмечен у 71% перенесших инсульт [14].
Низкое диетарное потребление витамина D является независимым фактором риска ИИ (n=8006, мужчины 45–68 лет). За время 34-летнего периода наблюдения – с подросткового и молодого возраста, проведенного в соответствии с этическими стандартами США, в когорте зарегистрировано 960 случаев ИИ. Частота ИИ была достоверно выше (6,38 случая ИИ на 1000 человек) в квартиле пациентов с самым низким потреблением витамина D (менее 40 МЕ/сут) по сравнению группой с самым высоким потреблением (160–800 МЕ/сут, частота ИИ – 5,14 случая на 1000 человек; р=0,03). Следует подчеркнуть, что фактически 3/4 обследованных пациентов характеризовались глубоким дефицитом витамина D (менее 160 МЕ/сут, нижняя граница нормы потребления – 1000 МЕ/сут). Этот факт объясняется тем, что исследование проведено на Гавайях, т.е. на территории, население которой отличается крайне низким уровнем жизни по сравнению с другими штатами США. Ассоциации сохранялись после поправок на возраст, калорийность, индекс массы тела, артериальную гипертензию, сахарный диабет, стаж курения, индекс физической активности, уровень холестерина, потребление алкоголя. Данное соотношение частот соответствовало повышению риска ИИ на 22% (относительный риск [ОР]=1,22; 95% доверительный интервал [ДИ] – 1,01–1,47; р=0,038) [15].
Уровни 25(OH)D у пациентов, перенесших ИИ, были достоверно снижены: дефицит витамина был ассоциирован с повышением риска ИИ на 60% (ОР=1,6; 95% ДИ – 1,2–2,8), кардиоэмболического инсульта – в 2 раза (ОШ=2,0; 95% ДИ – 1,0–3,2) [16]. Сравнение пациентов в верхней трети концентраций 25(OH)D (более 30 нг/мл) со всеми остальными пациентами показало снижение риска ИИ на 40% (ОР=0,60; 95% ДИ – 0,48–0,72) [17].
Многочисленные клинические исследования и мета-анализы показали, что уровни 25(OH)D в сыворотке крови могут использоваться для прогнозирования возраста и тяжести протекания инсульта. В группе пациентов с ИИ (n=382) уровень 25(OH)D<25,7 нмоль/л был предиктором NIHSS (NationalInstitutes of Health Stroke Scale)<6 (ОР=1,67; 95% ДИ – 1,05–2,68; р=0,03). Средний уровень 25(OH)D был ниже у пациентов с умеренным и тяжелым состоянием при выписке [3–6 баллов по модифицированной шкале Рэнкина, 25(OH)D – 35 нмоль/л], чем у пациентов со средним состоянием (48 нмоль/л, р<0,001). У пациентов в самой низкой трети (тертили) уровней 25(OH)D (<25,7 нмоль/л) отмечен более высокий риск умеренной и тяжелой инвалидности (ОР=2,06; 95% ДИ – 1,06–3,94; р=0,03) [18]. Уровни 25(OH)D в сыворотке имеют прогностическое значение для пациентов с острым ИИ: уровни 25(OH)D уменьшаются с ростом тяжести инсульта по шкале NIHSS (коэффициент корреляции r=-0,389; p=0,0001, n=326). Уровень 25(OH)D более 30 нг/мл – независимый прогностический маркер, указывающий на повышение шансов благоприятного функционального результата в 4 раза (ОР=3,96; 95% ДИ – 2,85–7,87), выживаемости – в 3,3 раза (ОР=3,36; 95% ДИ – 2,12–7,08; р=0,0001) [19].
В частности, уровни 25(OH)D в сыворотке крови прогнозируют функциональный исход для пациентов с острым ИИ в течение 90 дней. Оценка состояния пациентов проведена с помощью модифицированной шкалы Рэнкина. Средние уровни 25(OH)D были значительно ниже у пациентов с острым ИИ (14,2 нг/мл, 95% ДИ – 10,2–18,9 нг/мл) по сравнению с контрольной группой (17,9 нг/мл, 95% ДИ – 12,5–22,9 нг/мл; р<0,001). Уровни 25(OH)D более 50 нмоль/л соответствовали снижению риска неблагоприятного функционального исхода на 21% (ОР=0,79; 95% ДИ – 0,73–0,85; р<0,01), смерти – на 30% (ОР=0,70; 95% ДИ – 0,50–0,98; р<0,01) [20].
Наблюдения за когортой из 3135 участников в течение 6 лет показали, что уровни 25(OH)D сыворотки <20 нг/мл соответствовали повышению риска цереброваскулярных событий на 70% (ОР=1,70; 95% ДИ – 1,02–2,83) [21]. Мета-анализ 10 лонгитудинальных исследований (n=58384, 2644 случаев инсульта) подтвердил взаимосвязь дефицита витамина D и риска инсульта. Риск ИИ был повышен на 36% (ОР=1,36, 1,09–1,70) у пациентов с тяжелым дефицитом витамина D (<25,0 нмоль/л, т.е. <10,0 нг/мл) по сравнению с участниками с нормальными уровнями витамина D (>75,0 нмоль/л, т.е. >30,0 нг/мл) [22].
 Другой мета-анализ 7 лонгитудинальных исследований (1214 случаев инсульта в общей сложности) показал, что низкие уровни 25(OH)D (менее 20 нг/мл) ассоциированы с 50%-ным повышением риска развития ИИ (ОР=1,52; 95% ДИ – 1,20–1,85; р=0,04). При этом мета-анализ указал на дозозависимый эффект снижения риска ИИ (рис. 5): повышение уровней 25(OH)D на каждый 0,4 нг/мл соответствовало снижению риска ИИ на 1% (при уровнях 25(OH)D более 24 нг/мл) [23].
Другой мета-анализ 7 лонгитудинальных исследований (1214 случаев инсульта в общей сложности) показал, что низкие уровни 25(OH)D (менее 20 нг/мл) ассоциированы с 50%-ным повышением риска развития ИИ (ОР=1,52; 95% ДИ – 1,20–1,85; р=0,04). При этом мета-анализ указал на дозозависимый эффект снижения риска ИИ (рис. 5): повышение уровней 25(OH)D на каждый 0,4 нг/мл соответствовало снижению риска ИИ на 1% (при уровнях 25(OH)D более 24 нг/мл) [23].
Заслуживает отдельного внимания вопрос о взаимосвязи дефицита витамина D и повышенной смертности от инсульта. Например, в группе пациентов, перенесших инсульт (n=382), установлена ассоциация между низкой концентрацией витамина D в сыворотке крови и повышенной смертностью в течение первого года после инсульта. Среди пациентов, перенесших инсульт, 63 (16,5%) умерли в течение первого года. Средний уровень 25(OH)D в этой подгруппе пациентов был ниже (13±9 нг/мл) по сравнению с подгруппой выживших (18±12 нмоль/л; р<0,001) [24].
Связь между летальным ИИ и дефицитом витамина D была подтверждена в крупномасштабных клинико-эпидемиологических исследованиях. Сниженные уровни витамина D (<30 нг/мл, т.е. 75 нмоль/л) служат независимым предиктором летального инсульта в когорте пациентов (n=3316). Повышение уровней на каждые 10 нг/мл приводило почти к 2-кратному снижению риска летального исхода после инсульта (ОР=0,58; 95% ДИ – 0,43–0,78; р<0,001) [25]. Клинико-эпидемиологическое исследование NHANES-III (n=7981) показало, что низкие уровни 25(OH)D ассоциированы с повышением риска летального исхода инсульта. В течение 14 лет в когорте зарегистрировано 116 случаев инсульта. После поправок на другие факторы риска уровни 25(OH)D ниже 15 нг/мл были связаны с 2-кратным повышением риска летального исхода при инсульте (ОР=2,13; 95% ДИ – 1,01–4,50) [26].
О нейротрофических эффектах витамина D
Трудно переоценить важнейшую роль инсульта и ЧМТ в формировании детского церебрального паралича.
В раннем возрасте потенциал пластичности даже поврежденного мозга у ребенка максимален, поэтому важно активно использовать это терапевтическое окно. Экспериментальные и клинические исследования показали, что «противоинсультный» потенциал витамина D обусловлен не только его вазопротекторным действием, но и четко выраженными нейропротекторными и нейротрофическими эффектами. Нейропротекторное действие витамина D включает не только регуляцию уровней ионов Са2+ (вовлеченных, как известно, в процессы апоптоза), но и антиоксидантные, а также нейроиммуномодуляторные эффекты, а нейротрофическое – стимулирование синтеза/секреции нейротрофинов [1–8].
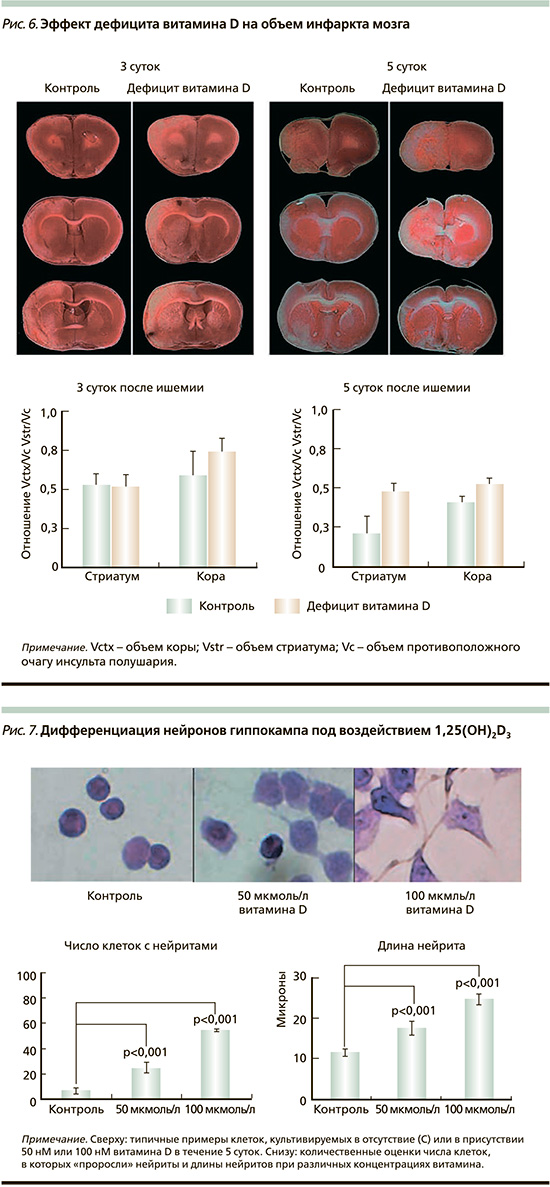
Дефицит витамина D усугубляет повреждения мозга при ишемии и нарушает регуляцию вызываемого ишемией воспаления. В эксперименте модель инсульта (окклюзия средней мозговой артерии) создавалась через 8 недель после содержания животных на витамин-D-дефицитной диете. Дефицитная по витамину диета привела к снижению уровней витамина D в крови до 22% от уровня в контрольной группе. Объемы инфарктов мозга при дефиците витамина D были достоверно больше (рис. 6), а неврологическое тестирование показало более серьезные, чем в группе контроля, постинсультные поведенческие нарушения. При дефиците витамина D также отмечены более низкие уровни нейропротекторного гормона IGF-I (insulin-like growth factor 1) в плазме и полушарии, перенесшем ишемию, и более низкие уровни интерлейкинов (ИЛ) ИЛ-1a, ИЛ-1b, ИЛ-2, ИЛ-4. Важно, что скоровспомощной прием витамина D не имел положительного действия на сокращение объема инфаркта или улучшение неврологического состояния; важен именно достаточный уровень витамина D в крови для защиты от развития инсульта и для более успешной реабилитации [27].
Эксперименты на культурах клеток показали, что кальцитриол (1,25(OH)2D3) уменьшает эксайтотоксичные эффекты глутамата. Кальцитриол (50–100 нМ) проявлял нейропротекторные свойства при введении совместно с глутаматом или при введении через 6 часов после введения глутамата в культуру клеток гиппокампа и неокортекса [28].
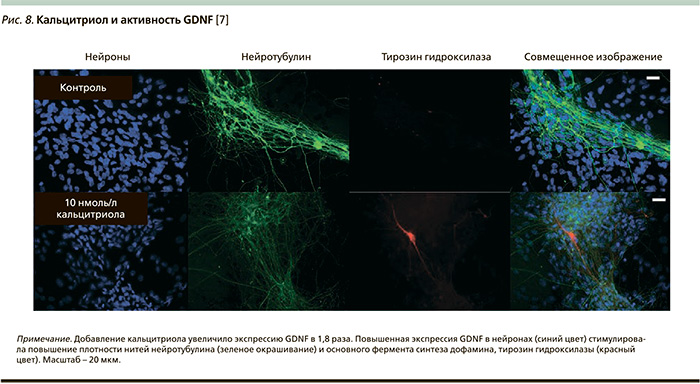
Активная форма витамина 1,25(OH)2D3 дозозависимо стимулирует появление маркеров дифференцировки (Bcl2, ФРН, STAT3) и уменьшение маркеров деления клеток (циклин-1, PCNA – Proliferating cell nuclear antigen) в эмбриональных клетках гиппокампа. Например, дифференцировка эмбриональных нейронов сопровождается ускоренным формированием аксонов и дендритов (рис. 7) [29]. Чем более выражен процесс арборизации (ветвления) и спраутининга (прорастания отростков) нейронов у плода, тем выше потенциал нейропластичности, лучше прогноз высших функций ЦНС (формирование речи, музыкального слуха, краткосрочной и длительной памяти, тонкой моторики, почерка, навыков рисования, удержание внимания и способности к обучению). Наряду с гиперактивностью недостаток или дефицит внимания служит основным препятствием на пути нормального интеллектуального развития ребенка.
Важно отметить, что кальцитриол обладает самостоятельным нейротрофическим действием и повышает уровни глиального нейротрофического фактора (GDNF – Glial cell derived neurotrophic factor) (рис. 8) [7, 30].
Нейропротекторный эффект кальцитриола при цереброваскулярной ишемии осуществляется посредством сигнальных путей NR3A/CREB. Внутрибрюшинное введение кальцитриола в эксперименте значительно снижало объем зоны ишемии мозга через 7 дней после реперфузии на фоне повышения активности сигнальных путей клеточного выживания в нейронах гиппокампа: NR3A (nuclear receptor subfamily 3, group A), внеклеточной регулируемой киназы (ERK1/2) и фосфорилированной формы сигнального белка «цАМФ/Ca2+-отвечающий элемент» (CREB – cAMP response element-binding protein) [31].
Витамин D и восстановление после ишемического повреждения мозга и ЧМТ
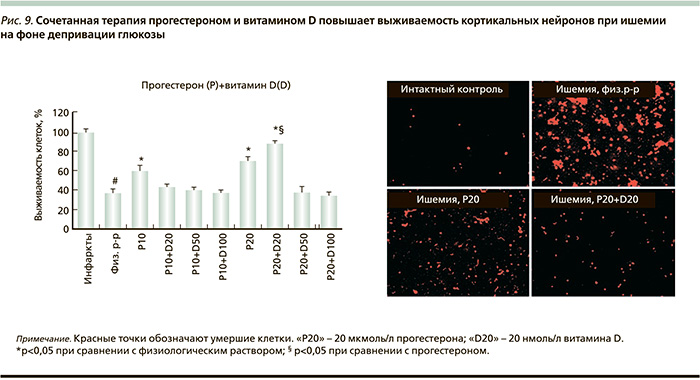
Витамин D и стероидные гормоны (прогестерон, глюкокортикоиды и т.д.) модулируют апоптоз, воспаление, окислительный стресс, эксайтотоксичность и эффективны при лечении ишемии (в частности, ЧМТ). Так, комбинированная терапия (прогестерон 16 мг/кг, витамин D 5 мкг/кг, внутрибрюшинно через час после травмы и затем в течение 7 суток) значительно снижала потери нейронов и пролиферацию реактивных астроцитов. Установлен синергидный эффект витамина D и прогестерона в предотвращении деградации белка, ассоциированного с микротрубочками (MAP-2), что ослабляет долгосрочные последствия ЧМТ [32].
В эксперименте и в клинике комбинированная терапия прогестероном и витамином D более эффективна для предотвращения последствий ишемии, чем монотерапия прогестероном. Сочетанное применение этих стероидных гормонов стимулирует активность нейротрофического фактора мозга (BDNF – Brain-derived neurotrophic factor) за счет активации тирозин-киназного рецептора BDNF (trkB) и путей выживания нейронов (ERK1/2 – extracellular-signal-regulated kinase1/2) [33]. Синергизм между прогестероном и витамином D дозозависим: оптимально сочетание 20 мкмоль/л прогестерона и 20 нмоль/л витамина D (рис. 9).
Сочетанное применение прогестерона с витамином D способствует улучшению исходов для пациентов с ЧМТ. В рандомизированном исследовании пациентов с тяжелой ЧМТ (исходный балл по шкале комы Глазго<8, n=60), оценка по шкале комы через 3 месяца после лечения увеличивалась на 5,3±3,2 балла при совместном применении, на 3,9±2,1 – при применении только прогестерона и только на 2,8±2,0 балла в группе плацебо (р=0,001) [34].
Витамин D и головокружение
Снижение уровней витамина D сыворотки отмечено при позиционном головокружении (головокружение при катании на карусели, в транспорте, на высоте и т.д.). У пациентов с позиционным пароксизмальным головокружением отмечена частая встречаемость дефицита витамина D (<30 нг/мл) [35]. Недостаточность витамина D (10–20 нг/мл) была ассоциирована с 4-кратным риском вертиго (ОР=3,8; 95% ДИ – 1,51–9,38; р=0,004), а дефицит витамина D (<10 нг/мл) – с 23-кратным риском головокружения (ОР=23,0; 95% ДИ – 6,88–77,05; р<0,001) [36].
О взаимосвязи эпилепсии и дефицита витамина D
С дефицитом витамина D связаны многочисленные дисфункции мозга, т.к. витамин D является важным эндогенным регулятором нейропротекции, подавления судорожной активности, нейроиммуномодуляции и нейротрансмиссии и у детей, и в зрелом возрасте [37].
В пилокарпиновой модели височной эпилепсии установлены изменения экспрессии гена рецептора витамина D [38]. Экспериментальная делеция гена VDR вызывает повышение тяжести судорог, химически индуцированных пентилентетразолом (70 мг/кг). Делеция VDR приводила к значительно более низкому порогу судорожной активности, более высоким баллам по шкале Расина и повышенной смертности [39]. В эксперименте 1,25(OH)2D3 (инъекции 50 мкг) приводит к повышению порога судорожной активности гиппокампа. Стимулируемое 1,25(OH)2D3 увеличение порога происходило через 5–10 минут после инъекции и сохранялось по крайней мере 120–180 минут. Внутривенное введение 1,25(OH)2D3 также приводило к повышению порога судорожной активности, но эффект длился только 30 минут [40].
О других неврологических ролях витамина D
Весьма важными являются упомянутые ранее цереброваскулярные эффекты витамина D – противовоспалительный и антигипотензивный. Дети и подростки с низким уровнем витамина D в крови имеют высокий риск старта артериальной гипертензии в молодом возрасте. Безусловно, особого внимания также заслуживает изучение витамина D как нейростероида. Кальцитриол улучшает эндотелий-зависимую вазодилатацию в моделях с гипертоническим повреждением почек, повышая уровни белка Klotho, вызываемое ацетилхолином снижение артериального давления, снижая экскрецию 8-эпи-простагландина F2A, окислительный стресс и альбуминурию без изменений в почечных уровнях ангиотензина II [41].
Противовоспалительный эффект.
В экспериментальной модели стеатогепатоза колекальциферол (витамин D3) снижает воспаление, улучшает когнитивную дисфункцию на фоне снижения уровней фактор некроза опухоли α в мозге [42]. Ассоциация между статусом витамина D и маркерами сосудистого здоровья у пациентов с синдромом хронической усталости и энцефаломиелитом [43]. При аллергическом энцефаломиелите прием витамина D снижает воспаление путем понижения уровня сфингозин-1-фосфата в сыворотке и спинномозговой жидкости [44].
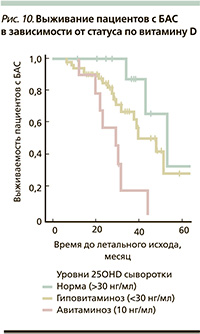
Витамин D обеспечивает защиту мотонейронов при боковом амиотрофическом склерозе (БАС), паралитическом расстройстве с прогрессирующей дегенерацией мотонейронов в головном и спинном мозге, при атаксии. Витамин D усиливает эффекты нейротрофических факторов, защищает мотонейроны от Fas-индуцированного апоптоза. Даже у молодых пациентов с БАС дефицит витамина D существенно ускоряет темпы прогрессирования заболевания (в 3–4 раза), заметно сокращая продолжительность и качество жизни пациентов (рис. 10) [45].
Обеспеченность витамином D – важный фактор поддержки развития когнитивных способностей у детей и подростков, а также фактор долговременного прогноза нейропсихического здоровья в последующие годы.
Заключение
Витамин D играет уникальную роль в гомеостазе мозга, эмбриогенезе и развитии нервной системы, осуществляя иммуномодуляцию в ЦНС, проявляя нейропротекторные и нейротрофические свойства. Наблюдаемая во всем мире «пандемия» гиповитамино-за D может быть связана, в частности, с нарушениями функции почек, обусловленными повышенной активностью РАС [46]. И наоборот, витамин D действует как негативный регулятор гена ренина, так что дефицит витамина D стимулирует избыточную активность РАС [47]. Повсеместная распространенность дефицита витамина D позволяет утверждать, что поддержание адекватной обеспеченности организма ребенка витамином D является важным фактором реабилитации и повышения нейропластичности после перенесенной ЧМТ, инсульта, развития, демиелинизирующих заболеваний (рассеянный склероз, БАС), при пароксизмальном вертиго, эпилепсии, алекситимии, синдроме дефицита внимания. Компенсация недостаточности витамина D при этих заболеваниях располагает значительным нейропротекторным, профилактическим и лечебным потенциалом [48, 49].
Для детей и подростков с последствиями родовой травмы, детским церебральным параличом, синдромом дефицита внимания, с трудностями обучения, реконвалесцентам после перенесенных нейроинфекций жизненно важно использование эффективной и безопасной поддержки нейропластичности путем включения в программу ведения ребенка водорастворимой формы витамина D3 Аквадетрим (колекальциферол) по 2–4 капли в сутки курсом 6–12 месяцев (1 капля=500 МЕ; 2 капли=1000 МЕ, 4 капли=2000 МЕ) ежедневно. Данный препарат характеризуется безупречной фармакологической историей применения детьми с рождения, подростками, беременными и кормящими. Мицеллярная форма витамина D в Аквадетриме хорошо всасывается в кишечнике даже при наличии у детей нарушений всасывания жиров и жирового обмена. Назначение витамина D детям не должно ограничиваться только первыми 2–3 годами жизни, т.к. при планомерном применении витамина D и поддержании уровня концентраций витамина D в крови 30–50 нг/мл создаются физиологические условия для оптимального нейропсихического развития детей и профилактируются прогностически неблагоприятные риски развития тяжелых неврологических заболеваний в отдаленном периоде жизни.



