Масштабы распространенности сахарного диабета (СД), частота его кардиоваскулярных осложнений, в т.ч. с фатальным исходом, поражение всех органов и систем, нарушение всех видов обмена веществ позволяют считать диабет вызовом современному миру с угрозой жизни для человечества. По данным IDF (International Diabetes Federation), в 2013 г. в мире зафиксированы 381 млн 800 тыс. больных СД [1]. Основной причиной осложнений СД2 служит хроническая гипергликемия, практически не контролируемая более чем у половины пациентов. Арсенал сахароснижающих препаратов практически ежегодно обогащается все новыми антидиабетическими средствами преимущественно группы безопасных в отношении развития гипогликемии. После открытия инкретинов – глюкагоноподобного пептида-1 (ГПП-1) и глюконозозависимого инсулинотропного пептида (ГИП) – эндогенных стимуляторов секреции инсулина на прием пищи все больше препаратов, регулирующих гликемию путем модулирования секреции ГПП-1, появляются на фармацевтическом рынке. Ингибирование дипептидилпептидазы-4 (ДПП-4) увеличивает концентрацию ГПП-1, которая стимулирует глюкозозависимое высвобождение инсулина, подавляет продукцию глюкагона, замедляет эвакуацию пищи из желудка, снижает аппетит и может способствовать сохранению функции β-клеток у пациентов с СД2 [2]. Таким образом, новой стратегической мишенью лечения больных СД2 является дисфункция панкреатических островков, которую можно восстанавливать с помощью кишечных гормонов-инкретинов. При ингибировании фермента ДПП-4 замедляется деградация эндогенного ГПП-1, что приводит к пролонгированию действия инсулинотропного гормона [3]. Ныне доступные ингибиторы ДПП-4, известные также как глиптины (ситаглиптин, вилдаглиптин, саксаглиптин, линаглиптин и алоглиптин), представляют собой мелкие молекулы, применяемые перорально. Они имеют сходные клиническую эффективность и профиль безопасности для пациентов с СД2. Основные отличия между пятью глиптинами заключаются в силе, степени селективности, биодоступности при приеме внутрь, продолжительности периода полужизни, уровне связывания с белками плазмы, метаболизме, наличии активных или неактивных метаболитов, путях экскреции из организма, необходимости коррекции дозы при почечной и печеночной недостаточности, а также в наличии потенциальных лекарственных взаимодействий.
Алоглиптин – новый ингибитор ДПП-4, обладающий высоким сродством и высокой специфичностью в отношении этого фермента, благодаря чему осуществляет быстрое и устойчивое ингибирование ДПП-4 со значительным снижением постпрандиальной концентрации глюкозы плазмы у пациентов с СД2 [4, 5].
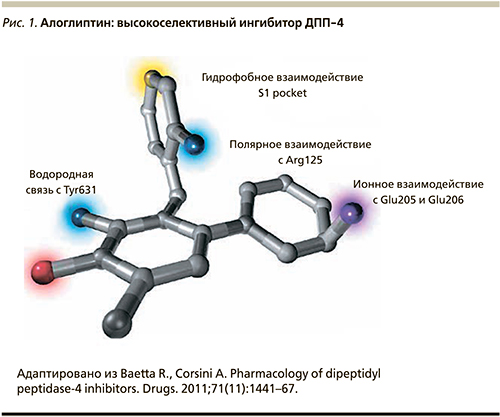
Алоглиптин имеет уникальное строение с четырьмя центрами связывания, в основе которого лежит 3D-структура ДПП-4, обеспечивающая высокую селективность и эффективность препарата (рис. 1).
Селективность алоглиптина к ДПП-4 превосходит данный показатель к ДПП-8 и -9 в 14 тыс. раз. Селективность представлена в виде IC50: nM±SEM (IC50 – концентрация полумаксимального ингибирования, SEM – стандартная ошибка среднего, nM – наномоль). Это позволяет считать алоглиптин самым селективным из ныне представленных ингибиторов ДПП-4 [3].
Эффективность и безопасность алоглиптина изучались в пяти плацебо-контролируемых исследованиях 3-й фазы с применением доз 12,5 и 25,0 мг 1 раз в сутки. Препарат оценивался в монотерапии, при добавлении к сульфонилмочевине (СМ), метформину, пиоглитазону±метформин или СМ, инсулину±метформин.
Алоглиптин в монотерапии
Эффективность монотерапии алоглиптином изучалась в ходе 26-недельного рандомизированного контролируемого исследования пациентов, не достигших целевого показателя гликированного гемоглобина (HbA1c) ≤7,0%.
Отобранные пациенты (мужчины и женщины в возрасте 18–80 лет с СД2) были без медикаментозного лечения (т.е. не получали сахароснижающую терапию в течение более 7 дней за последние 3 месяца). Основные критерии включения: уровень HbA1c – 7–10%, индекс массы тела – 23–45 кг/м2, терапия только в виде диеты и физических упражнений ≥1 месяца и уровни систолического/диастолического артериального давления ≤180/≤110 мм рт.ст. Пациенты получали рекомендации по диете и упражнениям. Больные, прошедшие 4-недельный подготовительный период, имевшие уровень глюкозы плазмы натощак (ГПН) <15,27 ммоль/л и комплаентность ≥75% (определена с помощью подсчета таблеток), были рандомизированы (2:2:1) в 26-недельное плацебо-контролируемое исследование: группы с приемом алоглиптина 12,5 и 25,0 мг в сутки однократно перед завтраком и группа плацебо. Использование других сахароснижающих препаратов было запрещено [6].
Оценка эффективности проведена в отношении всех рандомизированных пациентов, получавших двойную слепую терапию. Первичной конечной точкой стала степень снижения уровня HbA1c от исходного через 26 недель.
Из 420 включенных пациентов 329 были рандомизированы в группы двойной слепой терапии. Исходные характеристики среди групп лечения были одинаковыми. Исходный уровень HbA1c составил 7,9±0,08%, имелось преобладание мужского пола (53,2%) и белой расы (66,9%). В среднем через 26 недель уровень HbA1c значимо снизился при приеме алоглиптина 12,5 мг (-0,56%; р<0,001) и 25 мг (-0,59%; р<0,001) по сравнению с плацебо.
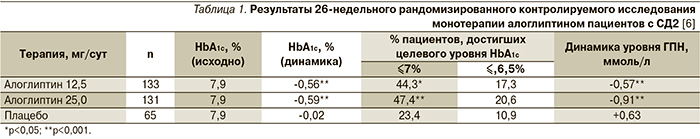
В табл. 1 представлены результаты данного исследования эффективности монотерапии алоглиптином. Значимое снижение HbA1c выявлено уже к 4-й неделе (р<0,001). К 26-й неделе снижение ГПН было более выражено при приеме алоглиптина по сравнению с плацебо (p<0,001) и отмечено уже через 1 неделю (p≤0,002).
Частота нежелательных явлений была сходной или даже чуть меньшей среди пациентов, получавших алоглиптин, по сравнению с плацебо. Нежелательные явления в виде поражения кожи регистрировались редко (12,5 против 6,3% в группе плацебо). Основным проявлением поражения кожи был кожный зуд. Гипогликемия была редкой (1,5–3,0%), и ее случаи не были расценены как нежелательные явления или тяжелые гипогликемии, требующие посторонней помощи. Не выявлено значимых изменений в лабораторных показателях, данных объективного осмотра и ЭКГ.
Алоглиптин в комбинированной терапии
Поскольку метформин считается признанным препаратом первого выбора в международных и национальных алгоритмах лечения СД2, а также тот факт, что СД2 является прогрессирующим заболеванием и со временем монотерапия метформином оказывается недостаточно эффективной, возникает необходимость комбинированной терапии. Наиболее привлекательной с точки зрения эффективности и безопасности служит комбинация метформина с ингибиторами ДПП-4. В связи с этим интерес представляет многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование эффективности и безопасности алоглиптина в лечении СД2 при добавлении его к терапии метформином.
В исследование были включены пациенты в возрасте 18–80 лет с СД2 и неудовлетворительным контролем гликемии (HbA1c – 7,0–10,0%) на фоне как минимум 3-месячной монотерапии метформином (за 8 недель до включения в исследование доза метформина должна была составлять ≥1500 мг/сут). Пациенты, которые на протяжении 3 месяцев до скрининга принимали другие сахароснижающие препараты, за исключением метформина, в исследование не включались [7].
По исходным демографическим и клиническим характеристикам группы между собой не различались (табл. 2).
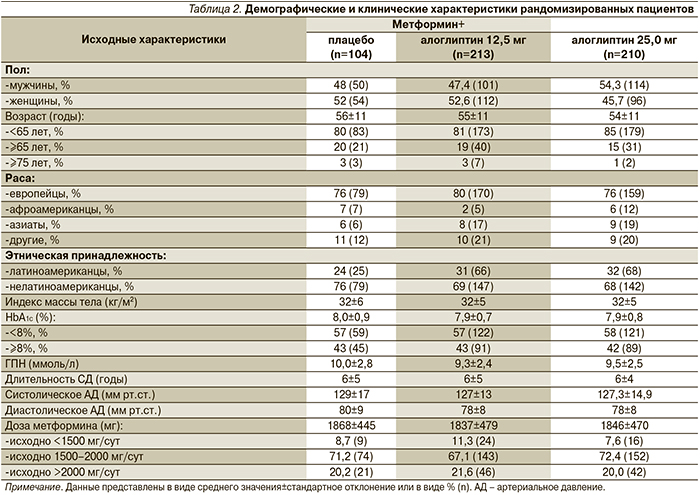
Во всех группах средний уровень исходного HbA1c составил 7,9–8,0%, а средний уровень ГПН – 9,3–10,0 ммоль/л. Средняя длительность СД2 составила 6 лет, средняя доза метформина – 1847 мг/сут. Средний возраст включенных в исследование пациентов достигал 55 лет, число мужчин и женщин было практически одинаковым. Большинство пациентов оказались европейцами.
Из 596 пациентов 527 больных, отвечающих критериям включения, были рандомизированы в группы и включены в анализ эффективности и безопасности. Полностью завершили исследование 413 пациентов.
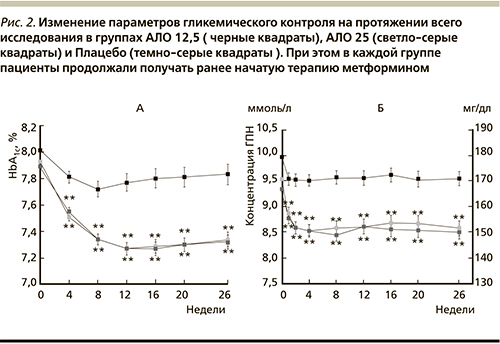
Данное исследование являлось многоцентровым рандомизированным двойным слепым для больных СД2, не достигших адекватного гликемического контроля на стабильной дозе метформина. Пациенты были рандомизированы в 3 группы: алоглиптин – 12,5 мг 1 раз в день+метформин – группа АЛО 12,5 (n=213); алоглиптин – 25,0 мг 1 раз в день+метформин – группа АЛО 25 (n=210); плацебо – 1 раз в день+метформин – группа плацебо (n=140). Первичной конечной точкой эффективности стало изменение уровня HbA1c от исходного уровня к 26-й неделе. Уровень HbA1c исходно составил 7,9% в группах АЛО и 8% – в группе плацебо. Снижение HbA1c к 26-й неделе составило ‑0,6%, ‑0,6% и -0,1% в группах АЛО 12,5, АЛО 25,0 и плацебо соответственно. Статистически значимое снижение HbA1c было достигнуто уже на 4-й неделе в обеих группах АЛО (p<0,001 при сравнении с плацебо) и сохранялось таковым до конца 26-недельного исследования (рис. 2). Вне зависимости от получаемой терапии исходно более высокий уровень HbA1c сопровождался его более выраженным снижением к 26-й неделе. Анализ подгрупп показал, что вне зависимости от возраста, пола, расы, этнической принадлежности, массы тела в обеих группах АЛО уровень HbA1c снизился гораздо сильнее, чем в группе плацебо. Из рис. 2 видно, что терапия в группах АЛО также приводила к большему, чем в группе плацебо снижению уровня гликемии натощак. Это снижение было зафиксировано уже на первой неделе лечения (р<0,001) и сохранялось на протяжении всего периода терапии [7].
Профиль безопасности комбинированной терапии алоглиптином и метформином не отличался от профиля безопасности терапии плацебо+метформин. В целом лечение алоглиптином переносилось хорошо. Большинство нежелательных явлений было легким и, как было расценено исследователями, не связано с приемом изучавшихся препаратов [7]. Во всех группах число пациентов, преждевременно выбывших из исследования по причине нежелательных явлений, оказалось очень низким (1,9–3,3%). В целом во всех трех группах частота эпизодов гипогликемии была низкой. Эпизодов тяжелой гипогликемии зафиксировано не было.
Добавление алоглиптина к пиоглитазону, глибенкламиду или инсулину также сопровождается значимым снижением уровня HbA1c по сравнению с плацебо (рис. 3).
Эффективность и безопасность терапии алоглиптином изучались на пациентах с СД2 с неудовлетворительным контролем гликемии на терапии пиоглитазоном из группы тиазолидиндионов (ТЗД). Результаты данного исследования были доложены в июне 2008 г. в Сан-Франциско на 68-й ежегодной сессии Американской диабетологической ассоциации и в сентябре 2008 г. Исследование было многоцентровым двойным слепым плацебо-контролируемым. В него были включены 493 пациента в возрасте 18–80 лет с неудовлетворительным контролем гликемии после периода стабилизации (HbA1c – 7,0–10,0%), несмотря на прием ТЗД. Больные были рандомизированы в соотношении 2:2:1 в 3 группы: пиоглитазон+12,5 или 25,0 мг алоглиптина и группу плацебо. Было разрешено продолжить сопутствующую терапию метформином или препаратами СМ в дозах, принимаемых до включения в исследование.
Анализ результатов исследования показал более выраженное снижение уровня HbA1с (р<0,001) в группах алоглиптина: в группе 12,5 мг алоглиптина HbA1c снизился на 0,66%, в группе 25,0 мг алоглиптина – на 0,80%, а в группе плацебо – всего лишь на 0,19% [8]. Терапия алоглиптином приводила к большему снижению уровня ГПН по сравнению с группой плацебо. Это снижение было зафиксировано уже на первой неделе лечения (р<0,05) и продолжалось на протяжении всего периода терапии. К 26-й неделе ГПН была статистически значимо ниже (р=0,003) при сравнении с исходными значениями: снижение в группе 12,5 мг алоглиптина составило 1,09 ммоль/л, в группе 25,0 мг алоглиптина – 1,10, а в группе плацебо – 0,32 ммоль/л [8].
Терапия алоглиптином не оказывала значимого влияния на частоту гипогликемий, которые чаще развивались у пациентов, получавших в качестве сопутствующей терапии СМ. Алоглиптин не оказывал значимого влияния на массу тела. Исследование не обнаружило доказательств неблагоприятного взаимодействия алоглиптина с пиоглитазоном. Не было также выявлено увеличения частоты побочных эффектов со стороны кожных покровов. В целом результаты исследования показывают, что комбинация алоглиптина с пиоглитазоном может по праву считаться адекватным выбором для пациентов с СД2 с неудовлетворительным гликемическим контролем на терапии метформином или СМ [8].
Несмотря на то что метформин признан препаратом первого выбора в инициации терапии СД2, препараты СМ во всех странах занимают лидирующие позиции с учетом их выраженного секретогенного эффекта.
В связи с тем что ингибиторы ДПП-4 и препараты СМ имеют разные механизмы действия, их комбинирование дополняет эффекты каждого их них при лечении СД2 [2, 9].
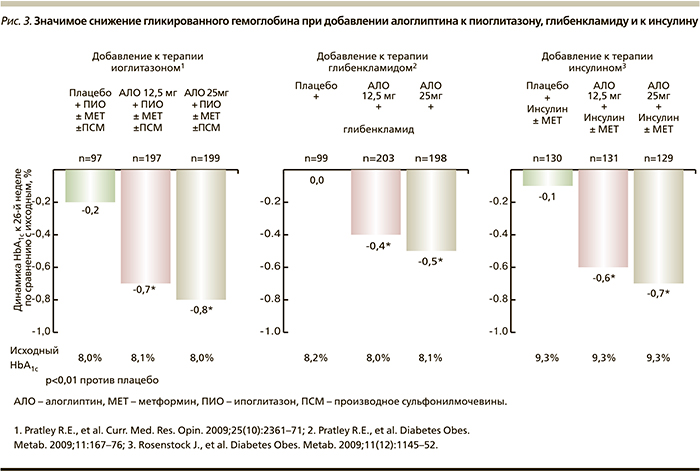
Включенным в исследование пациентам отменялась их собственная терапия препаратами СМ и заменялась на открытую эквивалентной дозой глибурида в дозе ≥10 мг/сут (или ≥5мг/сут при документально зарегистрированной на момент скрининга непереносимости дозы 10 мг/сут). Пациенты получали рекомендации по диетотерапии и физической активности в соответствии с местной практикой. Анализ эффективности и безопасности включал всех рандомизированных 500 пациентов (плацебо, n=99; алоглиптин 12,5 мг, n=203; алоглиптин 25,0 мг, n=198).
Через 26 недель снижение HbA1c было отмечено при приеме обеих доз алоглиптина по сравнению с небольшим повышением при приеме плацебо, приводя к статистически значимому различию между каждой дозой алоглипина и плацебо (12,5 мг -0,39%, 25,0 мг -0,53%, плацебо +0,01%; р<0,001 для каждой группы сравнения). Улучшение показателей HbA1c при приеме алоглиптина по сравнению с плацебо было выявлено независимо от его исходного уровня или дозы глибурида [10].
В данном исследовании добавление алоглиптина к проводимой терапии глибуридом сопровождалось клинически значимым снижением уровня HbA1c у пациентов с СД2 и неадекватным гликемическим контролем на монотерапии препаратом СМ. Снижение HbA1c наступало быстро после начала лечения и поддерживалось в течение 26-недельного периода. Большее, чем в группе плацебо, число пациентов, получавших терапию алоглиптином, достигли уровня HbA1c ≤7,0% независимо от дозы алоглиптина. Эти эффекты алоглиптина были достигнуты без увеличения частоты гипогликемии по сравнению с плацебо [10].
В связи с прогрессирующим снижением β-клеточной функции поджелудочной железы у больных CД2 возникает необходимость инсулинотерапии. Практически через 10 лет после установленного диагноза СД2 потребность в инсулине возникает у 60–70% пациентов. В связи с этим крайне актуальна оценка эффективности и безопасности добавления алоглиптина к терапии инсулином пациентов с СД2 с неудовлетворительным контролем гликемии на моноинсулинотерапии или инсулинотерапии в комбинации с метформином. Данное исследование также является 26-недельным рандомизированным двойным слепым плацебо-контролируемым. В него были включены 390 пациентов, рандомизированных в 3 группы: первая группа получала 12,5 мг алоглиптина (n=131), вторая – 25,0 мг алоглиптина (n=129), третья – плацебо (n=130). Все больные продолжили получать ранее начатую терапию инсулином или комбинированную терапию инсулин+метформин. В качестве первичной конечной точки было выбрано изменение уровня HbA1с к 26-й неделе лечения [11]. К этому сроку более выраженное снижение HbA1c от исходного было выявлено в группах алоглиптина. Так, в группе 12,5 мг алоглиптина HbA1c снизился на 0,63%, в группе 25,0 мг алоглиптина – на 0,71%, а в группе плацебо – всего лишь на 0,13% (p<0,001 при сравнении двух доз алоглиптина с плацебо). Значимое снижение уровня HbA1c в двух группах алоглиптина было достигнуто к 4-й неделе лечения (p<0,001 при сравнении с плацебо) и сохранялось таковым до конца исследования.
Снижения HbA1c более чем на 0,5; 1,0 и 1,5% в группах алоглиптина удалось достичь у гораздо большего числа пациентов, чем в группе плацебо [11].
Таким образом, во всех исследованиях 3-й фазы с 26-недельной терапией алоглиптином отмечено значимое снижение уровня HbA1c (от -0,5 до -0,8%), причем происходило оно быстро с последующим сохранением достигнутого результата. На фоне терапии алоглиптином целевого значения HbA1c (≤7%) достигало большее число пациентов, чем на монотерапии метформином, пиоглитазоном, СМ или инсулином. Следует отметить такой важный факт, как более быстрое и выраженное снижение ГПН под влиянием алоглиптина, чем при монотерапии метформином, пиоглитазоном, СМ или инсулином. На терапии алоглиптином достигнутое снижение гликемии сохранялось на протяжении 2 лет наблюдения в отличие от терапии препаратами СМ.
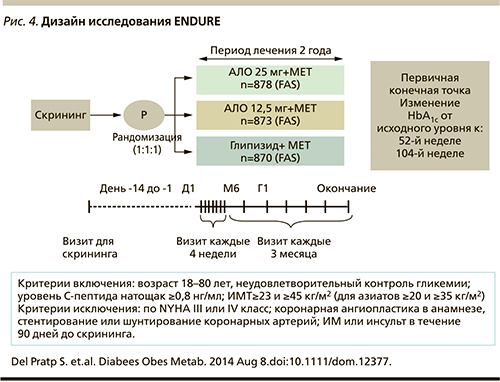
Исследование ENDURE
Большой интерес представляет исследование ENDURE, в котором изучалась продолжительность сохранения эффективности и безопасности при 2-летней терапии алоглиптином по сравнению с терапией глипизидом в комбинации с метформином.
Это многоцентровое рандомизированное двойное слепое исследование, в котором проводилось сравнение продолжительности сохранения эффективности и безопасности терапии алоглиптин+метформин и терапии глипизид+метформин пациентов с СД2, не достигших адекватного гликемического контроля на стабильной дозе метформина (рис. 4). Длительность исследования составила 104 недели, пациенты были рандомизированы в 3 группы сравнения: алоглиптин 12,5 мг 1 раз в день+метформин (n=880) – группа АЛО 12,5; алоглиптин 25,0 мг 1 раз в день+метформин (n=885) – группа АЛО 25; глипизид 5 мг, титруемый максимально до дозы 20,0 мг+метформин (n=874) – группа ГЛИПИЗИД. В качестве первичной конечной точки было выбрано среднее изменение уровня HbA1c от исходного значения, оцененное методом наименьших квадратов к 104-й неделе наблюдения.
К 104-й неделе лечения уровень HbA1c снизился в группах АЛО 12,5, АЛО 25,0 и ГЛИПИЗИД на -0,68, -0,72 и -0,59% (эффективность обеих дозировок алоглиптина не уступала глипизиду, при этом по эффективности алоглиптин 25,0 мг даже превосходил глипизид). Уровень ГПН снизился на 0,05 ммоль/л в группе АЛО 12,5; на 0,18 ммоль/л в группе АЛО 25,0, тогда как в группе ГЛИПИЗИД ГПН увеличилась на 0,3 ммоль/л (p<0,001 при сравнении обеих групп АЛО с группой ГЛИПИЗИД). В среднем масса тела в группе АЛО 12,5 – на 0,68 кг, в группе АЛО 25,0 – на 0,89. В группе ГЛИПИЗИД масса тела увеличилась на 0,95 кг (p<0,001 при сравнении обеих групп АЛО с глипизидом). Гипогликемия развивалась в группе ГЛИПИЗИД в 23,2% случаев, в группе АЛО 12,5 – в 2,5, а в группе АЛО 25,0 – в 1,4%. Тяжелые гипогликемии развились у шести пациентов в группе ГЛИПИЗИД, у одного – в группе АЛО 12,5. Панкреатит был диагностирован у одного пациента группы АЛО 25,0 и у 3 – группы ГЛИПИЗИД.
Большее число пациентов достигло уровня HbA1c ≤7% к 104-й неделе в группе АЛО 25,0 (48,5%) по сравнению с группой ГЛИПИЗИД (42,8%; р=0,004); в группе АЛО 12,5 таких пациентов было 45,6% (значимых отличий по сравнению с группой ГЛИПИЗИД не было).
Число пациентов, у которых развилось ≥1 нежелательного явления или события, приведшего к прекращению терапии, было в трех группах сходным. Восемь больных умерли: 3 – в группе АЛО 12,5, 3 – в группе АЛО 25,0 и 5 – в группе ГЛИПИЗИД. Таким образом, эффективность терапии алоглиптином сохранялась на протяжении 104 недель. Профиль безопасности был сходным между группами, однако на фоне терапии алоглиптином частота гипогликемий была достоверно ниже [11].
Заключение
Таким образом, при СД2 алоглиптин представляется эффективной терапевтической опцией как в качестве монотерапии, так и в комбинации с сахароснижающими препаратами других классов. Помимо высокой эффективности алоглиптин в клинических исследованиях также продемонстрировал высокую безопасность, в т.ч. кардиоваскулярную. В исследовании EXAMINE 5380 пациентов с СД2 и перенесенным за 15–90 дней до включения острым коронарным синдромом были рандомизированы в группы терапии алоглиптином или плацебо в дополнение к имеющейся сахароснижающей терапии и средствам вторичной профилактики кардиоваскулярных событий. Медиана периода наблюдения составила 18 месяцев. Экспертиза всех смертельных исходов проведена независимым комитетом из Cleveland Clinic Foundation. Анализ результатов исследования показал, что у пациентов с СД2 с недавно перенесенным острым коронарным синдромом риск смерти от сердечно-сосудистых причин на фоне терапии алоглиптином был не выше по сравнению с плацебо.


