Разделение рака молочной железы (РМЖ) на дольковый и протоковый обусловлено различиями в морфологии опухоли и клинических проявлениях болезни. Дольковый инвазивный рак (ДИР) составляет от 5 до 15 опухолей молочной железы и является вторым по частоте после т.н. протокового инвазивного рака (ПИР), или инвазивного рака неспецифического типа, согласно классификации ВОЗ 2012 г.
Основные принципы лечения РМЖ базируются на данных крупных рандомизированных клинических исследований, в которых ДИР составлял небольшой процент. В связи с относительной редкостью ДИР специальные клинические исследования для больных этой группы не проводились. Результаты анализа, выполненного, как правило, без учета морфологии, и соответствующие рекомендации по лечению автоматически распространяются на больных, имеющих ДИР, без учета его особенностей.
Морфологически классический дольковый рак характеризуется пролиферацией мелких клеток, расположенных отдельно в фиброзной строме или собранных в длинные цепочки. Часто они располагаются циркулярно вокруг нормальных протоков, формируя структуры, похожие на мишень [1]. Характерный линейный рост в виде тонких опухолевых тяжей вдоль млечных протоков с инвазией прилежащих структур создает трудности для интерпретации размеров первичной опухоли при маммографии и хирургической резекции [2]. Магнитно-резонансная томография молочных желез при ДИР также не является оптимальным методом диагностики, т.к. имеются сообщения о достаточно высоком уровне ложно-позитивных результатов [3].
По сравнению с протоковым раком ДИР встречается у больных более старшего возраста: у женщин 70–75 лет – в 11,0%, 50–70 лет – в 5,0%, 20–40 лет – в 0,5% случаев. На момент постановки диагноза первичная опухоль в среднем крупнее, с большим числом пораженных регионарных лимфоузлов, возможно благодаря особенностям характера роста [4, 6–8].
К особенностям ДИР также относят часто встречающийся мультифокальный и мультицентрический рост, частота первичной множественности колеблется от 30 до 85%, составляя в среднем 35%. В сочетании с особенностями морфологии и трудностями рентгенологической диагностики это приводит к высокой частоте выявления злокачественных клеток в краях резекции и, соответственно, к большему объему хирургического вмешательства [5].
Билатеральное поражение наблюдается в 10–47% случаев [4]. При ДИР вероятность возникновения контралатерального рака в 2 раза выше, чем при ПИР (20,9 против 11,2%; р<0,0001) [6].
К особенностям ДИР необходимо отнести и его частое сочетание с дольковыми раком in situ. По данным ретроспективного анализа 148 случаев ДИР, у 46% больных одномоментно был выявлен преинвазивный дольковый рак in situ [9].
Обычно ДИР позитивен по рецепторам эстрогенов и/или прогестерона (РЭ+ более чем в 90%), имеет низкие уровни индекса пролиферации (Ki-67), митотической активности и степени злокачественности (G). Реже отмечается гиперэкспрессия HER2: 5–14% по сравнению с 25–33% при ПИР [7–8, 10]. По данным ряда исследований, ДИР чаще относится к люминальным А и В подтипам, редко встречаются HER2-позитивные и базалоподобные варианты [11].
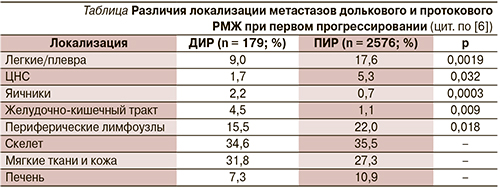
Имеется ряд клинических особенностей метастазирования. Метастазы в коже, мягких тканях и костях – наиболее частые локализации, здесь различий при ДИР и ПИР не отмечено. Метастазы в легких и ЦНС при ДИР встречаются реже. При ДИР значительно чаще отмечается редкое для РМЖ поражение желудочно-кишечного тракта и яичников. Интраабдоминальные метастазы имеют склонность к вовлечению серозных поверхностей и забрюшинного пространства [6, 12]. Особенности метастазирования при ДИР приведены в таблице.
Таким образом, с одной стороны, ДИР чаще характеризуется рядом благоприятных прогностических признаков (позитивные РЭ/РП, негативный HER2-статус, низкий уровень Ki-67 и низкая степень злокачественности), с другой – характер роста первичной опухоли при ДИР и сложность рентгенологической диагностики определяют относительно более позднее выявление заболевания с большими значениями T и N. В ряде случаев проблемой является и достаточно необычная для РМЖ локализация метастазов в яичниках, брюшине и желудочно-кишечном тракте. В совокупности это может негативно влиять на отдаленные результаты лечения.
В качестве иллюстрации вышесказанного, приводим собственное, на наш взгляд, характерное наблюдение.
Больная 57 лет в менопаузе оперирована в гинекологической клинике в объеме надвлагалищной ампутации матки с придатками в связи с выявленной по данным ультразвукового исследования кистой правого яичника и миомой матки. На момент операции отмечала жалобы на боли в эпигастральной области и тошноту. При гистологическом исследовании были обнаружены метастазы долькового рака в яичниках и маточной трубе.
В нашей клинике (через 2 месяца после операции) по данным маммографии в верхне-наружном квадранте левой молочной железы была выявлена опухоль размером 5,9×4,0 см; в правой молочной железе в верхне-наружном квадранте – участок микрокальцинатов, а также множественные метастатические лимфатические узлы в левой аксиллярной, в левой подключичной и в левой надключичной областях. При гастроскопии обнаружена стелющаяся опухолевая инфильтрация, распространяющаяся на субкардию и свод желудка, с очагами гиперплазии до 0,3 см; дистальная граница изменений определяется на границе нижней трети тела и антрального отдела.
Выполнены биопсия опухоли левой молочной железы и зоны микрокальцинатов в правой молочной железе, множественные биопсии инфильтрированной слизистой оболочки желудка.
При гистологическом исследовании:
- в опухоли левой молочной железы ДИР с единичными фокусами рака in situ 2-й степени злокачественности, РЭ – 8 баллов (PS-5 [100%], IS-3), РП – 6 баллов (PS-3 [30%], IS-3), HER2/neu – 0, Ki-67 – 20%;
- в биоптате зоны микрокальцинатов правой молочной железы ДИР 2-й степени злокачественности, РЭ – 7 баллов, РП – 6 баллов, HER2/neu – 0, Ki-67 – 5%;
- в биоптате опухоли желудка разрастания ДИР молочной железы, подтвержденного данными иммуногистохимического исследования; опухоль положительна по РЭ и РП;
- в опухоли яичников метастаз ДИР молочной железы, фрагменты маточных труб с разрастанием ДИР, подтвержденным данными иммуногистохимического исследования.
На основании полученных данных установлен диагноз: синхронный РМЖ с метастазами в яичниках, маточной трубе, желудке; люминальный В, HER2-негативный, BRCA-немутированный субтип.
Начато лечение анастрозолом. Через 6 месяцев лечения отмечен выраженный эффект в виде уменьшения первичной опухоли и степени инфильтрации стенки желудка по данным эзофагогастродуоденоскопии. Полностью прекратились тошнота и боль в эпигастрии. При позитронно-эмиссионной томографии данных о наличии активной опухолевой ткани не получено.
Представленный клинический случай проиллюстрировал практически все особенности ДИР: позднее выявление массивной первичной опухоли с обширным поражением регионарных лимфоузлов, контрлатеральный РМЖ, поражение яичников и стенок желудка с клинической картиной гастрита. Отсутствие онкологической настороженности у 57-летней женщины обусловило позднее выявление заболевания, несмотря на наличие симптомов.
При метастатических формах рекомендуемый алгоритм выбора лекарственной терапии одинаков при обоих вариантах РМЖ. При люминальных субтипах преимущество логично отдается выбору эндокринотерапии в отсутствие опухоль-ассоциированных симптомов. Высказывается мнение о более низкой эффективности химиотерапии при ДИР по сравнениию с ПИР, хотя статистических данных о различиях в эффективности лекарственного лечения метастатического ДИР и ПИР в доступной литературе нами не найдено.
В пользу предпочтения эндокринотерапии при выборе тактики лечения ранних форм свидетельствует более низкая эффективность неоадъювантной химиотерапии при ДИР по сравнению с ПИР [13].
В свою очередь высокая эффективность предоперационной эндокринотерапии ингибитором ароматазы (летрозол) была продемонстрирована в исследовании, включившем 61 больную с местнораспространенным дольковым РМЖ, не подлежавшим сохранной операции. Показано, что через 3 месяца лечения значимое уменьшение объема опухоли установлено у 66% больных, что позволило в 81% случаев выполнить органосохранную операцию [14].
Эффективность адъювантной химиотерапии ДИР достаточно плохо изучена [15, 16]. Потенциально невысокая эффективность химиотерапии может быть обусловлена высоким уровнем РЭ и относительно низким митотическим индексом [17].
Высокая частота выявления позитивных гормональных рецепторов в опухоли дает основание рассчитывать, что максимальное преимущество больные получат от адъювантной эндокринотерапии.
Представлены результаты сравнительного изучения эффективности адъювантной эндокринотерапии 6558 больных РМЖ, имевших позитивные РЭ или РП [18]. Все больные получали тамоксифен или ингибиторы ароматазы. ДИР (851 больная) был диагностирован у более пожилых, первичная опухоль была большего размера, с более низкой степенью злокачественности по сравнению с ПИР (5707 больных). При ДИР реже выявлялись HER2-позитивные случаи (3,2 против 13,4%). Мультивариантный регрессионный анализ результатов лечения показал, что при ДИР были более низкие значения интервала без проявлений болезни – отношение рисков (HR) – 1,34, времени до выявления метастазов (HR – 1,48) и общей выживаемости (HR – 1,34). Наибольшие различия между ДИР и ПИР были во времени без развития отдаленных метастазов при G1 (HR – 2,83).
У J.N. Mhuircheartaigh и соавт. [19], сравнивших больных ДИР и ПИР, имевших сравнимые стадии и возраст, анализ общей выживаемости продемонстрировал одинаковые результаты, несмотря на превалирование при ДИР маркеров благоприятного прогноза. Общая выживаемость в подгруппах РЭ+ при ДИР (n=106) была достоверно ниже (p=0,011), чем при ПИР (n=198). И это несмотря на то что у больных ДИР с наличием РЭ+ была ниже частота рецидива болезни [20, 21]. Авторы отметили, что в течение 10 лет от начала лечения прогноз при РЭ+ при обоих видах РМЖ одинаков, однако в более поздние сроки он хуже при ДИР. Анализ отдаленных результатов в группах с адъювантной эндокринотерапией и в ее отсутствие показал, что максимальная реализация преимуществ такого лечения имела место именно при ДИР.
Адъювантная гормонотерапия в этих исследованиях проводилась в течение 5 лет. Возникает логичное предположение, будто увеличение длительности гормонотерапии, например до 10 лет, может улучшить результаты больных ДИР с позитивными РЭ.
Недавно были представлены обновленные результаты сравнительного исследования эффективности адъювантной терапии – 5-летнего приема летрозола против тамоксифена (BIG 1-98). Ранее опубликованные (2005) данные продемонстрировали небольшое, но достоверное преимущество летрозола. С целью выявления больных, имевших наибольшее преимущество от ингибитора ароматазы, его эффективность была ретроспективно изучена в подгруппах. Выделены HER2-негативные больные, из которых 2599 страдали ПИР, 324 – ДИР [22, 23]. Было установлено, что в зависимости от гистологической картины и субтипа опухоли эффективность лекарств различна. Так, при ДИР 8-летняя выживаемость без прогрессирования получавших летрозол (n=152) составила 82 против 66% в группе тамоксифена (n=172), разница была достоверна: р=0,03; HR – 0,48 (0,31–0,74). При ПИР летрозол также имел преимущество, но разница была менее выраженной: 82 и 75%; HR – 0,80 (0,68–0,94). При анализе 8-летней общей выживаемости при ДИР абсолютное преимущество летрозола составило 15% (89 против 74%), р=0,045; HR – 0,40 (0,23–0,69). При ПИР 8-летняя общая выживаемость достоверно не различалась: 88 и 84% соответственно. Анализ мультивариантного моделирования пропорциональных рисков Кокса установил, что наибольшие преимущества летрозола в выживаемости без прогрессирования были при ДИР люминального В субтипа: HR – 0,33 (0,21–0,55), несколько в меньшей степени при люминальном А: HR – 0,49 (0,32–0,78). При ПИР преимущество летрозола над тамоксифеном было только при люминальном В: HR – 0,64 (0,53–0,79). При сравнении влияния на общую выживаемость преимущество летрозола над тамоксифеном было у больных ДИР: HR – 0,39 (0,22–0,68), в меньшей степени при ПИР: HR – 0,64 (0,57–0,85).
Эти данные позволяют предположить, что оптимальным вариантом адъювантной эндокринотерапии менопаузальных больных люминальным HER2-негативным ДИР служит применение ингибиторов ароматазы, в частности летрозола. Максимальное его преимущество отмечено у больных с более неблагоприятным люминальным В-субтипом. К 8 годам наблюдения прогрессирование болезни у больных ДИР в группе тамоксифена было более значимым, составив 34 против 18% в группе летрозола. Это позволяет отнести данный гистологический субтип опухоли к фактору неблагоприятного прогноза РМЖ. Соответственно, напрашивается вывод: эти больные являются таргетной популяцией для будущих исследований по увеличению длительности адъювантной эндокринотерапии до 10 лет и более.


