Введение
Мутация PIK3CA обнаруживается у 40–45% пациенток с люминальным HER2-негативным раком молочной железы (HR+ HER2-мРМЖ), ассоциируется с ухудшением ответа на все виды лекарственной терапии и с сокращением продолжительности жизни по сравнению с пациентками без мутации [1, 2]. Агрессивное течение заболевания связано с гиперактивацией фосфатидилинозитол-3-киназы (PI3K), которая кодируется геном PIK3CA, регулирует рост и деление клетки. Блокада PI3K с помощью препарата алпелисиб позволяет пациентам с мутацией PIK3CA получать дополнительную линию таргетной терапии и дольше контролировать заболевание [3, 4]. Алпелисиб в комбинации с фулвестрантом был зарегистрирован на основании исследования III фазы SOLAR-1, показавшиего практически двукратное увеличение медианы выживаемость без прогрессирования (ВБП) 11,0 месяцев против 5,7 (отношение риcков [ОР]=0,65, 95% доверительный интервал [ДИ]: 0,50–0,85; p<0,001) при добавлении алпелисиба к фулвестранту и приемлемый профиль переносимости [3]. На сегодняшний день в мире накоплен большой опыт применения алпелисиба для лечения РМЖ, однако некоторые вопросы остаются открытыми: в какой линии терапии алпелисиб может приносить наибольшую пользу? Какова эффективность алпелисиба у эндокринорезистентных пациентов с коротким ответом на ингибитор CDK4/6? Какова эффективность комбинации алпелисиба с фулвестрантом у пациентов, уже получавших фулвестрант ранее? Можно ли повысить эффективность лечения за счет профилактики побочных эффектов?
Самый острый вопрос – это вопрос оптимальной линии применения алпелисиба. В исследовании SOLAR-1, начавшемся в 2015 г., пациенты получали алпелисиб в 1-й или 2-й линии лечения мРМЖ. В настоящее время в 1-й линии прочно укрепились ингибиторы CDK4/6, продемонстрировавшие значимое увеличение общей выживаемости наряду с ВБП (рибоциклиб в комбинации с ингибиторами ароматазы и с фулвестрантом и абемациклиб в комбинации с фулвестрантом) [5–9]. Данные об эффективности алпелисиба после прогрессирования на фоне ингибитора CDK4/6 были получены в несравнительном исследовании II фазы BYLieve: мВБП 8 месяцев (95% ДИ: 5,6–8,6) [10]. Наша работа дополняет эти результаты анализом эффективности и переносимости алпелисиба у разных подгрупп пациентов в условиях рутинной клинической практики.
Методы
С апреля 2021 г. в СПбГБУЗ «ГКОД» 49 пациенток с HR+ HER2-мРМЖ получили алпелисиб 300 мг/сут перорально в комбинации с фулвестрантом 500 мг внутримышечно в 1-й, 15-й и 28-й день, далее каждые 28 дней. Терапия проводилась до прогрессирования заболевания или непереносимой токсичности. Эффективность терапии оценена у 38 пациенток на момент среза данных (15 августа 2023 г.).
Исходные характеристики пациенток представлены в таблице.
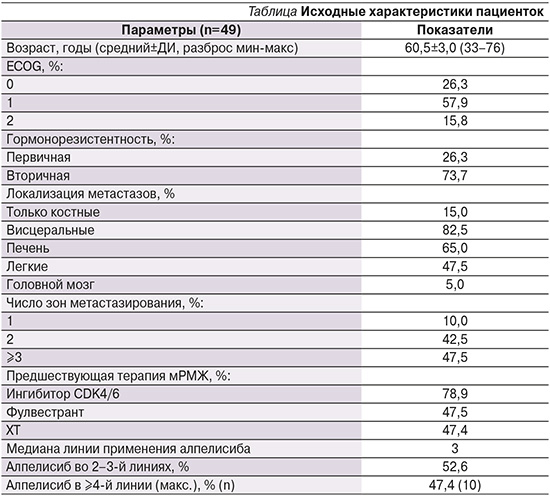
Важной отличительной особенностью нашей выборки являются большая опухолевая распространенность (висцеральные метастазы у 82,5% пациенток), наличие множественных органных поражений (≥3 зон метастазирования у 47,5%), выраженная предлеченность (применение алпелисиба в ≥4-й линии у 47,4%). Кроме того, большинство пациенток в анамнезе получали ингибиторы CDK4/6 (78,9%), а почти у половины больных уже использовались химиотерапия – ХТ (47,4%) и фулвестрант (47,5%) для лечения мРМЖ.
Для оценки количественных данных использовались методы описательной статистики в виде среднего значения±стандартное отклонение и медианы (интерквартильный размах). Качественные данные (номинальные и порядковые) представлены в виде частотного распределения. ВБП оценивали с помощью кривых Каплана–Майера, для сравнения выживаемости в группах применялся логранговый критерий. Статистически значимыми считали различия при р<0,05 (95%-й уровень значимости). Статистический анализ данных проводился на платформе Jamovi.
Результаты
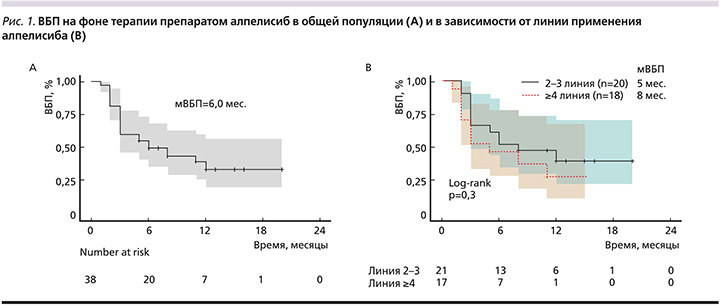
К 15 августа 2023 г. 12 пациенток продолжали терапию алпелисибом, у 26 зарегистрировано прогрессирование, 3 пациентки завершили терапию по причине развития непереносимой токсичности в течение первых 2 месяцев приема терапии. Медиана времени до прогрессирования на фоне терапии алпелисибом в комбинации с фулвестрантом составила 6 месяцев (95% ДИ: 3–22, рис. 1А); 6-месячная ВБП – 50%; 12-месячная ВБП – 34%.
Наилучший ответ на фоне лечения: частичный регресс –31,6% (n=12), стабилизация – 26,3% (n=10); прогрессирование – 36,8% (n=14), не оценены 5,3% (n=2).
Медиана ВБП при применении алпелисиба во 2–3-й линиях составила 8 месяцев (95% ДИ: 3–22), при применении в 4 и последующих линиях – 5 месяцев (95% ДИ: 3–15, рис. 1В).
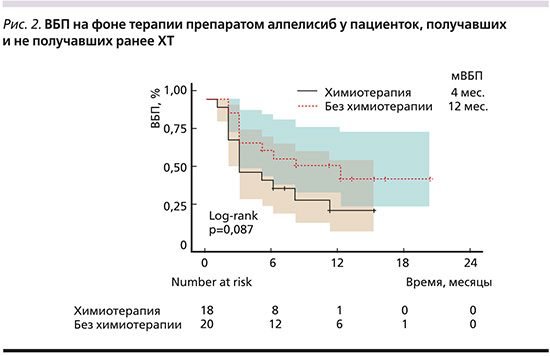
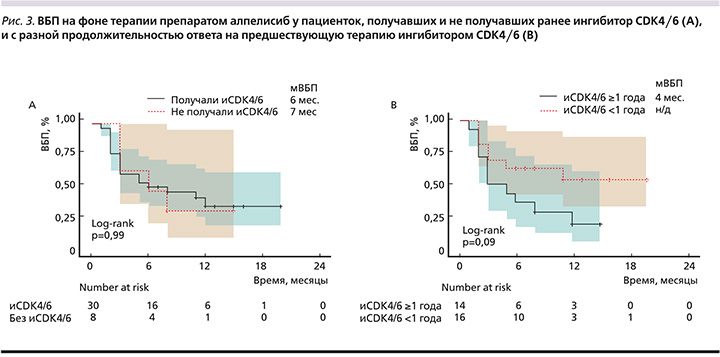
У пациенток, получавших ранее ХТ для лечения мРМЖ (n=18, медиана линии применения алпелисиба=5), мВБП составила 4 месяца (95% ДИ: 3–16), у пациенток, не получавших ХТ (n=20, медиана линии применения алпелисиба=3), мВБП составила 12 месяцев (95% ДИ: 5–22, рис. 2). У пациенток, получавших ранее ингибитор CDK4/6 (n=30, медиана линии применения алпелисиба=4), мВБП составила 6 месяцев (95% ДИ: 3–22), у пациенток без ингибитора CDK4/6 (n=8, медиана линии применения алпелисиба=3) в анамнезе мВБП составила 7 месяцев (95% ДИ: 3–22). У пациенток с длительным ответом на ингибитор CDK4/6 (≥1 год, n=14, медиана линии применения алпелисиба=3) мВБП составила 4 месяца (95% ДИ: 3–15), а у пациенток с более коротким ответом на ингибитор CDK4/6 (<1 года, медиана линии применения алпелисиба=3) медиана ВБП еще не была достигнута (95% ДИ: 3 месяца – не достигнуто) на момент анализа данных (p=0,09) (рис. 3).
В анализ переносимости терапии включены 38 пациенток. Всего редукция дозы алпелисиба потребовалась 17 (44,7%) пациенткам, отмена – 3 (7,9%) .
Гипергликемия отмечалась у 27 (71%) пациенток: 1-й степени – у 12 пациенток; 2-й – у 12; 3 – у 3 пациенток. Низкий риск гипергликемии был у 13 пациенток, средний – у 13, высокий – у 12 пациенток. Профилактическое применение метформина использовалось у 24 пациенток со средним и высоким рисками. Редукция дозы алпелисиба до 250 мг/сут в связи с гипергликемией потребовалась 4 пациенткам, у 1 пациентки произведена полная отмена лечения.
Кожная токсичность в виде сыпи отмечалась у 19 (50%) пациенток, при том что профилактический прием антигистаминных препаратов был назначен 30 больным (при наличии профилактики сыпь отмечалась у 15 из 30 пациенток, при ее отсутствии у 4 из 8 пациентов): 2-й степени – у 6 пациенток, 3-й степени – у 12, 4-й степени – у 1 пациентки. Важно отметить, что у всех пациенток без профилактического приема антигистаминных препаратов сыпь была 3-й степени. Редукция дозы алпелисиба в связи с кожной токсичностью произведена у 9 пациенток, у 2 больных была полная отмена лечения.
Из других побочных эффектов отмечены диарея (n=7), повышение уровня креатинина (n=7), потеря массы тела (n=16), астенический синдром (n=4), кетонурия (n=1), стоматит (n=1), тошнота (n=2). Редукция дозы алпелисиба применялась в связи с развитием данных осложнений у 4 пациенток, полной отмены препарата не потребовалось.
Обсуждение
Представленный опыт позволяет оценивать эффективность и переносимость алпелисиба в условиях рутинной клинической практики и дополняет данные, полученные в рамках клинических исследований SOLAR-1 и BYLieve, где препарат применялся в ранних (1–3) линиях терапии мРМЖ. В описанной популяции более 50% пациенток получили алпелисиб только в 3-й и последующих линиях, что ожидаемо сократило продолжительность ответа. В исследовании II фазы BYLieve в когорте А (пациентки, получавшие алпелисиб с фулвестрантом после прогрессирования на фоне терапии ингибитором CDK4/6, 70% пациенток получали алпелисиб во 2-й линии, 12% – в 1-й и 17% – в 3-й линии) мВБП составила 8 месяцев [10]. Зависимость ВБП от линии терапии алпелисибом была описана ранее в рамках американского исследования реальной клинической практики: мВБП составила 5,7 месяца в популяции, где 66% пациенток получили не менее трех линий терапии [11]. Отдельно по линиям: 11,9 месяца – в 1-й линии, 6,2 месяца – во 2-й, 4,0 месяца – в 3-й, 4,8 месяца – в 4-й и последующих линиях [11]. Группа пациенток «ГКОД» по уровню опухолевой нагрузки и степени предлеченности была близка к описанной группе из США: в 4-й и последующих линиях мВБП составила 8,0 месяцев.
Важно отметить, что алпелисиб демонстрировал эффективность даже у пациенток с коротким ответом на предшествовавшую терапию ингибитором CDK4/6. В настоящее время ингибиторы CDK4/6 являются «золотым» стандартом терапии 1-й линии мРМЖ благодаря достоверному увеличению общей выживаемости и благоприятному профилю переносимости, а быстрое прогрессирование на этих препаратах чаще всего интерпретируют как резистентность к эндокринотерапии, переводя пациентов на ХТ.
Однако наличие мутации PIK3CA позволяет предположить, что драйвером опухолевого роста является активированная в результате мутации фосфатидилинозитол-3-киназа и использование таргетной терапии может обеспечивать контроль заболевания. Впервые это было показано в исследовании BYLieve, где мВБП у пациенток с ответом на ингибитор CDK4/6 более и менее 1 года составила 8 и 7 месяцев соответственно (ОР=1,03, 95%ДИ: 0,64–1,64; p=0,927) [12]. После этого был проведен анализ тех же данных с отсечкой 6 месяцев, что соответствует критериям первичной эндокринорезистентности. Оказалось, что мВБП у пациенток с ответом на ингибитор CDK4/6 более 6 месяцев составила 6,2 месяца, а у пациенток с ответом на ингибитор CDK4/6 менее 6 месяцев – 12 месяцев (ОР=0,51, 95% ДИ: 0,29–0,89) [13]. У наших пациенток с коротким ответом на ингибитор CDK4/6 (менее 1 года) медиана ВБП еще не была достигнута на момент среза данных, что свидетельствует о возможности достижения контроля заболевания при применении алпелисиба даже у такой тяжелой подгруппы пациенток.
Профиль токсичности соответствовал описанному ранее в рамках клинических исследований: основными побочными эффектами были гипергликемия, сыпь и диарея. В рамках нашего практического опыта обращает на себя внимание также такой побочный эффект, как снижение массы тела, который встретился почти у половины больных (n=16). Это может быть связано как с действием самого алпелисиба, так и с жестким соблюдением диеты. Частота снижения дозы была ниже, чем в исследовании SOLAR-1 (44,7 против 63,9%), что может объясняться эффективной профилактикой гипергликемии и сыпи на основании разработанных отечественными специалистами консенсусов [14–16].
Заключение
Полученные нами данные свидетельствуют об эффективности применения алпелисиба в различных подгруппах пациенток с мутацией PIK3CA, которая, с одной стороны, является фактором агрессивного течения заболевания, с другой – дает возможность назначить пациенткам дополнительную линию таргетной терапии, которая помогает преодолевать резистентность к эндокринотерапии.


