Меланома кожи (МК) – это опухоль нейроэктодермального происхождения, возникающая в результате злокачественной трансформации меланоцитов, расположенных преимущественно в коже. В 2012 г. в РФ было выявлено 8639 новых случаев МК, при этом каждый четвертый (24,5%) пациент на III и IV стадиях заболевания. Так, за 10 лет (с 2002 по 2012 г.) прирост заболеваемости составил 20,7%, что говорит о росте заболеваемости и еще раз подчеркивает актуальность исследований в данной области. Помимо кожной формы меланомы, на долю которой приходится более 90%, существуют также внекожные формы опухоли, к которым относят меланому слизистых, оболочек головного и спинного мозга, глазную меланому. Все эти формы меланомы обладают различными молекулярными портретами и отличаются между собой как по прогнозу, так и по вариантам персонализированной терапии. На сегодняшний день имеются данные о наличии активирующих мутаций при всех этих видах меланомы; так, для МК любой локализации характерно наличие мутаций в генах: BRAF (50%), NRAS (20%); при акральной локализации опухоли возможно также наличие мутации в гене c-KIT (15%); при меланоме слизистых оболочек – c-KIT (20%), NRAS (15%), BRAF (5%); при глазной форме меланомы наиболее часто встречаются мутации GNAQ и GNA11 (по данным разных авторов: ~45% в первичной опухоли, ~22% в метастазах, ~30% в первичной опухоли, ~57% в метастазах соответственно). Мутации GNAQ и GNA11 не встречаются при кожной форме меланомы [1]. Все эти активирующие мутации являются потенциальными мишенями для создания новых препаратов.
 Метастатическая меланома кожи (мМК) характеризуется неблагоприятным прогнозом заболевания. Так, медиана общей выживаемости (ОВ) пациентов с мМК варьируется от 6 до 9 месяцев, по данным разных авторов [2–5]. Если при I стадии заболевания 5-летняя выживаемость превышает 90%, то при II стадии составляет около 65%, при локально-региональной (III стадии) снижается до 45%, а при метастатической (IV стадия) не превышает 10%.
Метастатическая меланома кожи (мМК) характеризуется неблагоприятным прогнозом заболевания. Так, медиана общей выживаемости (ОВ) пациентов с мМК варьируется от 6 до 9 месяцев, по данным разных авторов [2–5]. Если при I стадии заболевания 5-летняя выживаемость превышает 90%, то при II стадии составляет около 65%, при локально-региональной (III стадии) снижается до 45%, а при метастатической (IV стадия) не превышает 10%.
До недавнего времени для лечения метастатических форм МК, неоперабельной III и IV стадий заболевания, использовалась химиотерапия. Спектр цитостатиков, применяемых как в однокомпонентных, так и в многокомпонентных химиотерапевтических режимах, в основном представлен алкилирующими агентами: производными имидазолкарбоксамида (дакарбазин, темодал), производными нитрозомочевины (ломустин, фотемустин), препаратами платины (цисплатин и карбоплатин), а также таксанами (паклитаксел) или их комбинациями [6, 7]. Эффективность однокомпонентных режимов (монохимиотерапия) не превышает 10–15%. Некоторое улучшение выживаемости без прогрессирования, наблюдаемое при проведении химиотерапии, к сожалению, не оказывало влияния на ОВ пациентов. Все это делало мМК практически неизлечимой болезнью и побуждало к проведению все новых и новых клинических исследований.
В период с 1970 по 2010 г. было проведено более 3000 (3337 – PubMed; критерий поиска: «melanoma clinical trial») клинических исследований при меланоме, и ни один из исследуемых препаратов/режимов не продемонстрировал увеличения ОВ пациентов вплоть до 2011 г., когда благодаря исследованиям в области молекулярной биологии и иммунологии опухолей появилось два новых класса лекарственных препаратов: ингибиторы регуляторных молекул ключевых этапов иммунного ответа (CTLA4, PD1, PD-L1) и ингибиторы тирозинкиназных рецепторов (BRAF, MEK, NRAS) [7].
Первые значительные успехи в лечении МК, как уже было отмечено, произошли в 2011 г., когда FDA (Управление по контролю качества пищевых продуктов и лекарственных средств) зарегистрировало в США ипилимумаб (anti-CTLA4 – цитотоксический антиген Т-лимфоцита-4) и вемурафениб (BRAFi – ингибитор BRAF) для лечения диссеминированной МК. Оба препарата впервые продемонстрировали достоверное увеличение общей выживаемости пациентов с мМК по сравнению со стандартной химиотерапией.
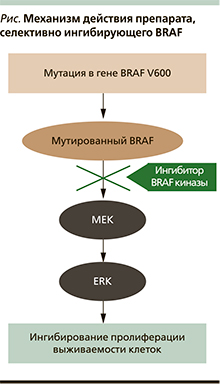
В 2002 г. исследователи института по изучению генома Sanger Institute (Великобритания) обнаружили, что приблизительно в 40–60% образцов МК есть мутации гена, кодирующего протеинкиназу BRAF [8]. Самой частой мутацией в гене BRAF при МК (около 90%) является мутация V600E – замена аминокислоты валин на глутамин, что приводит к увеличению киназной активности фермента BRAF по отношению к нижестоящей киназе MEK во внутриклеточном пути передачи сигнала. Помимо мутации V600E в гене BRAF встречаются и другие мутации (V600K, V600R, V600D, и др.), также активирующие киназную активность этого фермента. Активация MAPK-пути внутриклеточной передачи сигнала через последовательную активацию киназ MEK и ERK вызывает неконтролируемую пролиферацию клетки и блокаду апоптоза [9–10, 19].
Доклинические и клинические данные подтверждают, что эффект препарата, селективно ингибирующего BRAF, направлен на опухоли, которые содержат мутацию в гене BRAF (см. рисунок). Воздействие этих молекул на опухолевые клетки с нормальным BRAF, напротив, может сопровождаться патологической активацией каскада BRAF-MEK-ERK и провоцировать рост меланомы. По этой причине перед началом терапии ингибиторами BRAF необходимо обязательно проводить тестирование образца опухоли пациента на BRAF-мутацию.
Как было отмечено выше, первым препаратом, продемонстрировавшим статистически значимое увеличение общей выживаемости пациентов и зарегистрированным по показаниям мМК группы таргетной терапии, стал вемурафениб. Вемурафениб блокирует патологический сигнальный каскад, который запускается мутацией BRAFV600.
Препарат назначается в дозе 960 мг дважды в день per os (суточная доза – 1920 мг) для пациентов с метастатической и неоперабельной меланомой кожи при наличии мутации BRAFV600. Лечение проводят до прогрессирования заболевания или развития непереносимости терапии. Данный препарат получил одобрение для использования в США и странах Европы в 2011 г., на территории РФ в декабре 2013 г. Одобрение вемурафениба произошло на основании результатов исследования III фазы, BRIM-3, где была оценена его эффективность по сравнению со стандартной химиотерапией дакарбазином пациентов с мМК, ранее не получавших системного лечения. Основные цели данного исследования: оценка общей выживаемости и выживаемости без прогрессирования [11]. В исследование вошло 675 пациентов с мутацией BRAFV600, имеющих неоперабельную IIIC или IV стадию МК. Пациентов случайным образом распределили в отношении 1:1.
В группу вемурафениба (960 мг внутрь, два раза в сутки per os) были включены 337 пациентов и в группу дакарбазина (1000 мг/м2 в/в каждые 3 недели) – 338 пациентов. Лечение продолжали до прогрессирования заболевания, неприемлемой токсичности или до отзыва согласия пациентом по любой причине. Вемурафениб продемонстрировал статистически значимое увеличение общей выживаемости у пациентов с мМК при наличии мутации BRAFV600, ранее не получавших системной терапии. В данном исследовании было показано, что по сравнению с химиотерапией вемурафениб на 30% снижает риск смерти (HR=0,70; p=0,0008) и кроме того, на 62% (HR=0,38; p<0,0001) уменьшает риск прогрессирования заболевания (выживаемость без прогрессирования – вторая основная цель исследования). В ходе исследования показано значительное увеличение частоты объективного ответа на лечение в группе вемурафениба (57%, включая 5,6% полных ответов) по сравнению с группой дакарбазина, где частота объективного ответа на лечение составила 8,6% (1,2% полных ответов). Медиана общей выживаемости при использовании вемурафениба составила 13,6 месяца и была значимо выше, чем в группе дакарбазина, – 9,7 месяца (р<0,001). Еще существенней оказалась разница медианы ВБП: 6,9 месяца против 1,6 (р<0,001). Несмотря на разрешенный протоколом исследования переход больных из группы дакарбазина в группу вемурафениба после прогрессирования заболевания статистически достоверные различия между группами сохранились. Из группы вемурафениба 60 (18%) пациентов и 73 (22%) пациента группы дакарбазина после прогрессирования болезни получали ипилимумаб.
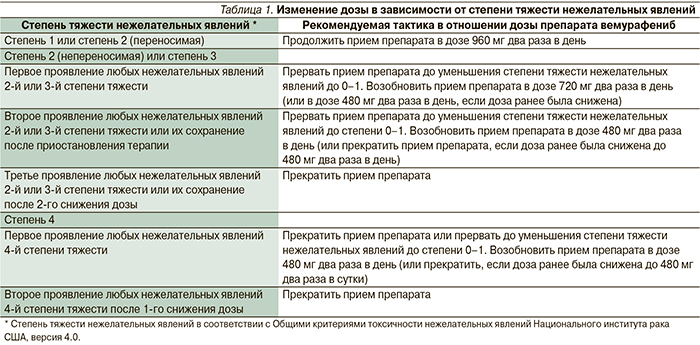
Нежелательные явления ингибиторов BRAF обусловлены их механизмом действия и включают развитие кератоакантом и плоскоклеточного рака, которые подвергаются хирургическому иссечению и не требуют отмены препарата/перерыва в лечении; также встречаются дерматиты, повышенная фоточувствительность кожи, артралгии, слабость, выпадение волос, нарушение функции печени. Разработаны критерии модификации дозы вемурафениба в зависимости от развившихся нежелательных явлений, однако не рекомендуется уменьшать дозу препарата ниже 480 мг два раза в день (табл. 1) [12].
Дабрафениб, так же как и вемурафениб, блокирует патологический сигнальный каскад, запущенный мутацией BRAFV600. Назначается препарат в дозе 150 мг дважды в день per os (суточная доза – 300 мг) пациентам с диссеминированной меланомой кожи и мутацией BRAFV600. Основанием регистрации дабрафениба в США и странах Европейского Союза в 2013 г. стали результаты рандомизированного исследования III фазы (BREAK-3), опубликованные в журнале «Lancet». Первичной целью данного исследования было оценить ВБП, вторичной – оценка общей выживаемости. В исследование были включены 225 пациентов, позитивных по мутации BRAFV600, с неоперабельной IIIC и IV стадиями МК. В данном исследовании сравнивались два режима терапии пациентов с мМК, ранее не получавших лекарственного лечения: монотерапия дабрафенибом (n=187) vs монотерапии дакарбазином (n=63). Было показано, что у пациентов, получавших дабрафениб, медиана ВБП была статистически значимо выше по сравнению с пациентами, получавшими дакарбазин (5,1 месяца против 2,7; p<0,0001) [13]. По данным, представленным на конгрессе Американского общества клинической онкологии в 2012 г., частота ответов на лечение в группе дабрафениба составила 53% (включая 3% полных ответов), а в группе дакарбазина – 19% (0% полных ответов). Медиана общей выживаемости в группе дабрафениба составила 18 месяцев и более 15 месяцев в группе дакарбазина. Столь высокий показатель общей выживаемости в группе дакарбазина связан с тем, что пациенты при прогрессировании заболевания в соответствии с условиями протокола могли получать дабрафениб. Нежелательные явления дабрафениба в целом сопоставимы с нежелательными явлениями емурафениба.
Траметиниб (Мекинист) является ингибитором киназы МЕК, которая активирует MAPK-(mitogen-activated protein kinase)-сигнальный путь. Траметиниб назначается в дозе 2 мг per os однократно, ежедневно. Препарат был одобрен в США и странах Европы в 2013 г. для использования пациентами с мМК и наличием мутации BRAFV600 на основании данных исследования III фазы METRIC [14].
В исследование METRIC были включены 322 пациента с нерезектабельной или метастатической МК с наличием мутации V600E или V600K; допускалось предшествующее использование I и более линий лекарственного лечения за исключением ингибиторов тирозинкиназ. Пациенты были распределены в отношении 2:1 в группу терапии траметинибом в дозе 2 мг (n=214) и группу химиотерапии (n=108). В данном исследовании пациенты были стратифицированы по уровню лактатдегидрогеназы в сыворотке крови и предшествующему лечению. Медиана выживаемости без прогрессирования в группе траметиниба составила 4,8 месяца по сравнению с группой химиотерапии – 1,5 месяца (p<0,0001). Частота объективного ответа в группе с траметинибом составила 22 против 8% в группе химиотерапии.
Спектр нежелательных явлений ингибиторов MEK несколько отличается от ингибиторов BRAF и включает отеки, нарушение зрения (вплоть до отслойки сетчатки), сыпь, повышение артериального давления, сухость кожных покровов, зуд, боли в животе, диарею, нарушение функции печени, анемию. Нежелательные явления 3-й степени выраженности включали повышение артериального давления (12%) и сыпь (7%).
В январе 2014 г. FDA одобрило комбинацию траметиниба и дабрафениба для лечения пациентов с мМК и мутациями BRAF V600E/K на основании результатов (частота и продолжительность объективных ответов) лечения пациентов в рамках клинического исследования 1/2 фазы. Так, при оценке исследователями частота объективных ответов и продолжительность ответа составили 76% (95% ДИ – 62–87) и 10,5 месяцев (95% ДИ – 7–15) для комбинации; и 54% (95% ДИ – 40–67) и 5,6 месяца (95% ДИ – 5–7) для монотерапии дабрафенибом соответственно. При оценке независимым комитетом частота ответов была несколько ниже, но также значимой – 57 и 46% соответственно. Интересно отметить, что частота развития злокачественных новообразований кожи (включая плоскоклеточный рак и кератоакантомы) оказалась ниже в группе комбинированной терапии (7% [95% ДИ, 2–18]) по сравнению с монотерапией дабрафенибом (19% [95% ДИ– 9–32]). Наиболее частыми нежелательными явлениями (≥20%) при использовании комбинации были лихорадка, озноб, утомляемость, сыпь, тошнота, рвота, диарея, боли в животе, периферические отеки, кашель, головная боль, артралгии, снижение аппетита, миалгия [15].
Для подтверждения данных и получения окончательного одобрения на использование данной комбинации препаратов было проведено исследование III фазы, COMBI-d, где сравнивали комбинированную терапию дабрафенибом и траметинибом против дабрафениба и плацебо. В данном исследовании III фазы были получены следующие результаты: подтвержденная частота объективного ответа составила 67% (полных ответов [ПО 10%]) для комбинации препаратов и 51% (ПО 9%) для дабрафениба и плацебо (p=0,0015). Медиана выживаемости без прогрессирования составила 9,3 месяца против 8,8 соответственно (ОР – 0,75, 95% ДИ – 0,57–0,99; p =0,035). На основании результатов исследования COMBI-d комбинация дабрафениба и траметиниба получила подтверждение одобрения FDA и в настоящее время доступна для использования лишь на территории США. Европейское медицинское агентство не одобрило данную комбинацию.
Еще одним препаратом данной группы является кобиметиниб (GDC-0973), который в настоящее время проходит клинические исследования и пока не зарегистрирован. Кобиметиниб (GDC-0973) является высокоселективным ингибитором протеинкиназы МЕK – серин/треонин киназа, представляющим собой компонент RAS/RAF/MEK/ERK пути. В настоящее время проводится исследование III фазы, coBRIM, первые результаты которого стали доступны в сентябре 2014 г. на конгрессе Европейского общества медицинской онкологии (ESMO). В рамках данного исследования III фазы оценивается эффективность терапии вемурафенибом в сочетании с кобиметинибом по сравнению с вемурафенибом и плацебо у пациентов, ранее не получавших терапии по поводу мМК с мутацией BRAFV600 (выявленной с помощью метода cobas® 4800). В исследование были включены 495 пациентов, из них 247 получали комбинацию вемурафениб/кобиметиниб и 248 – вемурафениб/плацебо. Продолжительность одного курса терапии составила 28 дней: вемурафениб назначался в дозе 960 мг два раза в день с 1-го по 28-й день per os; кобиметиниб или плацебо назначались в дозе 60 мг один раз в день с 1-го по 21-й день per os с перерывом не менее 7 дней.
Лечение продолжали до наступления прогрессирования заболевания, неприемлемой токсичности или отказа пациента от дальнейшего участия в исследовании. Первичной конечной точкой исследования была оценка выживаемости без прогрессирования, по мнению исследователей. Вторичные конечные точки включали общую выживаемость, частоту объективных ответов, продолжительность ответа, выживаемость без прогрессирования по оценке независимого комитета по лучевой диагностике, безопасность, фармакокинетику, а также качество жизни, оцениваемое с помощью опросников QLQ-C30 и EQ-5. Медиана выживаемости без прогрессирования по оценке исследователей составила 9,9 месяца в группе комбинированной терапии и 6,2 – в группе терапии вемурафенибом/плацебо (ОР=0,51; р<0,0001). Частота объективных ответов (полных и частичных) составила 68% (включая 10% полных ответов) в группе комбинированной терапии и 45% (4% полных ответов) в группе вемурафениб/плацебо (р<0,0001).
Девять месяцев пережили 81,1% больных группы комбинированной терапии и 72,5% группы вемурафениба (ОР=0,65; р=0,046). Комбинация вемурафениб/кобиметиниб по сравнению с вемурафенибом/плацебо была связана с большей частотой развития нежелательных явлений ≥3-й степени тяжести (65% vs 59%), однако не отмечено никаких различий по частоте нежелательных явлений, приведших к прекращению лечения исследуемым препаратом. Исследователи отметили также снижение частоты развития вторичных злокачественных новообразований кожи в группе комбинированной терапии [17, 18].
У пациентов с мутацией гена c-KIT в опухоли возможно использование иматиниба [20]. Иматиниб – ингибитор тирозинкиназы BCR-ABL, используемый в настоящее время при хроническом миелолейкозе, а также при гастроинтестинальных стромальных опухолях с c-KIT мутацией. В исследование II фазы были включены 43 пациента с метастатической меланомой. Медиана времени наблюдения составила 12 месяцев. Контроль роста опухоли достигнут 53,5% пациентов: 10 пациентами (23,3%; 95% ДИ – 10,2% – 36,4%) и 13 пациентами (30,2%; 95% ДИ – 16,0% – 44,4%) зарегистрированы частичный ответ и стабилизация болезни соответственно. Важно отметить, что частичный ответ 9 из 10 пациентов сочетался с мутациями в 11-й и 13-й экзонах. Показатель 1-летней общей выживаемости составил 51%. Медиана выживаемости без прогрессирования и общей выживаемости для пациентов, у которых был зарегистрирован частичный ответ или стабилизация болезни, против пациентов с прогрессированием заболевания составили 9,0 месяцев по сравнению с 1,5 (р<0,001) и 15,0 против 9,0 месяцев (р=0,036) соответственно. Исследователи отметили хорошую переносимость терапии иматинибом в дозе 400 мг в сутки [21].
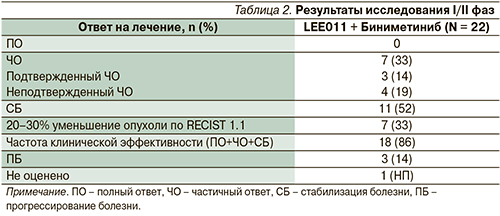
Для пациентов с мутацией гена NRAS в настоящее время проводятся клинические исследования препаратов: траметиниба в монорежиме и в сочетании с ингибитором CDK4/6 (палбоциклиб), биниметиниб в сочетании с ингибитором CDK4/6 (LEE011). Первые результаты исследования I/II фаз изучения биниметиниба в сочетании с ингибитором CDK4/6 были представлены в 2014 г. на конгрессе Американского общества клинической онкологии (ASCO) (табл. 2). Как видно, общая частота эффективности терапии, включающая как частоту полных ответов, частичных ответов, так и частоту стабилизаций болезни, составила 86% (18 пациентов). Но это предварительные данные, требующие дальнейшего подтверждения.
Таким образом, понимание причин, лежащих в основе молекулярно-генетической гетерогенности опухоли, привело к разработке новых препаратов, которые коренным образом изменили представление о мМК как об опухоли, рефрактерной к лекарственному лечению. Использование ингибиторов BRAF в группе больных мМК, имеющих специфический молекулярно-генетический «портрет» опухоли, а именно BRAF-мутацию, значительно повышает эффективность лечения по сравнению с традиционной химиотерапией. Это уже нашло свое отражение в современных международных рекомендациях, где ингибиторы BRAF стали новым стандартом лечения метастатической BRAF позитивной меланомы.
Применение иматиниба пациентами с мутацией гена c-KIT продемонстрировало обнадеживающие результаты. Эффективность таргетной терапии при NRAS позитивной меланоме в настоящее время изучается, но те предварительные данные, которые имеются уже сегодня, говорят о том, что вероятнее всего использование ингибиторов MEK в сочетании с ингибиторами CDK4/6 станет новым вариантом лекарственного лечения NRAS-позитивной меланомы. Хочется надеяться, что все эти препараты в скором времени будут доступны и российским пациентам в рамках не только клинических исследований и программ широкого доступа, но и стандартной практики.


