Лимфома из клеток мантии (ЛКМ) – сравнительно редко встречающееся заболевание (5–7 % от всех неходжкинских лимфом) с определенной морфологической, биологической и клинической характеристиками [1]. Более чем в 50 % случаев ЛКМ заболевают пожилые люди в возрасте 65 лет и старше, мужчин среди них – 60–70 %.
С учетом пожилого возраста больных при выборе терапии необходимо принимать во внимание не только эффективность лечения, но и его возможные осложнения, влияющие на качество и сроки жизни пациентов.
Диагноз ЛКМ чаще всего устанавливается при иммуноморфологическом исследовании биоптата лимфатического узла. Обычно морфологический облик опухоли определяется как классический или мелкоклеточный (центроцитоподобные клетки). Реже встречается бластоидный вариант [2], в этом случае опухолевые клетки крупнее, имеют несколько ядрышек, характеризуются высокой пролиферативной активностью (Ki-67 > 30 %). При иммуногистохимическом исследовании опухолевой ткани выявляется экспрессия СD79a, CD20, типична коэкспрессия опухолевыми клетками Т-клеточного маркера CD5. Важным маркером для проведения дифференциальной диагностики с хроническим лимфолейкозом (также СD5-позитивной опухолью) является антиген CD23, который при ЛКМ, как правило, отсутствует, в то время как при лимфолейкозе определяется коэкспрессия обоих антигенов – CD5 и CD23 [2, 3]. Основным онкогенным событием в развитии ЛКМ служит транслокация t(11;14)(q13;q32) с гиперэкспрессией белка циклин D1, что в свою очередь приводит к нарушению регуляции клеточного цикла и определяет непрерывный пролиферативный потенциал опухолевых клеток [4].
Приблизительно у 15 % больных заболевание протекает как индолентное, характеризуется длительной выживаемостью, медленным прогрессированием, умеренной чувствительностью к химиотерапии [5]. В большинстве случаев характерно агрессивное течение ЛКМ, 5-летняя выживаемость составляет лишь 27 % [1]. Ситуация несколько улучшилась за последнее десятилетие вследствие появления и широкого применения в лечении больных ЛКМ новых терапевтических агентов и методов [6]. Первым значимым событием на пути к улучшению результатов лечения стало появление моноклонального антитела анти-CD20 (ритуксимаба). Сочетание со стандартным режимом полихимиотерапии СНОР позволило увеличить частоту полных ремиссий до 34 против 7 %, улучшить показатели выживаемости без прогрессирования (ВБП; медиана 28 против 14 месяцев) и общей выживаемости (медиана 37 против 27 месяцев) [7–10]. Второе событие – применение высоких доз цитарабина на этапе индукции. В настоящее время рутинно используется несколько режимов полихимиотерапии с включением высоких доз цитарабина, эффективность их сопоставима, выбор конкретного режима зависит от предпочтения клиники [11–14]. И наконец важнейшим событием стало использование с целью консолидации эффекта, достигнутого в результате индукционного лечения, высокодозной химиотерапии с последующей аутологичной трансплантацией гемопоэтичесих стволовых клеток (ВДХТ с ауто-ТГСК). Эффективность высокодозной консолидации подтверждена многочисленными клиническими исследованиями, этот метод позволяет половине больных оставаться без признаков болезни на протяжении 4,5 лет при медиане сроков жизни 7,5 лет [15–17]. ВДХТ с ауто-ТГСК в настоящее время остается стандартом лечения первой линии молодых больных ЛКМ [5].
Обозначенные лечебные подходы в большей мере касаются молодых пациентов, при том что большинство заболевших старше 65 лет. Проведение пожилым больным интенсивных режимов лечения с использованием высоких доз цитарабина, тем более ВДХТ с ауто-ТГСК, обычно сопровождается высокой гематологической и негематологической токсичностью. Однако даже среди пациентов моложе 65 лет есть те, которым наличие серьезных сопутствующих заболеваний лимитирует использование интенсивных режимов химиотерапии. Таким образом, более чем половина пациентов с ЛКМ на момент постановки диагноза не являются кандидатами на проведение лечения с использованием высоких доз цитарабина и последующей консолидацией ВДХТ с ауто-ТГСК.
В ряде исследований показано, что при достижении полной ремиссии шанс на долгосрочную ВБП значительно возрастает [18]. При выборе лечебного режима для пожилого больного ЛКМ необходимо стремиться получить максимальный противоопухолевый эффект, минимизировав все возможные осложнения лечения.
В настоящее время стандартом лечения пожилых больных ЛКМ является режим R-CHOP (ритуксимаб, доксорубицин, винкристин, циклофосфамид, преднизолон). При его использовании противоопухолевый эффект (полная + частичная ремиссия) констатируется среди 85 % больных с частотой достижения полных ремиссий 30–40 % [19]. Проведение поддерживающей терапии ритуксимабом после завершения иммунохимиотерапии позволяет улучшать показатель 4-летней ВБП у пожилых больных ЛКМ до 58 %, при этом 85 % пациентов на тот момент были живы [2, 19]. Проведение поддерживающей терапии ритуксимабом (каждые 2 месяца на протяжении 24 месяцев или до прогрессирования) в настоящее время служит стандартом лечения пожилых больных ЛКМ.
По данным исследования Европейской группы по изучению ЛКМ, при сравнении эффективности применения к пожилым больным ЛКМ (средний возраст – 70 лет) режима R-FС (ритуксимаб, флударабин, циклофосфамид) и стандартного R-СНОР результаты оказались неожиданными. Частота общего ответа составила 86 % в группе R-СНОР и 78 % в группе R-FС, частота полных ремиссий в обеих группах достоверно не различалась – 34 и 40 % соответственно. В то же время показатели общей выживаемости оказались достоверно лучшими в группе R-СНОР: 4-летняя общая выживаемость – 62 против 47 %. Это различие было обусловлено в первую очередь высокой токсичностью режима R-FС [20].
Как правило, для очень пожилых пациентов, а также больных с тяжелой сопутствующей, в первую очередь сердечно-сосудистой, патологией проведение режима R-СНОР крайне проблематично. Альтернативным препаратом лечения этих больных может быть бендамустин. Сравнительное исследование эффективности и безопасности комбинаций R-В (ритуксимаб + бендамустин) и R-СНОР в качестве первой линии терапии первичных больных индолентными неходжкинскими лимфомами включило 94 пациента с ЛКМ (средний возраст – 70 лет).
Медиана ВБП для этих больных составила 35 месяцев при применении режима R-В и 22 – при лечении по схеме R-СНОР. При сравнении токсичности режимов оказалось, что при использовании R-В частота развития осложнений, связанных с лечением, была достоверно ниже. Преимущества режима R-В по сравнению с R-СНОР, в т.ч. меньшая токсичность, несмотря на отсутствие разницы в общей выживаемости, позволили рекомендовать его в качестве первой линии терапии пожилых больных ЛКМ [21].
В некоторых случаях может быть оправданно применение режима R-CVP (ритуксимаб, циклофосан, винкристин, преднизолон) [2]. Альтернативой для ослабленных и очень пожилых больных ЛКМ может стать режим метрономной полихимиотерапии РЕРС ± R (прокарбазин, этопозид, преднизолон, циклофосфамид ± ритуксимаб), возможно использование хлорамбуцила в комбинации с ритуксимабом [23].
Результаты использования ритуксимаба в качестве монотерапии больных ЛКМ в отличие от таковых при фолликулярной лимфоме значительно скромнее: применение этого препарата позволяет на непродолжительный срок контролировать болезнь лишь у 27 % больных (ВБП 6 месяцев). Длительное лечение ритуксимабом не улучшило существенно отдаленные результаты [24].
В случае локальной лимфаденопатии в отсутствие возможности проведения лекарственного лечения в качестве лечебного воздействия с паллиативной целью может быть применена лучевая терапия [25].
В настоящее время стандартов лечения рецидивов и рефрактерных форм ЛКМ у пожилых больных нет. Может быть успешно применен режим R-B, о чем свидетельствуют данные рандомизированных исследований [26]. Кроме того, имеются данные о повторном назначении бендамустина при рецидивах и рефрактерном течении ЛЗМ больным, ранее получавшим лечение этим препаратом [27], хотя достоверные сведения об эффективности бендамустина в этой ситуации не опубликованы [28]. Как вариант может быть предложена комбинация с митоксантроном – общая эффективность лечения составляет 58–79 % [28]. Однако эта схема не является предпочтительной для пациентов, ранее получавших лечение в режиме R-СНОР, из-за кумулятивного кардиотоксического эффекта антрациклинов.
Режимы, содержащие флударабин, считаются эффективными, в т.ч. при рецидивах и рефрактерном течении ЛЗМ, однако их назначение пожилым больным во многом ограничено потенциальной токсичностью [29].
Большинство пожилых больных ЛКМ в дебюте заболевания не получали режимы, содержащие высокие дозы цитарабина. Итальянские авторы опубликовали результаты лечения по программе R-BAC (бендамустин, высокие дозы цитарабина, ритуксимаб). Эта схема применялась в каячестве лечения пожилых больных ЛКМ (средний возраст – 70 лет), в т.ч. в исследование были включены пациенты с рецидивами и рефрактерным течением опухоли. Были получены обнадеживающие результаты: терапия была эффективной для 80 % пациентов, полные ремиссии достигнуты в 70 % случаев [30]. Двухлетняя ВБП в этой группе составила 70 %. Однако лечение ассоциировалось с развитием значительного числа осложнений, в первую очередь миелосупрессии.
Монотерапия с использованием пуринового нуклеозида кладрибина продемонстрировала активность при рецидиве ЛКМ с относительно низкой токсичностью [31].
Бортезомиб в монорежиме был эффективен при рецидивах ЛКМ в 30–45 % случаев, однако медиана ВБП составила всего 6 месяцев [32, 33].
В настоящее время изучаются также комбинации бортезомиба с цитарабином с возможностью коррекции (снижения) дозы цитарабина для пациентов пожилого возраста [34].
Имеются сообщения, согласно которым иммуномодулирующий препарат леналидомид эффективен при рецидивах ЛКМ в 42–55 % случаев, хорошо переносится пожилыми больными, однако ВБП при его применении составляет всего 6 месяцев [35, 36]. Ожидаются результаты рандомизированных исследований по применению леналидомида при ЛЗМ.
Клиническое наблюдение терапии 80-летней больной ЛЗМ
Больная С. 1930 г. р. находится под наблюдением РОНЦ с апреля 2010 г.
В мае 2009 г. заметила появление слабости, потливости, похудела на 7 кг.
В феврале 2010 г. была выполнена плановая экстракция 2-го, 3-го, 4-го нижних зубов слева и в связи с отсутствием заживления лунок рекомендована консультация онколога. Обратилась в РОНЦ, при цитологическом исследовании (соскоб альвеолярного отростка нижней челюсти) обнаружен плоскоклеточный рак. В условиях хирургического отделения РОНЦ 05.05.2010 выполнено оперативное вмешательство – краевая резекция нижней челюсти слева. Гистологическое заключение: кусочки слизистой оболочки, покрытой многослойным плоским эпителием, с комплексами амелобластомы, поверхностный вариант, с отложением солей кальция. Во время госпитализации обследование больной выявило увеличение лимфатических узлов в шейно-надключичных областях до 1,6 × 1,1 см, в аксиллярных – до 1,6 × 0,7 см, в паховых – до 2,0 × 0,8 см, по ходу аорты и нижней полой вены – 2,5 ×1,5 см. Спленомегалия, в структуре селезенки множественные очаги до 1,1 см. Больной выполнено исследование костного мозга.
В миелограмме отмечено незначительное увеличение числа лимфоцитов – до 18 %, однако при проточной цитофлуориметрии лимфоидные элементы костного мозга имели иммунофенотип периферической В-клеточной CD5-позитивной, CD23-негативной лимфомы, клональной по каппа-типу. При морфологическом исследовании материала трепанобиопсии подвздошной кости среди элементов гемопоэза обнаружены интерстициально и в виде небольших скоплений расположенные мелкие лимфоидные клетки с округло-овальными и слегка неправильными ядрами.
При иммуногистохимическом исследовании образца выявлена рыхлая интерстициально-мелкоочаговая В-клеточная инфильтрация CD20+-клеток. Опухолевые клетки циклин D1 позитивны, Т-клетки обнаружены в умеренном количестве (CD3+, CD3 < CD5, в т.ч. В-клетки). При эзофагогастродуоденоскопии выявлена картина острого эрозивно-геморрагического гастрита, однако морфологическое исследование гастробиоптата подтвердило опухолевое поражение желудка. Таким образом, после проведенного комплекса диагностических мероприятий установлен диагноз: первично множественные синхронные злокачественные опухоли: 1. Амелобластома нижней челюсти. Состояние после оперативного вмешательства в объеме краевой резекции нижней челюсти слева. 2. Лимфома из клеток мантии с поражением периферических лимфоузлов по обе стороны диафрагмы, лимфоузлов забрюшинного пространства, селезенки, желудка, костного мозга. Стадия IVВ. MIPI-высокий риск. ECOG-2. Сопутствующие заболевания: ИБС. Стенокардия напряжения. Функциональный класс II. Атеросклеротический кардиосклероз. Атеросклероз аорты. Недостаточность митрального и аортального клапанов. Сердечная недостаточность, функциональный класс II по NYHA. Дисциркуляторная энцефалопатия 2-й ст., смешанного генеза. Поликистоз почек. Мочекаменная болезнь. Хронический пиелонефрит.
При выборе метода противоопухолевого лечения нами были учтены пожилой возраст больной, перенесенное недавно оперативное вмешательство, общее состояние пациентки, наличие сопутствующих заболеваний. Все перечисленное ограничивало возможности проведения стандартных режимов полихимиотерапии. В качестве индукционной терапии был назначен режим РЕРС + R (ритуксимаб 600 мг внутривенно, день 1; прокарбазин 50 мг перорально, 1–14-й дни; циклофосфамид 50 мг перорально, 1–14-й дни, этопозид 100 мг перорально 2 раза в неделю; преднизолон 10 мг перорально через день, 1–14-й дни). Больная получила в данном режиме 7 курсов. Следует отметить, что за время терапии она была трижды госпитализирована по поводу различных инфекционных осложнений. Эффект лечения после завершения седьмого курса расценивался как частичная ремиссия. Больной проведена поддерживающая терапия ритуксимабом 600 мг 1 раз в 2 месяца в течение 2 лет, что улучшило качество противоопухолевого эффекта: в мае 2011 г. после комплексного обследования констатирована полная ремиссия.
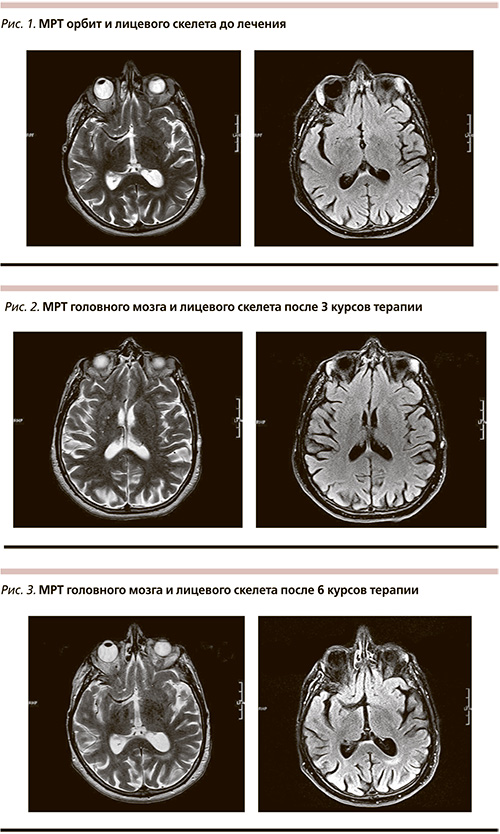
С октября 2012 г. у больной появились жалобы на горечь во рту, периодически возникающую припухлость верхних век, сухость глаз. Наблюдалась у окулиста по поводу аллергического конъюнктивита. В августе 2013 г. припухлость век резко усилилась, появилось опухолевое образование в области твердого неба. Магнитно-резонансная томография орбит и лицевого скелета выявила выраженное увеличение и смещение слезных желез обеих орбит (справа – 2,6 × 1,5 × 3,2 см, слева – 2,1 × 1,4 × 3,2 см), новообразования орбит распространялися вдоль латеральных прямых мышц глазных яблок. Аналогичное образование размером до 2,0 × 1,2 × 2,3 см отмечено в проекции твердого неба справа на границе с медиальной стенкой правой верхнечелюстной пазухи (рис. 1). Из-за опасности развития серьезных осложнений биопсия опухолевых образований орбит и твердого неба не производилась. Рецидив подтвержден при цитологическом исследовании материала пункционной тонкоигольной биопсии указанных областей. При дополнительном комплексном обследовании других очагов распространения лимфомы выявлено не было. Таким образом, у больной установлен рецидив ЛКМ с поражением придаточного аппарата глаз и твердого неба. Было проведено 6 курсов терапии в режиме R-B – ритуксимаб 600 мг 1-й день; бендамустин 110 мг (70 мг/м2) 2–3-й дни каждого цикла. При оценке эффекта после 3-го курса установлена частичная ремиссия. На серии магнитно-резонансных томограмм головного мозга и лицевого черепа по сравнению с предыдущим исследованием слезные железы уменьшились в размерах – справа до 1,3 × 0,6 ×1,4 см, слева до 1,2 × 0,5 × 1,3 см, перестало определяться образование в проекции твердого неба справа (рис. 2). Полная ремиссия констатирована после завершения шести курсов терапии (рис. 3).
Лечение больной проведено в амбулаторном режиме, внеплановых госпитализаций по поводу каких-либо нежелательных явлений не потребовалось.
Таким образом, высокая эффективность и благоприятный профиль токсичности делают программу R-B особенно привлекательной в лечении пожилых больных ЛКМ как при первичном обращении, так и при рецидивах заболевания.


