Введение
Глобальная мировая тенденция в структуре населения выражается в существенном увеличении доли людей старшего возраста. По сравнению с 2005-м в 2010 г. прирост населения старше 60 лет составил 6,9 %. Вместе с тем, по данным ВОЗ, в 2010 г. в мире насчитывалось 524 млн человек старше 60 лет, что составило 8 % всего населения земного шара. Расчеты демографов указывают, что темпы постарения населения в Российской Федерации могут опережать общемировые. По прогнозам, постарение населения стало особенно очевидным в крупных городах [1]. Так, доля людей 60 лет и старше в Санкт-Петербурге остается одной из самых высоких (21,1 %) по сравнению с другими территориями Российской Федерации (18,9 %). Кроме того, ожидаемая продолжительность предстоящей жизни в Санкт-Петербурге для лиц в возрасте 60–64 года составила 15,9, для жителей 75–79 лет – 7,8, а для жителей 85 лет и старше – 5,8 года [2]. Таким образом, диагностика, профилактика и лечение хронических заболеваний, ассоциированных с возрастом, должны стать приоритетом в организации медицинской гериатрической помощи.
Остеопороз (ОП) в полной мере относится к хроническим заболеваниям костно-мышечной системы и соединительной ткани, ассоциированным с возрастом (МКБ, класс XIII). Основным осложнением ОП, оказывающим существенное влияние на качество жизни и ее продолжительность, являются переломы, развивающиеся при минимальной травме или воздействии на скелет [3]. Число переломов, обусловленных ОП, увеличивается с возрастом, и более чем 50 % всех остеопоротических переломов происходят у людей старше 75 лет. В широкомасштабных эпидемиологических исследованиях показано, что распространенность вертебральных переломов среди женщин в возрасте 55–65 лет составляет 7,8 случая на 1000 человеко-лет, достигнув уровня 19,6 среди людей старше 75 лет [4]. Кроме того, для людей старшего возраста, имеющих предшествующие переломы в анамнезе, риск повторных переломов любой локализации существенно возрастает вследствие потери как костной, так и мышечной массы [5].
В некоторых работах, посвященных анализу оказания медицинской помощи больным ОП, говорится, что люди старшего возраста не получают в полной мере адекватного лечения [6]. Отсутствие лечения, когда оно показано, приводит к росту числа госпитализаций и медицинских затрат в целом. Складывающаяся ситуация может быть обусловлена двумя основными причинами. Во-первых, пациенты старшего возраста не вовлекаются в клинические исследования, соответственно, эффективность и переносимость доступных лекарственных средств остаются до конца невыясненными. Во-вторых, сложные правила приема антиостеопоротических препаратов (прежде всего бисфосфонатов [БФ] внутрь) создают дополнительные трудности, особенно при наличии когнитивных нарушений и функциональных ограничений вследствие множественной сопутствующей патологии (коморбидности).
Диагностика ОП
В настоящее время диагностика ОП, основанная на использовании двухэнергетической рентгеновской денситометрии (DXA – Dual-Energy X-ray Absorptiometry), широко вошла в клиническую практику многих медицинских организаций. Для установления диагноза необходимо провести измерение минеральной плотности костной ткани (МПК) в бедре (шейки бедра – Neck, проксимальном отделе бедренной кости – Hip) и/или позвоночнике (L1-4). Показатели денситометрии позволяют также проводить мониторинг лечения и оценивать риск переломов. Для людей старше 50 лет применим Т-критерий. Согласно критериям диагноза, предложенным ВОЗ, показатель Т должен составлять < -2,5 стандартных отклонений (СО) [7].
Экспертной группой ВОЗ под руководством J. Kanis (2008) был создан алгоритм выявления пациентов с высоким риском переломов, ассоциированных с ОП. Используя математическую модель FRAX (Fracture Risk Assessment Tool), можно рассчитать 10-летнюю вероятность перелома шейки бедренной кости и других типичных для ОП переломов у лиц в возрасте от 40 до 90 лет [8]. Данный метод основан на взаимодействии клинических факторов риска переломов, а именно возраста, наличия перелома проксимального отдела бедра у родителей, переломов в анамнезе у самого пациента, приема глюкокортикостероидов, курения и алкоголя, наличия ревматоидного артрита с учетом данных о МПК бедра или без него.
Стратегия профилактики и лечения ОП
Безусловно, что профилактика ОП и переломов должна стать доминирующей стратегией в лечении, поскольку количественные (снижение МПК) и качественные (нарушение микроархитектоники) изменения костной ткани практически необратимы. Профилактика ОП предусматривает достижения максимальной пиковой костной массы в период преобладания процессов костеобразования за счет рационального питания, достаточной ежедневной физической активности и исключения вредных привычек (курения и злоупотребления алкоголем). Как только достигается пиковая костная масса (примерно к 25–30 годам), в основу профилактики ложится принцип сохранения костной массы. С этой целью под особым вниманием должны находиться женщины в раннем периоде менопаузы. Заместительная гормональная терапия эстрогенами в сочетании с прогестагенами или без них для женщин и андрогенами для мужчин (при их недостаточности) может решить эту задачу. Для населения старшего возраста минимизации костных потерь – главный принцип профилактики ОП. Именно в этой популяции населения лекарственная терапия и лекарственная профилактика имеют особое значение.
Анализ всех проведенных рандомизированных клинических исследований (РКИ) III фазы длительностью не менее 3 лет, проведенных с целью определения антипереломного эффекта антиостеопоротических препаратов, показывает, что их применение позволяет снижать относительный риск вертебральных переломов на 30–70 %, а переломов бедра – на 30–51 %.
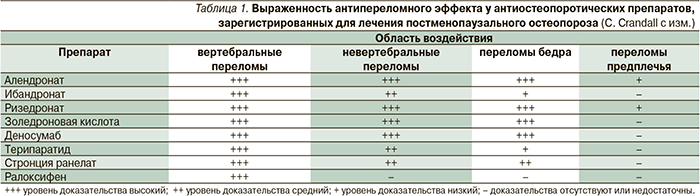
Эти данные позволяют рассчитывать такой показатель, как число пациентов, которых нужно пролечить препаратом для предотвращения одного перелома (number needed to treat – NNT). Так, для предотвращения одного вертебрального перелома понадобится пролечить от 9 до 21 пациента в течение 3 лет, а перелома бедра – более 48 человек [9]. Различные международные и национальные рекомендации высказываются в пользу предпочтительного применения антиостеопоротических препаратов, которые в РКИ продемонстрировали эффективность в отношении компрессионных переломов позвоночника, бедра и других невертебральных переломов. К таким препаратам относятся алендронат, ризедронат, золедроновая кислота, деносумаб, терипаратид и стронция ранелат (табл. 1) [10].
Наиболее широкое распространение в клинической практике получили БФ. Они показали свою эффективность предотвращать костные потери, обусловленные инволютивными процессами при старении, дефицитом эстрогенов у женщин в менопаузе и применением глюкокортикостероидов, что сопровождалось снижением риска переломов при постменопаузальном, глюкокортикостероидном остеопорозе и остеопорозе у мужчин. БФ в клинической практике стали использоваться 45 лет назад (этидронат – с 1977 г., памидронат – с 1991-го). Однако первым из азотсодержащих БФ, зарегистрированным для лечения постменопаузального остеопороза, стал алендронат (1995), затем ризедронат (2001), ибандронат (2005) и золедроновая кислота (2007).
В конечном итоге решение о применении того или иного препарата принимается в зависимости от конкретной клинической ситуации, зарегистрированных показаний (табл. 2), риска развития побочных эффектов, предпочтений пациента и других причин. Действительно, нет одного антиостеопоротического препарата, который мог бы быть применен всеми пациентами с ОП. Вместе с тем непереносимость одного из препаратов потребует перевода пациента на другое лекарственное средство.
Профилактика переломов у людей старшего возраста
Возраст как основная детерминанта ответа на лечение рассматривался в РКИ, в которых изучался эффект алендроната, ризедроната, золедроновой кислоты, стронция ранелата, терипаратида, деносумаба, а также ЗГТ на риски вертебральных и невертебральных переломов.
Оценить влияние пероральных БФ на риски невертебральных переломов не представлялось возможным, поскольку число людей старше 80 лет (или даже 75) оказалось невелико. Дизайн основных РКИ не предусматривал решения этой задачи, в связи с чем доверительный интервал оказывался достаточно широким. Так, в РКИ HIP и VERT эффективность влияния ризедроната на риск вертебральных переломов оказалась примерно одинаковой для пациентов как старше, так и моложе 80 лет [11, 12]. Количество невертебральных переломов достоверно снижалось только в группе пациентов моложе 80 лет [13]. Аналогичные данные были получены в РКИ FIT (Fracture Intervention Trial), в котором было зарегистрировано снижение относительного риска вертебральных переломов в подгруппе пациентов старше 75 лет на фоне терапии алендронатом [14].
В РКИ, в котором изучалась эффективность терипаратида среди 1085 женщин, было показано, что количество выявленных вертебральных переломов было одинаковым в подгруппах пациентов моложе и старше 75 лет [15]. Однако риски невертебральных переломов снижались только для пациентов моложе 75 лет.
Особенностью стронция ранелата стало доказательство его влияния на риски вертебральных и невертебральных переломов женщин старше 80 [16]. В большом проспективном исследовании WHI (Women’s Health Initiative) не было обнаружено влияния ЗГТ на риски переломов в различных возрастных группах [17].
Особенности применения золедроновой кислоты при ОП
Известно, что БФ относятся к классу антирезорбтивных средств. Они имеют высокое сродство к минерализованной костной ткани и прочно связываются с фосфатом кальция в составе гидроксиапатита, особенно в местах с повышенным костным обменом. Несколько независимых исследований показали, что точкой приложения для БФ является фермент фарнезил пирофосфат синтаза, участвующий в синтезе липидов по мевалоновому пути. Ингибирование данного фермента способствует замедлению остеокласт-обусловленной костной резорбции и вызывает апоптоз остеокластов. Золедроновая кислота подавляет активность фарнезила пирофосфата синтазы в десятки раз активнее, чем другие БФ [18]. Очевидно, что эта особенность золедроновой кислоты позволяет вводить ее реже и в меньшей дозировке, чем другие БФ.
При однократном внутривенном введении золедроновой кислоты пик концентрации в плазме достигается уже в конце инфузии, а затем быстро снижается. Через 24 часа менее 1 % действующего вещества определяется в крови, 43–55 % золедроновой кислоты связываются с белками плазмы вне зависимости от их концентрации. Золедроновая кислота не метаболизируется в организме человека, а экскретируется почками в неизмененном виде. До 40 % действующего вещества экскретируется в первые сутки после ее введения. Остальная часть попадает в костную ткань и медленно высвобождается в циркуляцию. Клиренс золедроновой кислоты зависит от функции почек, однако даже при клубочковой фильтрации 35–50 мл/мин экспозиция не меняется и, таким образом, не требуется коррекции дозы. Вместе с тем не рекомендуется лечение золедроновой кислотой при снижении клубочковой фильтрации ниже 35 мл/мин [19]. Не было выявлено изменений фармакокинетики препарата в зависимости от расовой принадлежности и возраста (от 38 до 84 лет). Однократное введение золедроновой кислоты приводит к быстрому снижению биохимических показателей, характеризующих процесс костной резорбции (примерно на 30–55 %). Затем практически одновременно происходит снижение костеобразования. Повторные ежегодные введения препарата не сопровождаются прогрессирующим снижением биохимических маркеров костной резорбции. Наименьшие значения биохимических маркеров костной резорбции зафиксированы через 7 дней от введения золедроновой кислоты в дозе 5 мг, а костеобразования – к 12-й неделе.
Эффективность золедроновой кислоты была продемонстрирована в рандомизированном двойном слепом плацебо-контролируемом международном исследовании HORIZON-PFT (Health Outcomes and Reduced Incidence with Zoledronic Acid Once Yearly – Pivotal Fracture Trial), в которое были рекрутированы 7736 женщин в возрасте от 65 до 89 лет. Подавляющее большинство пациентов были в возрасте 70–74 лет (38 % от общей популяции). Критерии включения: женщины в менопаузе с показателем МПК по Т-критерию бедра ≤ -1,5 СО и 2 компрессионными переломами позвонков легкой или одним средней степени или при МПК ≤ -2,5 СО при необязательном наличии вертебральных переломов. Пациенты не должны были получать ранее какой-либо антиостеопоротической терапии, кроме кальцитонина, заместительной гормональной терапии или селективных модуляторов эстрогеновых рецепторов. Все участники исследования обязательно получали 1000–1500 мг кальция и 400–1200 МЕ витамина Д ежедневно. Продолжительность исследования составила 3 года, основной целью стало изучение влияния препарата на риски вертебральных переломов и перелома шейки бедра. В результате проведенного лечения золедроновой кислотой в дозе 5 мг один раз в год абсолютное снижение вертебральных переломов составило 7,6 % за 3 полных года наблюдения; соответственно, относительный риск уменьшился на 70 % (за 1-й год – на 60 %, за 2-й – на 71 %) по сравнению с группой плацебо [20]. Также зафиксировано достоверное относительное снижение числа переломов бедра на 41 % среди пациентов, получавших в течение 3 лет 3 инфузии золедроновой кислоты. Абсолютное количество переломов в группе плацебо составило 2,5 %, в группе, получавшей золедроновую кислоту, – 1,45 %.

Стойкое снижение вертебральных переломов и переломов бедра на протяжении 3 лет наблюдения имело место независимо от возраста, числа зарегистрированных переломов на момент начала исследования, региональных и расовых особенностей, индекса массы тела, уровня МПК.
У пациентов старше 75 лет относительное снижение риска перелома бедра оказалось выше и достигало 60 % снижения по сравнению с группой плацебо (p < 0,0001). Результатом лечения явилось также снижение риска всех клинических переломов на 33 %, клинических вертебральных переломов – на 77, невертебральных переломов – на 25 %. Количество множественных вертебральных переломов снизилось на 89 % (0,2 % в группе вмешательства и 2,3 % в группе плацебо).
Снижение риска всех остеопоротических переломов сопровождалось повышением МПК в различных участках бедренной кости и позвоночнике через 6, 12, 24 и 36 месяцев от начала наблюдения. Проведено гистоморфологическое исследование костной ткани среди пациентов, получавших золедроновую кислоту.
Так, несмотря на подавление костного обмена, процесс костного ремоделирования сохранялся во всех (кроме одного) биоптатах подвздошной кости [82]. Не было получено никаких данных о нарушении качества костной ткани среди постменопаузальных женщин. Кроме того, не было зарегистрировано ни одного случая развития «замороженной» кости, фиброза костного мозга или проявлений клеточной токсичности. Получены косвенные доказательства положительного влияния золедроновой кислоты на показатели прочности губчатой и кортикальной кости по результатам количественной компьютерной томографии [21].
Другое исследование, проведенное с использованием микроспектроскопии на декальцинированной кости, выявило анаболический эффект золедроновой кислоты на костный матрикс в дополнение к основному антирезорбтивному действию [22].
Несколько исследований, в которых применялась золедроновая кислота с различной частотой (плацебо, 1 или 2 введения) женщинами в постменопаузе со сниженной МПК (остеопения) в течение 2 лет, позволили доказать профилактический эффект препарата [23].
В РКИ с дизайном, направленным на выяснение влияния золедроновой кислоты на риски повторных переломов, были включены пациенты, у которых развился наиболее неблагоприятный для жизни и функциональной активности перелом бедра. Участие в исследовании HORIZON-RFT (HORIZON-Recurrent Fracture Trial) приняли 2127 мужчин и женщин в возрасте старше 50 лет. Золедроновая кислота вводилась пациентам в течение 3 месяцев после выполнения хирургической операции (эндопротезирование, металлоостеосинтез) [24]. Если содержание 25(ОН)Д было < 15 нг/мл, такие пациенты получали высокую дозу витамина Д (50000–125000 МЕ) за 14 дней до введения исследуемого препарата, а затем 800–1200 МЕ витамина Д и кальций ежедневно. Относительный риск новых клинических переломов в среднем через 1,9 года уменьшился на 46 %, а всех невертебральных переломов – на 27,0 %. Относительный риск повторных переломов бедра сократился на 30 %, однако не было достигнуто статистически значимых различий из-за малого количества случаев.
Проведенный дополнительный анализ результатов того же исследования показал, что общая летальность от всех причин достоверно уменьшилась на 28 % среди пациентов, получивших золедроновую кислоту [25].
Эффективность и безопасность золедроновой кислоты при лечении и профилактике глюкокортикостероидного ОП изучались в рандомизированном многоцентровом двойном слепом плацебо-контролируемом исследовании с активным контролем. В исследование были включены 833 мужчины и женщины в возрасте 18–85 лет, которые получали преднизолон (или аналогичные глюкокортикостероиды) внутрь в дозе не менее 7,5 мг в день. Профилактическое лечение проводилось в группе пациентов, которые начали получать ГК за 3 месяца до рандомизации. Лечебная группа была сформирована из пациентов, которые получали глюкокортикостероиды более 3 месяцев. Пациентам назначалась либо золедроновая кислота внутривенно, либо ризедронат внутрь в дозе 5 мг в день. Исследование продемонстрировало, что золедроновая кислота действовала на показатели МПК не хуже, чем ризедронат, а МПК в поясничном отделе позвоночника увеличивалась в лечебной группе на +4,06 % (против 2,71 %), а в группе профилактики на +2,6 % (против 0,64 %) через 12 месяцев наблюдения. Статистически значимое повышение МПК в поясничном отделе позвоночника наблюдалось среди постменопаузальных женщин и мужчин. Количество зарегистрированных вертебральных переломов за период наблюдения было невелико, поэтому различий в группах сравнения не зарегистрировано [26]. Дополнительный анализ результатов того же исследования показал, что преимущество золедроновой кислоты заключалось в повышении МПК как в поясничных позвонках, так и в бедренной кости у женщин в период пременопаузы. Положительный эффект на показатели МПК развивался вне зависимости от возраста, пола и длительности менопаузы [27].
С целью изучения эффективности применения золедроновой кислоты для мужчин E. Orwoll и соавт. (2010) провели РКИ, в которое были включены 302 мужчины с остеопорозом в возрасте 25–86 лет (средний возраст – 64 года). В течение 2 лет проводилось лечение пациентов, распределенных в две сравниваемые группы. Первая группа получала два введения золедроновой кислоты, в группе сравнения назначался алендронат 70 мг в неделю. Дополнительно всем пациентам назначались комбинированные препараты кальция (1000 мг) и витамина Д (800–1000 МЕ) в день. Повышение МПК в поясничных позвонках наблюдалось в обеих группах (+6,1 и +6,2 % соответственно), что доказывает возможность использования золедроновой кислоты мужчинами с ОП [28].
Для оценки эффективности применения золедроновой кислоты пожилыми людьми был проведен дополнительный совокупный анализ данных двух РКИ (HORIZON-PFT и -RFT). Золедроновая кислота назначалась 4761 пациенту в возрасте старше 65 лет и 2083 – старше 75 лет. Не было выявлено различий в эффективности и переносимости золедроновой кислоты среди пациентов разных возрастных групп [20]. Однако более выраженный эффект на риск вертебральных переломов развился среди женщин в возрасте моложе 75 лет [29]. РКИ HORIZON-PFT явилось первым исследованием с использованием БФ, в котором было показано существенное снижение невертебральных переломов среди людей старше 75 лет [30].
РКИ, выполненное группой авторов, показало, что однократное введение золедроновой кислоты в сочетании с ежедневным применением терипаратида приводило к более выраженному увеличению МПК в позвоночнике, чем это было только при использовании терипаратида на 13-й неделе наблюдения. Через год МПК позвоночника в группах пациентов, получавших терипаратид и терипаратид в сочетании с золедроновой кислотой, оказалась примерно одинаковой, однако была более высокой по сравнению с теми, кто использовал только золедроновую кислоту. Более того, комбинированная терапия приводила к быстрому, выраженному и последовательному повышению МПК во всех измеряемых точках бедра в отличие от монотерапии золедроновой кислотой или терипаратидом через 13 недель. Различий в частоте развития нежелательных явлений в сравниваемых группах не выявлено [31].
Проблема комплаентности при длительном лечении хронических неинфекционных заболеваний обсуждается в литературе достаточно широко. Очевидно, что в отсутствие должной комплаентности со стороны пациентов невозможно добиваться сопоставимых результатов лечения, продемонстрированных в РКИ. В одной из последних научных статей, опубликованных J.R. Curtis и соавт. (2013), говорится, что 67 % врачей общей практики при назначении антиостеопоротических препаратов оптимистично оценивали приверженность к лечению своих пациентов. Однако в действительности лишь 40 % полностью соблюдали рекомендации по лекарственной терапии ОП [32]. В связи с этим наличие золедроновой кислоты для внутривенного введения безусловно не только позволяет улучшать приверженность, но и способствует организации строгого контроля за объемом терапии и ее эффективностью.
Анализ сравнительных исследований (золедроновая кислота и алендронат, золедроновая кислота и ризедронат) показал, что пациенты в 78,7 % случаев предпочитали введение золедроновой кислоты один раз в год, чем применение пероральных форм БФ в режиме 1 таблетка в неделю. При этом 9 % пациентов высказались в пользу приема таблетированных форм БФ [33].
Среди специфических серьезных нежелательных явлений, зарегистрированных при применении внутривенных форм БФ, наиболее часто обсуждаются фибрилляция предсердий, атипичный (подвертельный) перелом бедра, остеонекроз нижней челюсти и поражение верхних отделов желудочно-кишечного тракта (преимущественно пищевода). У людей старшего возраста наиболее актуальным побочным эффектом является фибрилляция предсердий, которая регистрировалась в исследовании HORIZON-PFT в 1,3 % случаев среди пациентов, получавших золедроновую кислоту, и только в 0,5 % в группе плацебо (р < 0,001). При этом не было выявлено какой-либо хронологической связи между самой инфузией препарата, его фармакокинетическим профилем и фибрилляцией предсердий. Практически все женщины имели признаки синдрома слабости синусового узла до начала лечения. По показателям, включившим сердечно-сосудистую смерть, инсульты и другие сердечно-сосудистые негативные явления, исключая все варианты аритмий, группы сравнения не различались. Однако любые аритмии, зарегистрированные на ЭКГ, встречались чаще, чем в группе плацебо (6,9 против 5,3 %; р = 0,003). Было установлено, что фибрилляция желудочков имела место несколько чаще среди пациентов старше 85 лет [34].
Для людей старшего возраста с низкой МПК (остеопенией), получающих глюкокортикостероиды, а также с диагностированным ОП БФ остаются препаратом выбора как для мужчин, так и для женщин. Золедроновая кислота может считаться альтернативой пероральным формам БФ в случаях наличия или развития эзофагита, пептической язвы желудка или обострения других заболеваний желудочно-кишечного тракта. Возможно применение золедроновой кислоты в качестве первого антиостеопоротического препарата по желанию пациента. При наличии факторов, обусловливающих низкую приверженность пациента, золедроновая кислота может рассматриваться как приоритетное лекарственное средство.


