Введение
Фибрилляция предcердий (ФП) в глобальных масштабах представляет собой наиболее часто встречающееся нарушение ритма сердца [1]. Так, согласно данным европейских экспертов [2], в мире ФП страдают 20,9 млн мужчин и 12,6 млн женщин, а по прогнозам, к 2030 г. в странах Европейского Союза общее число пациентов с этим нарушением ритма может увеличиться на 14–17 млн человек с дебютом 120–215 тыс. новых случаев в год. По оценкам, среди населения Европы и США ФП разовьется у одного из четырех человек [2]. Распространенность ФП среди лиц старше 20 лет составляет 3%, и эта цифра существенно растет по мере увеличения возраста пациентов, а также по мере роста числа коморбидных состояний, таких как ишемическая болезнь сердца (ИБС), хроническая сердечная недостаточность (ХСН), артериальная гипертензия (АГ), клапанные поражения сердца, хроническая болезнь почек (ХБП), ожирение и сахарный диабет [2]. Так, по данным исследования глобального бремени болезней (Global Burden of Disease) [3], среди мужчин распространенность ФП на 100 тыс. человек в возрастной группе старше 35 лет составляет 1307,4, в группе 60–64 года увеличивается до 1636,6, в группе 70–74 года достигает 3688,7 и, наконец среди лиц мужского пола старше 80 лет возрастает до 8189,5. Аналогичные закономерности характерны и для женщин [3]. Что касается коморбидной патологии, то у пациентов 65 лет и старше в 84,5% случаев ФП ассоциируется с АГ, в 63,5% – с ИБС, в 50,9% – с ХСН, в 34,4% – с ХБП [4].
Следует отметить, что тесная взаимосвязь роста встречаемости ФП с наличием сопутствующих заболеваний и увеличением возраста больных абсолютно логична, поскольку, с одной стороны, возраст служит фактором риска полиморбидности, с другой – изначальное наличие какого-либо заболевания (в т.ч. сердечно-сосудистой системы) повышает вероятность присоединения сочетанной патологии (в т.ч. ФП) [4]. Кроме того, необходимо учитывать общемировую тенденцию к постарению населения, что еще больше актуализирует проблему ведения полиморбидных пациентов.
Вопросы полиморбидности/коморбидности в настоящее время – весьма актуальная тема, что находит свое отражение в увеличении числа разделов в международных клинических рекомендациях, посвященных особенностям терапии того или иного заболевания в условиях сочетанной патологии. Говоря о значимости коморбидных состояний у больных кардиологического профиля для отечественного здравоохранения, следует напомнить, что в 2019 г. вышла в свет уже вторая редакция Алгоритмов диагностики и лечения коморбидной патологии в клинической практике [4], в которой 4 раздела из 14 так или иначе посвящены сердечно-сосудистой коморбидности, а также присутствует отдельный раздел, в котором рассматриваются исключительно нарушения ритма сердца (в т.ч. и ФП). В документе подчеркивается, что сердечно-сосудистая коморбидность наблюдается у 65–90% пациентов, имеющих несколько одновременно сосуществующих заболеваний, т.е. по сути занимает здесь ведущие позиции и в дополнение к этому существенно отягощает в целом общее состояние больного, ухудшает прогноз, а также затрудняет выбор наиболее рациональной и эффективной схемы лечения [4].
Термин «коморбидность» произошел от латинского «со» – вместе+«morbus» – «болезнь». Исторически H.C. Kraemer (1995) [5] и M. van den Akker (1996) [6] определили коморбидность как сочетание у одного больного двух и/или более хронических заболеваний, патогенетически связанных между собой или совпадающих по времени у одного пациента вне зависимости от активности каждого из них. Принципиальным в этом понятии является наличие единого патогенетического механизма, объединяющего наличие нескольких хронических заболеваний у одного пациента. В настоящее время некоторые авторы по-прежнему трактуют комборбидность именно так и противопоставляют этому термину другой термин – «мультиморбидность», когда у одного и того же пациента имеет место наличие множественных заболеваний, не связанных между собой доказанными на настоящий момент патогенетическими механизмами [7]. Существует и другая точка зрения: мультиморбидность есть сочетание множества хронических или острых болезней и медицинских состояний у одного человека, при этом не делается акцента на единство или разность их патогенеза [8]. Следует отметить, что в развитых странах свыше половины населения старших возрастных групп имеют три и более заболеваний и у не менее чем 20% пациентов наблюдается мультиморбидность [9]. В клинической практике используется также термин «полиморбидность». Под полиморбидностью, как правило, подразумевается наличие у пациента нескольких синхронно протекающих заболеваний в различных фазах и стадиях их развития, как связанных, так и не связанных между собой патогенетически [4, 10] .
Важно также отметить, что в условиях коморбидности меняются принципы ведения пациента: на место болезнь-ориентированного подхода, ставящего во главу угла конкретное заболевание, должен приходить пациент-ориентированный подход, который в настоящее время активно разрабатывается и совершенствуется [4]. Пациент-ориентированный подход особенно актуален для пациента пожилого возраста с сочетанной патологией. Данный подход учитывает не столько сумму хронических заболеваний у больного, сколько его функциональную и когнитивную сохранность, зависимость от посторонней помощи, качество жизни. При решении вопроса о назначении терапии при применении этого подхода должны учитываться предпочтения, приоритеты и жизненные ориентиры пациента [4].
Принципы фармакотерапии для пациентов пожилого возраста с коморбидностью отличаются от стандартных подходов, и эти отличия подразумевают не только особенности дозирования лекарственных средств, связанные с возрастом и функцией почек и печени [4]. Цель медикаментозного лечения таких пациентов заключается в улучшении качества жизни за счет уменьшения выраженности симптомов и контроля заболевания в краткосрочной перспективе. Практический подход к назначению препаратов таким пациентам подразумевает выделение приоритетного заболевания, лечение которого в данный момент времени позволит улучшить функциональный статус, качество жизни пациента и прогноз его здоровья. Главные принципы лечения полиморбидного пациента пожилого возраста состоят [4] в применении минимального количества лекарств для лечения множества заболеваний; выборе лекарств с учетом цель-ориентированного подхода с возможно широким спектром влияния на общие механизмы патогенеза заболеваний. В случае необходимости приема комбинаций следует проводить учет взаимодействия и результатов клинических исследований комбинированной терапии. Полиморбидность меняет и требования к подбору лекарственных препаратов. В такой ситуации необходимо определение общих механизмов течения заболеваний и подбор минимального количества лекарств с максимально обоснованным механизмом действия [4].
Прогностически неблагоприятная роль ФП как предиктора инсульта, повышения общей смертности (среди мужчин в 2 раза, среди женщин в 1,5), дисфункции левого желудочка и сердечной недостаточности, развития когнитивных нарушений/деменции и в целом снижения качества жизни подчеркивает важность оптимизации принципов ведения коморбидных пациентов с ФП, в первую очередь оценки эффективности и безопасности применения ими оральных антикоагулятнов (ОАК) как основополагающего направления в лечении больных с этим нарушением ритма сердца [2]. Следует отметить, что, к сожалению, как следует из эпидемиологических данных, до настоящего времени встречаются ситуации, когда оральная антикоагулянтная терапия не назначается пациентам с ФП, в частности с впервые выявленной ее формой [11]. Это было показано, в частности, в многоцентровом проспективном регистровом исследовании [11] по изучению частоты встречаемости пациентов с впервые выявленной ФП и особенностей их ведения по сравнению с больными, у которых ФП имелась в анамнезе.
В итоговый анализ вошли 2677 пациентов (средний возраст – 69,1 года, 55,5% мужчин), из них 23,6% имели впервые выявленную ФП. Из сопутствующих заболеваний 50,2% участников исследования имели ХСН или фракцию выброса (ФВ) левого желудочка менее 40%, АГ встречалась у 79,2% лиц, сахарный диабет – у 25,0%, ИБС – у 30,4%, ХБП – у 15,4%, инсульт/транзиторная ишемическая атака в анамнезе – у 14,4% (риc. 1) [11, 12].
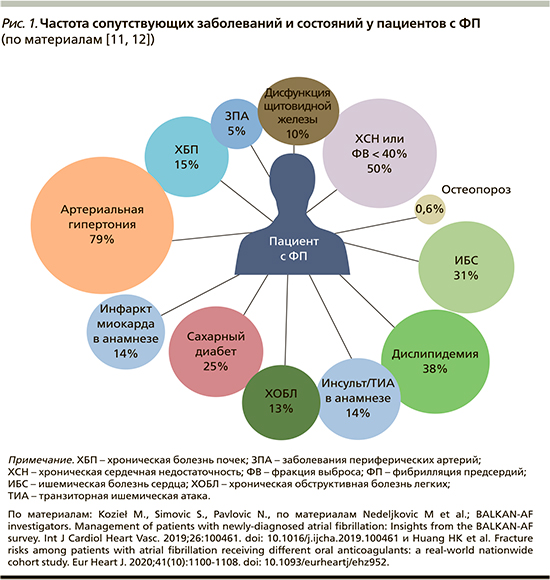
Авторы обнаружили, что пациентов с впервые выявленной ФП по сравнению с больными, уже имевшими в анамнезе эту аритмию, чаще госпитализировали (соответственно 58,5 и 47,7%), они чаще получали антитромбоцитарную монотерапию (19,0 и 9,8%), а также им реже назначали ОАК (59,6 и 77,7%; р<0,001 во всех случаях). Кроме того, как следует из результатов анализа регистра, предиктором назначения антикоагулянтов в т.ч. являлся ряд коморбидных заболеваваний, в частности наличие АГ, дилатационной кардиомиопатии и поражений митрального клапана.
На сегодняшний день в большинстве международных клинических рекомендаций [2, 13] подчеркивается приоритетность назначения прямых оральных антикоагулянтов (ПОАК), а не антагонистов витамина К (АВК) пациентам с ФП (разумеется, в отсутствие у больного противопоказаний к применению ПОАК). Одним из представителей ПОАК является апиксабан, уже доказавший свои преимущества у пациентов с ФП и имеющий собственную доказательную базу клинической эффективности и безопасности [14–18]. Далее нам бы хотелось рассмотреть возможности применения апиксабана пациентами с ФП в условиях коморбидности, поскольку, как следует из представленных выше данных, этот вопрос крайне актуален для современного здравоохранения.
Выбор антикоагулянтной терапии пациентов с ФП и ИБС
Одним из важных коморбидных состояний у пациентов с ФП является ИБС, встречающаяся, по различным эпидемиологическим данным, у 36,5–40,2% пациентов [14, 19]. ФП также повышает риск развития ИМ. Это было показано в мета-анализе V. Ruddox et al. [20], в который вошли 18 когортных исследований, объединивших в общей сложности 220 928 пациентов (медиана возраста – 63 года, 59% мужчин, средний период наблюдения – 4,9 года), из которых 17,5% имели ФП. Исходно ИБС имела место у пациентов в 8 исследованиях. Как было установлено авторами, наличие ФП увеличивает риск развития ИМ более чем в 1,5 раза (относительный риск [ОР]=1,54; 95% доверительный интервал [ДИ] –1,26–1,85).
Необходимо отметить, что преимущества применения ПОАК для пациентов с ФП и стабильной ИБС закреплены и на уровне международных клинических рекомендаций. В частности, в Европейских рекомендациях по ведению больных хроническими коронарными синдромами 2019 г. [13] в разделе, посвященном антитромботической терапии лиц с ФП, перенесших чрескожное коронарное вмешательство (ЧКВ), обращается внимание на предпочтительность выбора ПОАК, а не АВК (рекомендации IA-класса), с дополнительным указанием на то, что в условиях повышенного риска кровотечений нет необходимости в снижении дозы апиксабана, в то время как для других представителей класса такое снижение дозы требуется.
Высокая эффективность и безопасность применения апиксабана пациентами с ИБС и ФП, не отличавшиеся от таковой в общей популяции, была доказана в ряде работ. Заслуживает внимания субанализ [21] опорного двойного слепого рандомизированного плацебо-контролируемого исследования III фазы ARISTOTLE (Apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation) [14], посвященного изучению эффектов апиксабана по сравнению с варфарином у пациентов с наличием/отсутствием ИБС.
В рамках субанализа сформирована когорта пациентов с ИБС (n=6639; средний возраст – 70 лет; 29,8% женщин). Критерии включения в данную группу: наличие в анамнезе диагноза ИБС, перенесенного ИМ и/или реваскуляризации миокарда на момент рандомизации. Больные ИБС по сравнению с группой без такового заболевания чаще имели мужской пол, инсульт в анамнезе, АГ, сахарный диабет и чаще принимали ацетилсалициловую кислоту (АСК). Первичной конечной точкой в рассматриваемом субанализе, как и в целом в исследовании ARISTOTLE, по критерию «эффективность» являлось развитие инсульта или тромбоэмболических осложнений, по критерию «безопасность» – массивные кровотечения. В результате было установлено, что терапия апиксабаном ассоциируется со снижением частоты развития инсульта или системных эмболических событий, общей смертности и ИМ как у пациентов с ИБС, так и без нее (р для взаимодействия равны 0,12; 0,28; 0,45 соответственно). В группах больных ИБС и без таковой также статистически значимо не различалось влияние апиксабана на снижение риска инсульта и эмболических осложнений (соответственно ОР=0,95, 95% ДИ – 0,71–1,27 и ОР=0,70, 95% ДИ – 0,56–0,89; р=0,11) и общую смертность (соответственно ОР=0,96, 95% ДИ – 0,81–1,13 и ОР=0,85, 95% ДИ – 0,73–0,98; р=0,28). Сходным образом лечение апиксабаном ассоциировалось со снижением частоты массивных кровотечений (р=0,17) и внутричерепных кровоизлияний вне зависимости от наличия ИБС (р=0,59).
Еще одной работой, доказавшей эффективность апиксабана в отношении пациентов с ИБС, стало исследование AUGUSTUS (An Open-label, 2 x 2 Factorial, Randomized Controlled, Clinical Trial to Evaluate the Safety of Apixaban vs. Vitamin K Antagonist and Aspirin vs. Aspirin Placebo in Patients With Atrial Fibrillation and Acute Coronary Syndrome or Percutaneous Coronary Intervention) [16, 17]. Его первичной целью служил сравнительный анализ по критерию «не хуже» терапии апиксабаном и АВК (целевой уровень МНО – 2,0–3,0) в отношении составной конечной точки из массивных и клинически незначимых кровотечений у пациентов с ФП в сочетании с острым коронарным синдромом и/или с наличием необходимости проведения ЧКВ и кому планировалось назначение ингибиторов P2Y12-рецепторов тромбоцитов не менее чем на 6 месяцев. Вторая цель состояла в оценке потенциального превосходства применения антикоагулянтов вместе с однокомпонентной антитромбоцитарной терапией в виде ингибиторов P2Y12-рецепторов как минимум в течение 6 месяцев по сравнению со схемой антикоагулянт в сочетании с двойной антиагрегантной терапией (комбинация ингибиторов P2Y12 с АСК) по влиянию на ту же составную конечную точку. В AUGUSTUS были включены 4614 пациентов из 33 стран (медиана возраста – 70,7 года; 29% женщин; средний балл по шкале CHA2DS2-VASc –3,9±1,6, по шкале HAS-BLED – 2,9±0,9), из них 88,3% имели сопутствующую АГ, 42,8% – сердечную недостаточность, 36,4% – сахарный диабет, 13,8% перенесли в анамнезе инсульт/транзиторную ишемическую атаку или системные тромбоэмболические осложнения. Период наблюдения равнялся 6 месяцам плюс еще один дополнительный визит после завершения исследования на 7-м месяце для анализа исходов на фоне перевода пациентов на общепринятую в том или ином региональном центре терапию.
В AUGUSTUS апиксабан назначался по 5 мг дважды в сутки. При наличии как минимум 2 из 3 указанных выше при описании исследования ARISTOTLE критериев доза уменьшалась до 2,5 мг 2 раза в сутки; 90,0% больных в группе апиксабана получали данный ПОАК в полной дозе. В результате исследования установлено, что комбинированная конечная точка по кровотечениям возникла у 10,5% пациентов в группе апиксабана и у 14,7% лиц в группе АВК, а на фоне приема этого ПОАК она наступала статистически значимо реже на 100 пациенто-лет (ОР=0,69, 95% ДИ – 0,58–0,91; р<0,001, как по критерию «не хуже», так и по критерию «лучше») (рис. 2). Аналогичным образом при терапии апиксабаном по сравнению с варфарином статистически значимо реже имели место летальные исходы и случаи госпитализации больных: соответственно, 23,5 против 27,4% (ОР=0,83, 95% ДИ – 0,74–0,93; р=0,002). Частота инсульта на 100 пациенто-лет была также меньше в группе апиксабана (1,2 против 2,4% в группе варфарина; ОР=0,50, 95% ДИ – 0,26–0,97).

Эффективность и безопасность апиксабана по сравнению с варфарином и с прочими ПОАК, в т.ч. для пациентов с ИБС, были также подтверждены в псевдорандомизированном ретроспективном наблюдательном когортном исследовании ARISTOPHANES (Anticoagulants for Reduction in Stroke: Observational Pooled Analysis on Health Outcomes and Experience of Patients) [18]. Целью работы стало изучение эффектов ПОАК (апиксабана, дабигатрана, ривароксабана) и варфарина для пациентов с неклапанной ФП.
В исследование вошли сведения из баз данных центров США по предоставлению медицинской помощи пожилым, малоимущим и лицам с ограниченными возможностями, а также сведения из четырех баз дополнительного медицинского страхования (MarketScan, PharMetrics, Optum и Humana). Критериями включения служили наличие у пациента как минимум одной записи о назначении впервые за 12 месяцев апиксабана или дабигатрана, или ривароксабана, или варфарина с 1 января 2013 по 30 сентября 2015 г., а также факт диагностированной ФП на момент выписывания антикоагулянта либо до него. Также больному должен быть доступен полный набор сведений о состоянии здоровья и проводимом лечении на протяжении как минимум 12 месяцев до включения в работу. Из исследования исключались лица, уже получавшие антикоагулянты в период 12 месяцев до даты потенциального вхождения в анализ, лица с клапанными пороками сердца, тромбоэмболическими осложнениями, симптоматической (преходящей) ФП, связанной с вторичными причинами (перикардит, гипертиреоз и тиреотоксикоз), перенесшие кардиохирургические вмешательства/трансплантацию сердца в течение 12 месяцев до момента назначения антикоагулянта, беременные и пациенты, которым выполнялось оперативное вмешательство по замене коленного/тазобедренного сустава в период 6 недель до планируемой даты включения в исследование. Конечными точками служили время до возникновения первого инсульта/системного тромбоэмболического осложнения и время до дебюта массивного кровотечения (включая желудочно-кишечное и внутричерепные кровоизлияния). После проведения псевдорандомизации общее число составило 434 046 включенных пациентов (средний возраст – 72,8–76,1 года; мужчин – 51,3–57,2%; средний балл по CHA2DS2-VASc – 3,5–3,9; по HAS-BLED – 2,7–3,1). Среди них ИБС имели 40,0–44,9% пациентов, заболевания периферических артерий – 15,9–19,6%, ХСН – 23,9–28,7%, ХБП – 16,3–23,9%. Медиана периода наблюдения равнялась 123–159 дням. В результате установлено, что апиксабан имеет преимущества над варфарином в группах с ИБС и без таковой как в снижении риска развития инсульта/тромбоэмболических событий (соответственно ОР=0,65, 95% ДИ – 0,57–0,73 и ОР=0,62, 95% ДИ – 0,54–0,71), так и в уменьшении риска возникновения массивных кровотечений (соответственно ОР=0,58, 95% ДИ – 0,54–0,63 и ОР=0,61, 95% ДИ – 0,56–0,66). Помимо этого аналогичные преимущества апиксабана были продемонстрированы при сравнении его с другими ПОАК также в подгруппах пациентов с ИБС и без нее. По конечной точке «инсульт/системные эмболические осложнения» по сравнению с дабигатраном снижение риска на фоне применения апиксабана составило 24% для пациентов с ИБС (ОР=0,76, 95% ДИ – 0,60–0,96) и 34% для пациентов без ИБС (ОР=0,66, 95% ДИ – 0,51–0,86); по сравнению с ривароксабаном аналогичные показатели составили 15% соответственно (ОР=0,85, 95% ДИ – 0,75–0,97) и 25% (ОР=0,75, 95% ДИ – 0,65–0,86). По конечной точке «массивные кровотечения» по сравнению с дабигатраном снижение риска на фоне терапии апиксабаном пациентов с ИБС составило 19% (ОР=0,81, 95% ДИ – 0,70–0,93), больных без ИБС – 26% (ОР=0,74, 95% ДИ – 0,63–0,87); по сравнению с ривароксабаном те же показатели равнялись 45% (ОР=0,55, 95% ДИ – 0,51–0,59) и 46% (ОР=0,56, 95% ДИ – 0,51–0,61) соответственно.
Выбор антикоагулянтной терапии пациентов с ФП и ХСН
Еще одним часто сосусществующим с ФП состоянием является ХСН [22]. Распространенность СН среди пациентов с неклапанным вариантом ФП составляет 27–64% по данным рандомизированных контролируемых исследований и 21–48% по данным исследований реальной клинической практики [2, 22]. Что касается применения апиксабана, то его преимущества для пациентов с ФП и сопутствующей ХСН на сегодняшний день также доказаны.
Здесь заслуживает внимания ретроспективное наблюдательное исследование реальной клинической практики на основе базы данных медицинского страхования Medicare США с применением метода псевдорандомизации, проведенное A. Amin et al. [22]. Целью данной работы являлся сравнительный анализ профиля эффективности и безопасности применения ПОАК (апиксабана, дабигатрана, ривароксабана) и варфарина пациентами с неклапанной ФП в сочетании с ХСН. В исследование включались больные в возрасте 65 лет и старше с наличием ≥1 записи о назначении апиксабана, дабигатрана, ривароксабана или варфарина в период с 1 января 2013 по 31 сентября 2015 г., имевшие ФП в сочетании с ХСН, которые должны были быть диагностированы в течение 12 месяцев до включения в исследование. Кроме того, от всех пациентов требовалось наличие информации о состоянии здоровья и медикаментозных назначениях за период ≥12 месяцев до включения в исследование. Критериями невключения служили поражения клапанного аппарата сердца, тромбоэмболические события в анамнезе, транзиторный характер ФП (в силу известных вторичных причин), кардиохирургические вмешательства и/или прием антикоагулянтов в течение предшествовавших 12 месяцев, беременность, операции по замене коленного/тазобедренного сустава на протяжении 6 месяцев до потенциальной даты начала участия в работе. Пациенты наблюдались до одного из следующих событий (того, которое возникало первым): в течение 30 дней после прерывания лечения, изменения терапии, смерти, прекращения регистрации дальнейших данных о состоянии здоровья, завершения исследования. В качестве конечных точек рассматривались инсульт (ишемический и геморрагический)/системные эмболические осложнения, массивные кровотечения и основные неблагоприятные сердечные события: инфаркт миокарда (ИМ), инсульт, общая смертность. Исходно были отобраны данные 63 206 пациентов (средний возраст – 78,7–80,4 года, 46,1–49,2% – мужчины), из них 16,8% получали апиксабан, 6,8% – дабигатран, 25,2% – ривароксабан, 51,2% – варфарин. Индекс коморбиндности по Charlson составил 5,2–5,7, средний балл по шкале CHAD2DS2VASc – 5,2–5,4.
В результате исследования установлено, что по сравнению с варфарином только апиксабан из трех изучаемых ПОАК благоприятно и статистически значимо влиял на все конечные точки: его применение ассоциировалось с меньшей частотой инсульта/системных эмболических событий (ОР=0,64, 95% ДИ – 0,48–0,85), массивных кровотечений (ОР=0,66, 95% ДИ – 0,58–0,76) и основных неблагоприятных сердечных событий (ОР=0,73, 95% ДИ – 0,67–0,79). В отличие от этого в группах дабигатрана и ривароксабана по сравнению с терапией варфарином наблюдалось снижение частоты основных неблагоприятных сердечных событий (соответственно ОР=0,87, 95% ДИ – 0,77–0,99 и ОР=0,84, 95% ДИ – 0,79–0,89). В группе ривароксабана по сравнению с пациентами, получавшими варфарин, наблюдалось также снижение риска инсульта/системных эмболических событий (ОР=0,65, 95% ДИ – 0,52–0,82), но в то же время отмечалась более высокая частота массивных кровотечений (ОР=1,18, 95% ДИ – 1,08–1,30).
В дополнение в группе апиксабана по сравнению с лечением дабигатраном и ривароксабаном отмечался статистически значимо меньший риск массивных кровотечений (соответственно ОР=0,71, 95% ДИ – 0,57–0,89 и ОР=0,55, 95% ДИ – 0,49–0,63) и основных неблагоприятных сердечных событий (соответственно ОР=0,80, 95% ДИ – 0,69–0,93 и ОР=0,86, 95% ДИ – 0,79–0,94).
Выбор антикоагулянтной терапии пациентов с ФП и ХБП
Другим независимо взаимосвязанным с ФП коморбидным состоянием является ХБП [2]. Так, пациенты с ФП имеют наибольший риск развития ХБП 4–5-й стадий: отношение шансов (ОШ) – 3,52; для ХБП 1–2-й стадий риск возникновения несколько меньше, ОШ составляет 2,67; для ХБП 3-й стадии ОШ=1,68 [2]. В свою очередь, как показано в мета-анализе J.B. Olesen et al. [23], объединившем в общей сложности 132 372 пациента с ФП (из них 3587 человек имели ХБП, не достигшей терминальной стадии, и еще 901 больной нуждался в трансплантации почек), наличие сопутствующей ХБП у пациентов с ФП служит предиктором возникновения инсульта/системных эмболических событий (ОР=1,49–1,83), массивных кровотечений (ОР=2,24–2,70) и роста общей смертности (ОР=2,37–3,35).
В связи с этим заслуживает внимания субанализ [24] рассмотренного выше исследования ARISTOTLE [14], в котором проводился сравнительный анализ влияния апиксабана и варфарина на частоту инсульта и системных эмболических событий (конечная точка по критерию «эффективность»), а также на риск развития массивных кровотечений (конечная точка по критерию «безопасность») в зависимости от функционального состояния почечного аппарата. У всех пациентов исходно была рассчитана скорость клубочковой фильтрации (СКФ) по трем формулам: Кокрофта–Голта, CKD–EPI (Chronic Kidney Disease Epidemiology Collaboration), а также с учетом уровня цистатина С. Согласно методике анализа функционального состояния почек по Кокрофту–Голту, всех пациентов разделили на три группы: с СКФ>80 мл/мин (n=7518; 42%), с СКФ в диапазоне >50 и менее 80 мл/мин (n=7587; 42%) и с СКФ≤50 мл/мин (n=3015). Установлено, что частота неблагоприятных сердечно-сосудистых событий (инсульт, общая смертность, массивные кровотечения) имела бoльшие значения среди лиц с СКФ по Кокрофту–Голту ниже 80 мл/мин. Апиксабан демонстрировал бoльшую, чем варфарин, эффективность в профилактике развития инсульта, системных эмболических осложнений и ассоциировался с меньшей частотой возникновения массивных кровотечений вне зависимости от функции почечного аппарата. И эти закономерности оставались неизменными при любом из трех методов расчета СКФ.
Столь высокая эффективность апиксабана у пациентов, в т.ч. с ХБП, нашла свое отражение в клинических рекомендация. В частности, в согласительном документе по выбору ОАК для профилактики инсульта при ФП у отдельных групп пациентов, опубликованном под эгидой Европейского кардиологического общества в 2017 г. [25], указано, что при сочетании ФП с ХБП 3-й стадии (клиренс креатинина – 30–49 мл/мин) ПОАК первой линии являются апиксабан 5 мг 2 раза в сутки (со снижением дозы до 2,5 мг 2 раза в сутки при наличии двух и более критериев из следующих: возраст ≥80 лет, масса тела ≤60 кг, креатинин сыворотки ≥1,5 мг/дл), ривароксабан 15 мг 1 раз в сутки или эдоксабан 30 мг 1 раз в сутки.
Выбор антикоагулянтной терапии пациентов с ФП и высоким риском желудочно-кишечных кровотечений
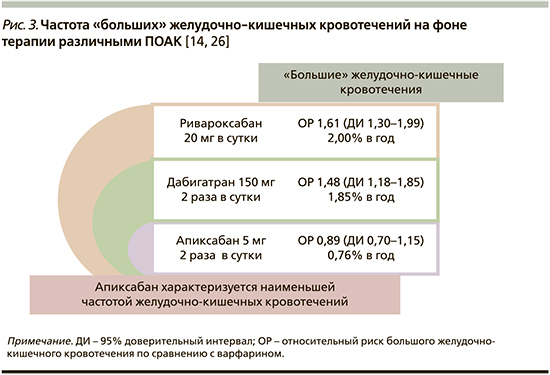
Еще одним важным вопросом при выборе ПОАК для пациентов с ФП, получающих антикоагулянтную терапию, является риск возникновения желудочно-кишечных кровотечений, поскольку, с одной стороны, определенная доля пациентов имеют известные коморбидные состояния, связанные с поражением слизистой оболочки желудочно-кишечного тракта (ЖКТ), с другой (что представляется не менее, а возможно, даже более важным) – ряд больных не знают о существовании субклинических изменений слизистой оболочки желудка и кишечника (например, эрозий), которые могут протекать без значимого симптомокомплекса, но существенно повышают риск кровотечений, в т.ч. массивных, на фоне использования препаратов, влияющих на звенья гемостаза. Рассматривая риск кровотечений из ЖКТ на фоне использования тех или иных ПОАК, необходимо отметить, что к настоящему времени прямых сравнительных исследований между различными представителями препаратов этого класса не проводилось. Вместе с тем, опираясь на результаты клинических исследований III фазы, можно сказать, что в стандартной дозе (5 мг 2 раза в сутки) только апиксабан не повышает риска кровотечений (ОР=0,89; 95% ДИ – 0,70–1,15) [14, 26], тогда как для дабигатрана (150 мг 2 раза в сутки) ОР=1,48 (95% ДИ – 1,18–1,85) [26], а для ривароксабана ОР=1,61 (95% ДИ – 1,30–1,99) [26] (рис. 3).
Апиксабан также обладает доказательной базой того, что имеет профиль безопасности в отношении развития массивных кровотечений (в т.ч. из ЖКТ) не хуже, чем у АСК, но в отличие от нее обеспечивает статистически значимо лучшую защиту для пациентов с ФП от инсульта и системных эмболических событий [15].
В связи с этим необходимо привести результаты двойного слепого исследования AVERROES (Apixaban Versus Acetylsalicylic Acid to Prevent Stroke in Atrial Fibrillation Patients Who Have Failed or are Unsuitable for Vitamin K Antagonist Treatment) [15], в котором у пациентов (n=5599; средний возраст – 70 лет; 58–59% мужчин; средний балл по шкале CHADS2=2,0–2,1) с перманентной или пароксизмальной формой ФП и наличием по крайней мере одного из дополнительных факторов риска инсульта изучалось влияние апиксабана по сравнению с АСК 81–324 мг/сут на частоту развития инсульта/системных тромбоэмболических осложнений и массивных кровотечений. Исследование прекратили досрочно (медиана фактического периода наблюдения – 1,1 года) после промежуточного анализа данных в силу явных преимуществ лечения апиксабаном. Было установлено, что инсульт/системные эмболические осложнения в группе апиксабана возникали статистически значимо реже по сравнению с терапией АСК (1,6 и 3,7% в год соответственно; ОР=0,45, 95% ДИ – 0,32–0,62; р<0,001). Кроме того, частота массивных кровотечений в группе апиксабана не отличалась от таковой в группе АСК (1,4 и 1,2% в год соответственно; ОР=1,13, 95% ДИ – 0,74–1,75; р=0,57).
Подтверждением оптимального профиля безопасности апиксабана в фокусе развития кровотечений из ЖКТ является его включение в Отчет подкомитета Американской академии неврологии по доказательной базе обновлений руководства «Профилактика инсульта при неклапанной ФП» [27]. В нем, в частности, указано, что апиксабан может быть назначен пациентам с неклапанной ФП и повышенным риском желудочно-кишечного кровотечения, которым требуется антикоагулянтная терапия (уровень рекомендаций – C) [27]. Сходным образом в уже процитированном выше согласительном документе по выбору ОАК для профилактики инсульта при ФП у отдельных групп пациентов, опубликованном под эгидой Европейского кардиологического общества 2017 г. [25], записано, что у пациентов с высоким риском желудочно-кишечного кровотечения в качестве ПОАК первой линии может быть использован в т.ч.¬ апиксабан в дозе 5 мг 2 раза в сутки.
Выбор антикоагулянтной терапии пациентов с остеопорозом/высоким риском переломов костей
На сегодняшний день накапливается все больше сведений о взаимосвязи ФП и применения отдельных типов антикоагулянтов с повышенным риском переломов костей и снижением минеральной плотности костной такни, что клинически значимо в принципе и особенно важно для пожилых пациентов, которые, с одной стороны, как указано в начале обзоре, имеют потенциально большее бремя коморбидных состояний, с другой – склонны к таким возраст-ассоциированным явлениям, как падение [4]. Кроме того, известно, что пациенты, принимающие бисфосфонаты, имеют почти в 2 раза больший риск развития ФП (ОШ=1,78, 95% ДИ – 1,46–2,16) [28], а наличие ФП у пациентов с остеопорозом служит независимым фактором риска переломов костей (ОР=1,24, 95% ДИ – 1,05–1,46; p=0,010) [29].
Заслуживает внимания ретроспективное когортное исследование с использованием метода псевдорандомизации, проведенное H.K. Huang et al. [30], в котором изучался риск остеопороза у пациентов с ФП, принимающих ПОАК или варфарин. Анализировалась национальная база данных медицинского страхования Тайваня. В работу включались мужчины и женщины в возрасте ≥20 лет с впервые выявленной ФП (причем диагноз ФП должен был быть зафиксирован по крайней мере однократно в условиях стационара и/или не менее 2 раз в амбулаторных условиях), принимавшие варфарин или ПОАК (ривароксабан, апиксабан, дабигатран) в течение не менее 90 дней после диагностирования ФП. В работу не входили больные, у которых ФП была выявлена до 2012 г., принимавшие в период ≥90 дней варфарин и ПОАК или с наличием назначений различных ПОАК в течение этого времени, находившиеся на антикоагулянтной терапии до момента диагностирования ФП, а также имевшие ранее диагностированный остеопороз. Первичной конечной точкой служила частота случаев впервые выявленного остеопороза, который диагностировался, согласно рекомендациям Тайваньской ассоциации остеопороза, в виде значения Т-критерия минеральной плотности костной ткани ≤2,5 или по анамнестическим данным о факте низкоэнергетических переломов. Пациенты наблюдались от момента назначения антикоагулянтной терапии либо до возникновения первичной конечной точки, либо до момента смерти, либо до 31 декабря 2016 г. в зависимости от того, какое из событий наступало раньше. После псевдорандомизации в исследование вошли 17 008 пациентов (средний возраст около 71 года; 59–60% мужчин; среднее значение индекса коморбидности по Charlson – 4,1–4,2; средний балл по CHA2DS2-VASc – 2,4–2,5), из них переломы костей в анамнезе имели место приблизительно у 11% лиц. В результате установлено, что на фоне применения ПОАК риск остеопороза ниже по сравнению с терапией варфарином (скорректированное ОР=0,82, 95% ДИ – 0,55–0,83), причем такая взаимосвязь становилась сильнее по мере увеличения сроков лечения. Кроме того, как установили авторы, статистически значимо меньший риск остеопороза наблюдался в группе апиксабана (ОР=0,38; 95% ДИ – 0,22–0,66) и ривароксабана (ОР=0,68; 95% ДИ – 0,55–0,83), но не на фоне применения дабигатрана (ОР=1,04; 95% ДИ – 0,85–1,27).
В рамках еще одного национального когортного исследования реальной клинической практики [12] изучался риск переломов костей среди пациентов, получавших различные антикоагулянты. Работа также представляла собой ретроспективное национальное исследование с использованием метода псевдорандомизации. Анализировалась национальная база данных медицинского страхования Тайваня. В исследование включались мужчины и женщины в возрасте ≥20 лет с впервые диагностированной в период с 2012 по 2016 г. ФП, причем диагноз должен был быть зарегистрирован при выписке из стационара или не менее 2 раз в амбулаторных условиях. Пациенты должны были принимать варфарин или ПОАК (ривароксабан, апиксабан, дабигатран) в течение не менее 90 дней после установления диагноза ФП, а дата включения в исследование представляла собой 91-й день терапии антикоагулянтами. Основными критериями исключения служили наличие диагноза ФП, установленного до 2012 г., прием в период ≥90 дней варфарина и ПОАК или эпизоды приема различных ПОАК в течение этого времени, или развитие первичной конечной точки до даты включения в исследование. Первичной конечной точкой стали случаи развития новых переломов бедра, позвонков, плечевой кости, предплечья, запястья. Пациенты наблюдались до момента возникновения первичной конечной точки либо до момента смерти, либо до 31 декабря 2016 г. в зависимости от того, какое из событий наступало раньше. После выполнения псевдорандомизации в исследование вошли 19 414 пациентов (средний возраст – 71–72 года; около 59% мужчин; среднее значение индекса коморбидности по Charlson – 1,6; средний балл по CHA2DS2-VASc – 2,7–2,8). Исходно остеопороз встречался у 0,5–0,7% участников исследования. Медиана периода наблюдения составила 2,4 года. Было обнаружено, что применение ПОАК по сравнению с варфарином ассоциируется с меньшим риском переломов (скорректированное ОР=0,84; 95% ДИ – 0,77–0,93; р<0,001). Как показали авторы при субанализе по отдельным препаратам, терапия каждым ПОАК сопровождалась снижением риска переломов: для апиксабана ОР=0,67 (95% ДИ – 0,52–0,87; р=0,003); для ривароксабана ОР=0,81 (95% ДИ – 0,72–0,90; р<0,001); для дабигатрана ОР=0,88 (95% ДИ – 0,78–0,99), т.е. с наиболее благоприятным прогнозом ассоциировалась терапия апиксабаном.
Повышение частоты случаев остеопороза и переломов костей на фоне применения варфарина можно объяснить с точки зрения участия витамина К в процессах остеогенеза и поддержания минеральной плотности ткани [31]. Варфарин же, являясь антагонистом данного витамина, способен потенциально угнетать эти механизмы, в частности снижать К-зависимое карбоксилирование остеокальцина, матриксного Gla-белка, периостина, периостин-подобного фактора в остеобластах с нарушением их активации, снижением тропности к костной ткани, ее деминерализацией и увеличением риска кальцификации сосудов [31]. Также необходимо принимать во внимание непрямые механизмы, связанные, в частности, с особенностями диеты пациентов, получающих варфарин в виде ограничения потребления листовых овощей, в которых содержится филлохинон (витамин К1), сходным образом участвующий в процессах остеогенеза [31].
Заключение
Таким образом, в настоящее время увеличивается число пациентов, имеющих сочетанную патологию, и это явление становится особенно актуальным для заболеваний сердечно-сосудистой системы, особенно по мере увеличения возраста больного. Одним из наиболее распространенных в клинической практике нарушений ритма сердца является ФП, которая также очень часто существует в условиях коморбидности в виде наличия у пациента ИБС, ХСН, ХБП, сахарного диабета и нередко поражений ЖКТ, потенциально способствующих повышению риска жизнеугрожающих кровотечений. Ведущим компонентом в ведении практически всех пациентов с ФП является назначение антикоагулянтной терапии, к которой в ситуации наличия коморбидной патологии предъявляются самые жесткие требования, заключающиеся в оптимальном и сбалансированном профиле антитромботической эффективности и безопасности с точки зрения развития кровотечений. Хорошо известно, что на сегодняшний день все приоритеты в вопросах антикоагуляции отданы ПОАК. Данный класс препаратов включает ряд представителей, различающихся по своей доказательной базе и клиническим эффектам. Среди них одним из наиболее изученных препаратов является апиксабан (Эликвис, Пфайзер Инк; США), доказавший свою эффективность и безопасность в т.ч. в отношении пациентов с ФП в условиях коморбидности, причем, что важно, такие данные были получены как в рандомизированных контролируемых исследованиях, так и в исследованиях реальной клинической практики, благодаря этому апиксабан можно рекомендовать к назначению пациентам с ФП и полиморбидной патологией в качестве ПОАК первого выбора.
Источник финансирования
Статья опубликована при финансовой поддержке компании Пфайзер. В статье выражена позиция автора, которая может отличаться от позиции компании Пфайзер.



