Инфекции мочевыводящих путей (ИМП) остаются проблемой мирового масштаба; лечение и оплата нетрудоспособности пациентов с данными заболеваниями связаны с большими финансовыми затратами. Более чем половина женщин хотя бы раз в жизни страдали от неосложненных ИМП, в подавляющем большинстве – от цистита. При этом частота цистита максимальна в репродуктивном возрасте и значительно снижается после 40 лет [1]. Во время беременности ИМП – одно из наиболее распространенных осложнений, конкурируя по частоте с сердечно-сосудистой патологией, поскольку гестационные физиологические изменения еще более существенно повышают риск развития ИМП.
В подавляющем большинстве случаев ИМП представлены грамотрицательной флорой. Большинство уропатогенных микроорганизмов обитает в кишечнике, перианальной области, в преддверии влагалища и периуретральной области. Специфические вирулентные факторы, которыми обладает уропатогенная флора, способствуют широкому распространению и активизации ИМП. Вирулентные факторы Еscherichia coli и Proteus mirabilis хорошо известны – это синтез аэробактина и энтеробактина (железосвязывающие белки с высоким сродством к железу, необходимому для размножения бактерий, образования гемолизина и экспрессии фимбрий). Уропатогенность микроорганизмов определяется феноменом адгезии грамотрицательных бактерий к уроэпителиальным клеткам благодаря специальным ворсинкам-фимбриям с последующей инвазией в эпителий. Маннозочувствительные фимбрии (тип 1) обнаруживаются у патогенных и непатогенных штаммов Е. coli, в то время как маннозорезистентные фимбрии (Р-фимбрии) выявляются только на уропатогенных микробах. Р-фимбрии называют пиелонефрит-ассоциированными, т.к. они могут специфически прикрепляться к рецепторам эпителия урогенитального тракта и позволяют бактериям подниматься вверх из мочевого пузыря к почкам [2].
Неосложненные ИМП характерны для пациенток с отсутствием аномалий и нормальной функцией мочевыводящих путей. Для большинства таких пациенток инфекция ограничивается локализацией в нижних отделах мочевыводящих путей. Она может протекать как в бессимптомной (асимптоматическая бактериурия), так и в манифестной форме (острый цистит). Распространенность бессимптомной бактериурии, по данным различных исследований, колеблется от 2 до 13 %; манифестные формы инфекции развиваются у 1–2 % беременных женщин [3].
Необходимо дифференцировать бактериурию от контаминации околоуретральной микрофлорой. Количество уропатогенных микроорганизмов, отличающее бактериурию мочевого пузыря от бактериального загрязнения, было установлено в 1960-х гг. [4]. Клинически значимой бактериурией у пациентов без каких-либо симптомов ИМП было принято обнаружение одного и того же вида бактерий в концентрации 105 КОЕ/мл и более в двух посевах средней порции мочи с интервалом в 24 часа. Меньшее количество колоний у женщин с бессимптомной бактериурией было принято считать контаминацией. Однако исследования последних лет показали, что традиционный критерий наличия бактериурии (более или равно 105 КОЕ/мл) обладает высокой специфичностью (0,99), но очень низкой чувствительностью (0,51), в то время как порог, в более или равный 102 КОЕ/мл, является более чувствительным показателем бактериурии мочевого пузыря (0,95), хотя он и менее специфичен (0,85). Фактами, подтверждающими присутствие бактериурии при низком содержании уропатогенных микроорганизмов, являются наличие симптомов ИМП и пиурия, реакция на лечение и характерная вирулентность микроорганизмов. На практике эритроциты и лейкоциты, составляющие мочевой осадок, лизируются при рН мочи > 6, при низкой осмолярности мочи или когда до исследования мочи проходит много времени. Поэтому ложноотрицательные результаты при микроскопии мочи достаточно часты. Многие женщины с клиническими симптомами ИМП считаются неинфицированными согласно традиционному подходу, на самом деле имеют настоящую бактериурию мочевого пузыря либо без, либо с субклинической инфекцией верхних мочевых путей. Поэтому большинство авторов предлагают считать наличие бактерий в концентрации более 103 КОЕ/мл хотя бы в одном образце средней порции мочи беременных с симптомами ИМП в качестве диагностического критерия клинически значимой бактериурии [5, 6].
Одна из наиболее частых ошибок в диагностике ИМП – это недооценка «малой» бактериурии. Во-первых, симптоматическая бактериурия менее 105 КОЕ/мл может отражать начальный этап ИМП, во-вторых, вследствие большого приема жидкости и большого диуреза может наблюдаться низкая бактериурия (бактериурия разведения); в-третьих, низкая бактериурия может быть вызвана медленным ростом некоторых уропатогенных штаммов, таких как Staphylococcus saprophyticus [5].
Установлено, что острый цистит может быть вызван бактериурией, представленной менее чем 105 КОЕ/мл. Нелеченая бактериурия приводит к развитию пиелонефрита в 30–80 % случаев. Кроме того, нелеченая бессимптомная бактериурия способствует преждевременным родам в 11,8 %, перинатальной заболеваемости – в 37,5, внутриутробной патологии мочевыводящей системы плодов – в 20–30 % случаев [7].

Принято различать ИМП в зависимости от уровня вовлечения мочевого тракта, клинической симптоматики и наличия осложнений. Очень важно разграничить ИМП нижнего (уретра, мочевой пузырь) и верхнего (почка) мочевого тракта, поскольку тактика лечения беременных существенно различается.
Ведущим путем инфицирования мочевой системы женщин остается восходящий уриногенный. Однако нельзя исключать и гематогенный путь проникновения инфекции, при котором первичным очагом может быть любой гнойно-воспалительный процесс в организме беременной.
Высокая вирулентнось микрофлоры определяет частое рецидивирование ИМП. Рецидивирующие ИМП возникают у одной из трех женщин после первого эпизода ИМП. Рецидив, требующий вмешательств, обычно определяется как 2 или 3 эпизода в течение 6 месяцев или 3 или более эпизодов за год. Таким пациенткам требуется назначение специальной противорецидивной терапии: применение противомикробных препаратов в низких дозах 1 раз в сутки или посткоитально. Адекватная антибактериальная терапия инфекций нижних отделов мочевыводящих путей беременных позволяет в 75 % случаев предупреждать развитие острого пиелонефрита и даже снижать риск перинатальной смертности [8].
Вместе с тем антимикробная терапия ограничена возрастающей резистентностью к микрофлоре, вызывающей ИМП. Так, за последнее время отмечено возрастание резистентности к фторхинолонам, ранее широко применявшимся при лечении ИМП у небеременных пациенток [9]. При беременности выбор возможных препаратов, безопасных для матери и плода и в то же время обладающих высокой эффективностью, крайне ограничен. Антибактериальная терапия должна проводиться с учетом особенностей фармакокинетики препаратов и их токсического влияния на организм матери и плода.
Антибиотики, рекомендуемые в качестве лечения инфекций нижних мочевыводящих путей беременных, по классификации Администрации по контролю за лекарствами и пищевыми продуктами США (FDA) относятся к категории В и включают ингибитор-защищенные пенициллины, цефалоспорины и фосфомицин [10].
Многочисленными исследованиями показано, что достаточно антибактериальной терапии неосложненной ИМП короткими курсами до 3 дней. Более длительная терапия при лечении острого неосложненного цистита не имеет преимуществ [11, 12]. Препаратом выбора лечения инфекции нижних мочевыводящих путей, не затронувшей почечную паренхиму, служит природный антибиотик фосфомицин.
Фосфомицина трометамол (Монурал) оказывает бактерицидное действие за счет нарушения начальных этапов синтеза клеточной стенки бактерий и антиадгезивного действия (препятствует адгезии уропатогенных штаммов к клеткам уротелия). Преимущества Монурала: отсутствие перекрестной устойчивости с другими антибиотиками, широкий антибактериальный спектр, способность создавать высокие концентрации в моче, длительно сохраняющиеся после однократного приема, что определяет высокую комплаентность препарата (3 г однократно на ночь со стаканом воды) [13].
Многоцентровые исследования последних лет беременных с ИМП показали, что фосфомицин обладает наибольшей активностью в отношении E. coli наряду с фуразидином и нитрофурантоином, чувствительность к которым сохраняется у 97,3 % штаммов; достаточной чувствительностью обладают и пероральные цефалоспорины III поколения. В отношении же всех представителей семейства Enterobacteriaceae активностью более 90 % среди пероральных препаратов обладает только фосфомицин (93,9 %). Активность фуразидина и нитрофурантоина составляет только 88,4 и 81,0 % соответственно [14].
Отмечено, что чувствительность фосфомицина к E. coli и Klebsiella pneumonia составляет соответственно 99,2 и 88 %, а к Klebsiella oxytoca, Proteus spp., Enterobacter sakazakii – 100 %, и такая совокупная чувствительность максимальна по сравнению с ингибиторозащищенными аминопенициллинами, цефалоспоринами, нитрофурантоином и ко-тримоксазолом. Стопроцентная чувствительность фосфомицина отмечена и к Enterococcus faecalis [15]. Многие исследования показывают, что однократное применение фосфомицина беременными с инфекцией нижних мочевыводящих путей так же эффективно, как трехдневные курсы традиционной антибактериальной терапии [16].
Так, не отмечено существенного различия между однократным применением 3 г фосфомицина и 5-дневным курсом цефуроксима – ни в персистенции инфекции, ни в необходимости перехода на другие антибиотики [17]. Отмечено также, что фосфомицин гораздо реже вызывает побочные эффекты у беременных по сравнению с традиционными антибиотиками [18].
Материал и методы
Произведена оценка эффективности лечения инфекций нижних отделов мочевыводящих путей препаратом Монурал 85 беременных во 2-м и 3-м триместрах беременности. По показаниям к назначению Монурала пациентки были разделены на три группы. Группу 1 составили 23 беременных, не имевших в анамнезе ИМП, у которых в посеве мочи выявлен рост уропатогенной флоры ≥ 105 КОЕ/мл. Группу 2 составили 47 беременных, страдавших хроническим циститом и/или хроническим пиелонефритом, без клинических проявлений на момент исследования, но у которых в посеве мочи выявлен рост уропатогенной флоры ≥ 103 КОЕ/мл. Группу 3 составили 15 пациенток, имевших обострение хронического пиелонефрита во время беременности, получивших 5–7-дневный курс антибактериальной терапии ингибиторозащищенными аминопенициллинами или цефалоспоринами. Пациентки первых двух групп получили Монурал однократно в виде 3 г порошка, растворенного в стакане воды, перед сном. Контрольный посев мочи произведен через 7–10 дней. Пациентки третьей группы принимали Монурал 1 раз 10 дней вплоть до родоразрешения под контролем еженедельных общих анализов мочи и посевов мочи 1 раз в месяц.
Бактериологическая эффективность оценивалась по следующим критериям:
- выздоровление (стерильные посевы мочи);
- персистенция инфекции (определение того же возбудителя в моче в концентрации 103 КОЕ/мл и более);
- реинфекция (обнаружение в моче нового вида бактерий в концентрации 103 КОЕ/мл и более).
Результаты и обсуждение
Нами было отмечено, что у пациенток, имевших обострение хронического пиелонефрита при данной беременности, чаще, чем у беременных, не имевших клинических проявлений ИМП во время данной беременности встречались предрасполагающие к ИМП факторы (осложненные ИМП) (табл. 1).
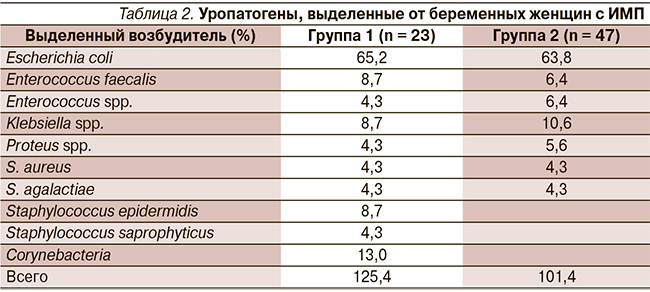
Частота выделения различных возбудителей существенно не различалась у беременных первой и второй групп, при этом наиболее часто в посевах определялась E. coli (табл. 2).
При бессимптомной бактериурии у 12 беременных (48 % случаев) выявлены микробные ассоциации E. coli, Corynebacterium spp., Enterococcus spp. После однократного вечернего применения Монурала (3 г) 87 % пациенток с имевшейся бессимптомной бактериурией достигнута стерильность мочи, т.е. наблюдалось полное выздоровление. У 3 (13 % случаев) беременных концентрация микробных тел значительно снизилась, при этом наблюдалась персистенция Corynebacterium spp. Этим пациенткам была назначена повторная доза Монурала. После повторного применения Монурала Corynebacterium spp. выявлены не были.
Из 47 обследованных беременных второй группы только у одной пациентки наблюдалось сочетание E. coli и Klebsiella spp. При повторном посеве мочи эрадикация возбудителя наблюдалась у 40 (89,3 %) пациенток, получавших Монурал. Персистирующими возбудителями были Klebsiella в двух случаях, S. agalactiae в двух случаях и Enterococcus faecalis в одном соответственно. Этим пациенткам была назначена повторная доза Монурала, и при последующем бактериологическом исследовании рост микробных тел не был обнаружен.
Беременным третьей группы с обострением хронического пиелонефрита при данной беременности Монурал назначен в качестве противорецидивной терапии. Перед назначением препарата эти пациентки прошли курс антибактериальной терапии, и в посевах мочи после лечения роста уропатогенной флоры выявлено не было. Однако в общих анализах мочи сохранялись умеренная гипостенурия (относительная плотность мочи – 1007,5 ± 3,04), слизь, соли, лейкоциты 5,3 ± 0,6 в поле зрения. С учетом наличия факторов, предрасполагающих к рецидивированию пиелонефрита у пациенток данной группы (табл. 1), Монурал назначался один раз в 10 дней вплоть до родоразрешения. Кратность приема препарата составила 6,6 ± 1,9 раза. Дополнительно пациентки данной группы получали постоянную фитотерапию. При контроле посевов мочи с интервалом 1 месяц ни у одной из пациенток роста уропатогенной флоры обнаружено не было. Повторных обострений хронического пиелонефрита не наблюдалось. Только 3 (3,5 %) из наблюдавшихся беременных отметили побочные явления в виде тошноты при приеме препарата, при этом тошнота была легкой и кратковременной.
Монурал относится к препаратам группы В, поэтому мы избегали применять его в первом триместре беременности. Полученные результаты показали высокую эффективность препарата при лечении инфекций нижних мочевыводящих путей во время 2-го и 3-го триместров беременности, а также для профилактики рецидивов хронического пиелонефрита у беременных высокой группы риска. Фосфомицин выводится почками практически без изменений, его концентрация в моче очень высока и его терапевтическое действие пролонгируется до 36 часов, вероятно из-за более длительной желудочно-кишечной абсорбции [19]. Это свойство фосфомицина объясняет его высокую эффективность даже при однократном приеме. Тем не менее в небольшом проценте случаев потребовалось повторное применение препарата для достижения полной стерильности посева мочи. Поскольку к фосфомицину не возникает первичной резистентности [20], считаем целесообразным при значительной контаминации мочевыводящих путей высоковирулентной уропатогенной флорой назначать Монурал дважды с интервалом 3–5 дней.
В связи с тем что Монурал эффективен при незначительной дозировке, он вызывает не только минимальные побочные эффекты, но и потенциально меньшее количество изменений кишечной флоры, поэтому не требует назначения параллельных длительных курсов про- и эубиотиков. Это определяет как высокую комплаентность препарата, так и его экономичность.



