Бронхиальная астма (БА) представляет одно из частых хронических заболеваний у женщин детородного возраста.
Распространенность заболевания среди беременных в России колеблется в пределах 5–12 % в зависимости от региона. При этом до 2/3 беременных с БА нуждаются в соответствующей терапии, но не получают ее [3, 4]. Вместе с тем отсутствие контроля заболевания во время беременности сопряжено с повышенным риском развития осложнений как для матери, так и для плода.
Диагностика и мониторинг БА у беременной женщины осуществляется по общим принципам, за исключением провокационных и кожных тестов (последние при необходимости заменяются определением аллергенспецифических иммуноглобулинов Е – IgE) [1,6].
Дифференциальная диагностика проводится с одышкой беременных, рефлюкс эзофагитом, постназальным синдромом, бронхитом, гипервентиляцией, отеком легких, эмболией легочной артерии, дисфункцией голосовых связок [19].
Влияние беременности на течение БА прогнозировать трудно, однако данные последних лет свидетельствуют: течение БА во время беременности ухудшается почти у 50 % женщин, в т.ч. 45,6 % из них имеют нормальные показатели объема форсированного выдоха за 1-ю секунду – ОФВ1 [3].
Физиологические сдвиги при беременности, оказывающие влияние на течение БА, многочисленны и не позволяют делать однозначного прогноза в отношении течения как БА, так и беременности. Гормональные сдвиги характеризуются снижением клиренса глюкокортикостероидов (ГКС) при усилении синтеза хорионического гонадотропина человека и эстрогенов, которые активируют тучные клетки и обладают проаллергенным действием, а также прогестерона, который подавляет высвобождение гистамина и усиливает синтез IgE, но снижает тонус гладкой мускулатуры и экспрессию β2-адренорецепторов [16].
Основной задачей иммунологической перестройки в организме беременной женщины служит предупреждение отторжения генетически чужеродного эмбриона/плода. К одним из важных механизмов при этом относится супрессия цитотоксических механизмов, в т.ч. Th1-фенотипа иммунного ответа. Биологический смысл данного феномена состоит в профилактике отторжения плода вследствие активации γ-интерферон-зависимых цитотоксических механизмов при увеличении антигенной нагрузки (инфекция, фетоплацентарная недостаточность и т.д.), что, соответственно, ведет к преобладанию проаллергических Th2-цитокинов [2, 3]. К обострению аллергопатологии при беременности может также вести повышение уровня эозинофильного катионного протеина, простагландинов PgЕ2 и F2a [16].
Несмотря на то что дыхательные пути беременной претерпевают некоторые конформационные изменения (увеличение окружности грудной клетки до 5–7 см, уменьшение вертикальных размеров и подъем диафрагмы до 4 см к доношенному сроку) вследствие сдавления беременной маткой, изменения параметров функции внешнего дыхания немногочисленны. Для компенсации растущих потребностей беременной и плода в кислороде происходит увеличение дыхательного объема до 40 % за счет уменьшения резервного объема выдоха и возрастание минутного объема дыхания на больших сроках беременности на 40–50 %. Показатели пиковой скорости выдоха и ОФВ1 не меняются. Не отмечено также выраженных изменений реактивности бронхов на метахолин, хотя может наблюдаться некоторое повышение бронхопровоцирующей концентрации (РС20) [3, 4, 12]. Однако, как показывает ряд исследований, большой проблемой в диагностике и мониторинге БА для беременных остается недооценка изменений функции внешнего дыхания (снижение ОФВ1, остаточного объема легких, ОФВ1/ЖЕЛ – жизненной емкости легких, МОС50 – отношение мгновенной объемной скорости в момент достижения 50 % объема ФЖЕЛ – форсированной жизненной емкости легких выдоха к аналогичному параметру при вдохе, удельной проводимости бронхов, увеличение бронхиального сопротивления), что имеет место в отношении половины беременных с БА и неправомерно трактуется как физиологически обусловленное [3, 4].
Влияние БА на течение беременности в свою очередь сопряжено с риском осложненного течения беременности и родов, однако во многих случаях достижение контролируемого течения астмы минимизирует или устраняет его [17].
К осложнениям со стороны матери относятся:
- Преэклампсия – в настоящее время в понятие «преэклампсия» включаются такие ранее существовавшие понятия, как гестоз, токсикоз и т.д. Неконтролируемая БА ассоциируется с двукратным ростом частоты преэклампсии за счет эндотелиальной дисфункции, цитокинового дисбаланса, эозинофильной инфильтрации плаценты [16].
- Преждевременные и осложненные роды, увеличение частоты самопроизвольных абортов. Мета-анализ перинатальных исходов у женщин с БА показал достоверное увеличение риска преждевременных родов у женщин с неконтролируемым течением БА (относительный риск [ОР] = 1,50; 95 % доверительный интервал [ДИ] – 1,28–1,75) при его достоверном снижении на фоне активной терапии заболевания (ОР = 0,71; 95 % ДИ – 0,58–0,89) [17]. По данным M.B. Bracken (2003), фармакотерапия БА ассоциируется с увеличением частоты преждевременных родов только при приеме таблетированных ГКС (на 2,22 недели) и монотерапии теофиллином (на 1,11 недели) [9].
- Кесарево сечение.
- Анте-, интра- и постнатальные кровотечения.
- Материнская смертность.
Со стороны плода наиболее часты следующие осложнения:
 1. Увеличенный риск перинатальной смертности. В когортном исследовании M.C. Breton (2010) наличие заболевания ассоциировалось с увеличением перинатальной смертности на 34 % [10].
1. Увеличенный риск перинатальной смертности. В когортном исследовании M.C. Breton (2010) наличие заболевания ассоциировалось с увеличением перинатальной смертности на 34 % [10].
2. Гипотрофия плода, маловесность. Мета-анализ перинатальных исходов у женщин с БА показал возрастание на 24 % частоты случаев незрелости плода по отношению к сроку гестации > 10 % в отсутствие адекватной терапии заболевания; ОР рождения плода с массой тела > 4 кг при неконтролируемой БА был также достоверно ниже (ОР = 0,84 [0,74–0,96), а риск рождения ребенка с массой тела < 2500 г выше; ОР = 1,50; 95 % ДИ – 1,28–1,75) [17].
Кроме того, было показано, что к одной из функций плаценты относится метаболизм эндогенных кортикостероидов плацентарной 11-β-гидроксистероиддегидрогеназы, количество и активность которого при гипоксии снижаются. Это ведет к тому, что эндогенные ГКС достигают плода и могут замедлять его развитие. При нормальном функционировании плаценты фермент полностью утилизирует как эндогенные, так и экзогенные ГКС, не приводя к нарушению развития плода. Таким образом, исследование V.E. Murphy (2011) объясняет парадокс, заключенный в следующем: женщины, не получающие игаляционных ГКС (иГКС), имеют более высокий риск гипотрофии плода, обусловленный их воздействием [17].
3. Повышение частоты врожденных отклонений у детей (увеличение риска при обострениях БА у матери, приеме таблетированных ГКС, дозе беклометзона пропионата > 1000 мкг и обращении за медицинской помощью по причинам, обусловленным БА, в I триместре) [8].
4. Неонатальная гипоксия (только для неконтролируемого течения БА).
5. Внутриутробное инфицирование плода.
6. Увеличение рождения детей, страдающих неврологическими расстройствами.
Цели лечения БА у беременных женщин не отличаются от таковых у небеременных, но наряду с необходимостью достижения контроля заболевания включают также избегание побочных эффектов лекарственных препаратов.
Элиминационные мероприятия в отношении триггеров проводятся по общим принципам [1, 6].
Аллергенспецифическая иммунотерапия запрещена для беременных Федеральными клиническими рекомендациями по проведению АСИТ (2013) из-за существующего риска системных реакций и угрозы прерывания беременности при их лечении [7].
Существующее ведение беременных с БА предполагает ступенчатый подход к достижению контроля, предусмотренный GINA 2006–2014 гг., однако большую проблему при этом представляет неоправданный отказ от использования адекватной фармакотерапии по причинам, связанным с фактом беременности. Вместе с тем в отчете рабочей группы NAEPP (National Asthma Education and Prevention Program, 2004) закреплено, что отсутствие адекватного контроля БА представляет больший риск для плода, чем применение любых препаратов для лечения этого заболевания [15]. Правильный контроль заболевания должен обеспечивать женщине, страдающей БА, возможность нормального вынашивания ребенка с минимальным риском для плода или вовсе без него [13–15].
Общепринятой практикой на сегодня является выбор фармакологических средств для лечения беременных с учетом классификации FDA (Food and Drug Administration), согласно которой все лекарственные препараты по возможности их использования беременными подразделяются на несколько категорий:
- Категория А – надлежащие исследования не выявили риска неблагоприятного воздействия на плод в I триместре беременности, и нет данных о риске во II и III триместрах (лекарственных средств с уровнем безопасности категории А для лечения БА у беременных не существует ввиду отсутствия по этическим соображениям каких-либо исследований данной группы пациенток).
- Категория В – исследования на животных не выявили рисков отрицательного воздействия на плод, надлежащих исследований беременных женщин не было (предпочтительная группа препаратов для лечения БА у беременных).
- Категория С – исследования на животных выявили отрицательное воздействие лекарства на плод, а надлежащих исследований беременных женщин не было, однако потенциальная польза, связанная с применением данного лекарства беременными, может оправдывать его использование, несмотря на имеющийся риск (применение не исключено, когда отсутствует возможность использования препаратов группы В, а ожидаемый эффект превосходит негативные последствия для матери и плода.
- Категория D – получены доказательства риска неблагоприятного действия лекарственного средства на плод человека, однако потенциальная польза, связанная с применением лекарственного средства беременными, может оправдывать его использование, несмотря на риск.
- Категория N – данное лекарство еще не классифицировано FDA.
- Категория Х – выявлены нарушения развития плода или имеются доказательства риска отрицательного воздействия данного средства на плод человека, и, таким образом, риски для плода от него превышают возможную пользу для беременной женщины.
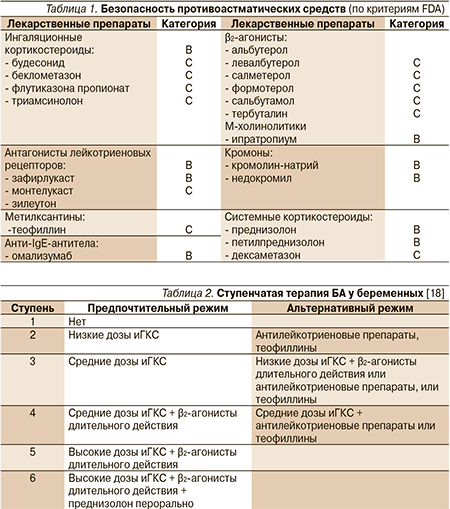
В табл. 1 приведены группы препаратов и входящие в них лекарственные средства, рекомендованные для лечения БА и купирования приступов бронхоспазмов во время беременности с учетом рекомендаций FDA по состоянию на 2013 г.
Короткодействующие β2-агонисты, ипратропия бромид, пероральные и внутривенные теофиллины, а также иГКС при лечении БА у беременных используются по обычным показаниям. Беременность не служит причиной отказа от таблетированных ГКС. Если есть признаки тяжелой астмы, препараты назначаются по общим показаниям. Прием антилейкотриеновых препаратов может продолжаться беременными женщинами, которые достигли значительного улучшения контроля за этими препаратами до беременности и не могут достичь его за другими [6].
Предпочтительные и альтернативные режимы ступенчатой фармакотерапии БА у беременных приведены в табл. 2 [18]. Несмотря на отсутствие в данном перечне омализумаба, препарат признан эффективным и безопасным при лечении БА у беременных [11].
Во время родов необходимо продолжение базисной терапии БА в прежнем режиме. При необходимости анестезии предпочтительной остается перидуральная.
Контроль состояния плода во время родов осуществляется постоянно, у роженицы оценивают ОФВ1 или пиковую скорость выдоха каждые 12 часов (при обострении БА – в динамике). При предшествующем получении системных ГКС в дозе > 7,5 мг преднизолона в течение > 2 недель перед родами беременная переводится на гидрокортизон 100 мг каждые 6–8 часов в течение родов и 24 часов после рождения ребенка. При необходимости стимуляции родовой деятельности следует использовать окситоцин и избегать назначения препаратов простагландинов. Вопрос о необходимости кесарева сечения определяется акушерскими показаниями, а при его необходимости предпочтительна перидуральная анестезия [5, 6].
В послеродовом периоде обязателен мониторинг функции внешнего дыхания, в дальнейшем – лечение заболевания по общим принципам.
Таким образом, неконтролируемое течение БА у беременной женщины сопряжено с высоким риском осложнений со стороны как матери, так и плода. Обеспечение контроля с помощью любых фармакотерапевтических средств – наиболее безопасный вариант ведения данной категории больных, при этом предпочтительными в использовании остаются препараты, отнесенные к категории В по кри-териям FDA. При невозможности их назначения допустимо таковое препаратов группы С, если предполагаемый риск выше риска потенциальных осложнений. В родовом и послеродовом периодах следует исходить из возможности обострения БА, соответствующим образом корригировать тактику ведения и фармакотерапию больной.


