Введение и классификация
Желудочно-кишечные кровотечения (ЖКК) осложняют течение многих заболеваний пищеварительной системы, и от того, насколько клиницист ориентирован в современных методах диагностики и адекватном выборе тактики лечения, в конченом счете зависит жизнь больного [1]. На текущий момент ЖКК – одна из главных причин экстренной госпитализации в экономически развитых странах мира. Актуальность проблемы подчеркивается уровнем летальности, которая колеблется от 6 до 14 %, а в группе пациентов с тяжелым кровотечением достигает 50 % [2–4].
Традиционно различают кровотечения из верхних и нижних отделов желудочно-кишечного тракта (ЖКТ). В первом случае источник кровотечения располагается выше связки Трейтца (ЖКК из пищевода, желудка и двенадцатиперстной кишки), в свою очередь ЖКК из нижних отделов ЖКТ происходят из тонкой и толстой кишки [1, 3].
ЖКК из верхних отделов ЖКТ
На сегодняшний момент кровотечения из верхних отделов ЖКТ занимают главенствующее место в структуре всех ЖКК и составляют 80–90 % случаев [3]. Среди причин кровотечений из верхних отделов ЖКТ выделяют две большие группы – кровотечения язвенной природы (44–49 % случаев) и кровотечения неязвенной природы (51–56 %) [1]. К последним относят кровотечения из варикозно расширенных вен пищевода больных циррозом печени, а также ЖКК, ассоциированные с болезнью Вебера–Ослера–Рандю, разрывом аневризмы аорты, коагулопатиями и другими причинами [3, 5].
В последнее время в иностранной литературе нередко отмечается тенденция к снижению распространенности язвенной болезни желудка и двенадцатиперстной кишки в странах Западной Европы и Северной Америки, однако этот процесс не коррелирует с частотой язвенных кровотечений [6, 7]. При этом, несмотря на эффективность современной терапии, число больных с язвенными кровотечениями имеет тенденцию к увеличению [8]. Так, по данным российских авторов, за последние 8–10 лет число пациентов с ЖКК язвенной природы возросло в 1,5 раза [1].
Представляется, что причины высокой частоты язвенных кровотечений в странах Европы, Северной Америки и России различны. Так, в России высокая частота язвенных кровотечений связана скорее всего с низким социальным уровнем населения, что в свою очередь обусловливает высокую распространенность основных факторов риска, таких как курение, инфицированность Helicobacter pylori и др. [9–11]. Напротив, в западноевропейской и североамериканской популяции за последние годы стремительно выросло потребление нестероидных противовоспалительных препаратов (НПВП) [6]. Прием НПВП повышает риск развития эрозивно-язвенных поражений слизистой в 3–5 раз, риск кровотечений и перфораций – в 8 раз [12].
К основным факторам риска кровотечений язвенной природы стоит отнести пожилой возраст, а также прием НПВП, антикоагулянтов и глюкокортикоидов [4, 6]. Помимо этого следует отметить, что у мужчин ЖКК встречаются в 2,5–3,0 раза чаще, чем у женщин [7].
Механизм формирования кровотечения при язвенной болезни желудка и двенадцатиперстной кишки обусловлен глубоким язвенным дефектом, когда дно язвы достигает стенки кровеносного сосуда. Опосредованно наступает истончение и некроз сосудистой стенки, инициируя кровотечение. Так, показано, что источником кровотечения язвенной природы могут быть как аррозированные сосуды различного диаметра, находящиеся в дне язвы, так и сами края язвенного кратера, диффузно кровоточащие вследствие воспалительно-деструктивных изменений в стенке пораженного органа. Стоит отметить, что наиболее часто массивные и жизнеугрожающие кровотечения исходят из каллезных язв малой кривизны желудка и заднемедиального отдела луковицы двенадцатиперстной кишки, что связано с особенностями кровоснабжения этих зон [1, 3, 4, 13].
Выраженность клинических симптомов отражает индивидуальную реакцию больного на кровопотерю, определяется как интенсивностью и массивностью самого кровотечения, так и исходным состоянием организма, его компенсаторными возможностями [4]. Наиболее яркие клинические проявления наблюдаются при массивных кровотечениях с потерей около 25 % объема циркулирующей крови (ОЦК) в течение достаточно небольшого временного интервала (минуты–часы) [1]. В таких случаях клиническая картина соответствует геморрагическому (гиповолемическому) шоку и проявляется гипотонией, тахикардией, мраморностью кожных покровов, снижением центрального венозного давления [13].
Симптомокомплексы острых ЖКК можно подразделить на общие, характерные для любой кровопотери, и частные, характерные для внутрипросветного кровотечения. Общие симптомы кровопотери разнообразны и включают резкую общую слабость, головокружение, ощущение потемнения в глазах, сердцебиение, одышку. При массивных кровотечениях в силу нарастающей циркуляторной гипоксии может наступить потеря сознания.
К симптомам, характеризующим внутрипросветное кровотечение, относят рвоту кровью (гематемезис) и черный дегтеобразный стул (мелена). Считается, что для появления таких характерных признаков внутрипросветного кровотечения необходима потеря около 500 мл излившейся крови. Рвота кровью, как правило, всегда ассоциирована с меленой. Характерным признаком желудочного кровотечения являются рвотные массы в виде кофейной гущи, что определяется образованием хлорида гематина при взаимодействии гемоглобина крови с соляной кислотой желудка. Мелена появляется не ранее чем через 8 часов после начала кровотечения. Стоит отметить, что при массивном кровотечении (в случае внутрипросветного выделения более 1500 мл крови) не происходит формирования мелены, а из прямой кишки может отмечаться выделение малоизмененной алой крови (гематохезия) [3, 5, 14].
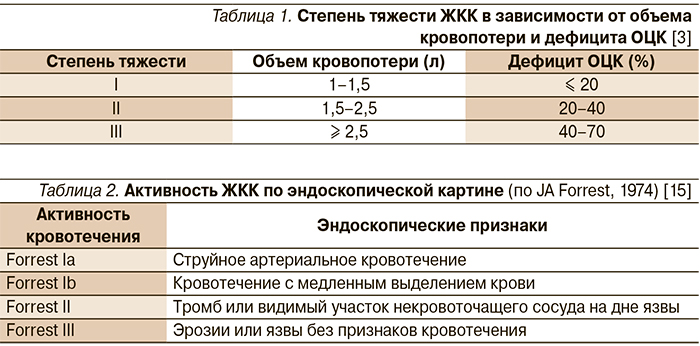
В зависимости от объема кровопотери и дефицита ОЦК выделяют 3 степени тяжести ЖКК (табл. 1). Для вычисления ОЦК нередко используют показатель шокового индекса Алговера–Бурри (1967), определяемый соотношением частоты пульса и уровня систолического артериального давления. При индексе 0,8 и менее объем кровопотери равен 10 % ОЦК, при 1,3–1,4 – 30 %, при 1,5 и выше – 50 % ОЦК и более [3].
В диагностике ЖКК из верхних отделов ЖКТ большое значение имеют анамнестические данные пациента. С учетом того что у превалирующего числа пациентов кровотечение возникает на фоне обострения язвенной болезни, можно выявить характерные для этого заболевания клинические проявления (наличие «голодных» болей, часто сопровождающихся изжогой, облегчающихся после приема антацидов и ингибиторов протонной помпы [ИПП], нередко носящих сезонный характер) [1, 4, 6, 13].
Инструментальные методы исследования направлены на выявление точной локализации зоны кровотечения. На сегодня ведущим инструментальным методом диагностики ЖКК служит экстренная (неотложная) эзофагогастродуоденоскопия [1–3, 11, 14]. Данный метод дает возможность наиболее точно верифицировать источник и характер кровотечения, а также оценить риск ранних рецидивов. Эндоскопическая картина лежит также в основе классификации активности язвенных ЖКК (по J.A. Forrest, 1974) [15]. В соответствии с данной классификацией принято выделять активное (Forrest Ia/Ib) и состоявшееся (Forrest II/III) кровотечения (табл. 2).
Использование данной классификации позволяет унифицировать описание кровоточащей гастродуоденальной язвы, а значит, избегать разночтений, однозначно трактовать интенсивность кровотечения и его источник. Основываясь на вышеперечисленных показателях, врач-эндоскопист оценивает потенциальную возможность рецидива ЖКК.
Методы консервативного гемостаза направлены на создание условий для формирования, ретракции и организации тромба в просвете кровоточащего сосуда, предотвращение лизиса и дислокации тромба, реализации тканевого репаративного потенциала желудочной и дуоденальной стенки в периульцерозной зоне [16]. В ряде случаев выбирается комбинированный эндоскопический гемостаз, сочетающий инъекционное введение в края язвы адреналина и спирт-новокаиновой смеси с аргоноплазменной коагуляцией или диатермокоагуляцией. Однако успех терапии гастродуоденальных кровотечений заключается в сочетании эндоскопического гемостаза с адекватной медикаментозной терапией, базисными препаратами которой являются ИПП [3, 7, 11, 16–18].
Основанием к назначению антисекреторных препаратов, ингибирующих продукцию соляной кислоты, служит падение активности пепсина или его инактивация при повышении интрагастрального рН > 4 ЕД, что приводит к снижению агрессивных свойств желудочного сока за счет нарушения активации пепсина, снижает обратную диффузию ионов водорода и их повреждающее воздействие на слизистую оболочку желудка. Помимо этого в условиях, когда рН содержимого желудка (6–7 ЕД) сдвигается в щелочную сторону, блокируется лизис свежих тромбов, что позволяет обеспечивать полноценный сосудисто-тромбоцитарный гемостаз [4, 16, 19].
Основные позиции применения ИПП в рамках медикаментозной терапии гастродуоденальных кровотечений были регламентированы в 2010 г. Международным консенсусом по ведению пациентов с неварикозными кровотечениями из верхних отделов ЖКТ [19].
Согласно положению А8 вышеназванного документа, вполне оправданно инфузионное введение ИПП до проведения первичного эндоскопического осмотра, что снижает частоту необходимости применения эндоскопических методов гемостаза (уровень доказательности 1b) [19]. При этом важно подчеркнуть, что такая тактика ни в коем случае не должна рассматриваться как предлог задержки проведения экстренного эндоскопического исследования [20].
В положении С3 утверждается, что после успешного эндоскопического гемостаза рекомендуется назначение внутривенного болюса с последующей непрерывной инфузией ИПП. Такая тактика снижает риск повторного кровотечения, а значит, и смертность в этой группе пациентов (уровень доказательности 1a) [19]. Согласно крупномасштабному Кокрановскому мета-анализу, включившему 5792 пациента, высокодозная внутривенная терапия ИПП (80 мг болюсно и 8 мг в час в виде продленной инфузии) привела к уменьшению частоты повторных кровотечений (ОР – 0,43, ДИ – 0,27–0,67), хирургических вмешательств (ОР – 0,60 ДИ – 0,31–0,96) и смертности (ОР – 0,57, ДИ – 0,34–0,96). А низкие дозы ИПП как при внутривенном введении, так и перорально уменьшали частоту повторного кровотечения, но не снижали уровень смертности [21].
В положении С4 рекомендуется продолжить лечение ежедневными разовыми дозами ИПП перорально и после выписки пациента из стационара. Продолжительность такого лечения обусловлена этиологией заболевания (уровень доказательности 1с) [19]. Так, пациентам, нуждающимся в лечении НПВП, может потребоваться длительная вторичная профилактика [22]. Рядом экспертов предлагается двукратный суточный прием ИПП реконвалесцентам, что позволяет профилактировать кислотные прорывы на фоне лечения [23].
Эксперты, принявшие участие в разработке рекомендаций Международного консенсуса по ведению пациентов с неварикозными кровотечениями из верхних отделов ЖКТ, большое внимание уделяют роли эрадикации H. pylori. Распространенность данной инфекции у пациентов с кровотечением из верхних отделов ЖКТ довольно высока и варьируется от 43 до 56 % [24, 25].
В положении D5 говорится, что все пациенты, перенесшие язвенное кровотечение, должны тестироваться на наличие H. pylori и в случае его обнаружения получать эрадикационную терапию с обязательным подтверждением успешности проведенного антихеликобактерного лечения (уровень доказательности 2а) [19].
В соответствии с консенсусом Маастрихт-IV (2010), регламентирующим стандарты диагностики и лечения инфекции H. pylori, в регионах с низкой резистентностью H. pylori к кларитромицину (менее 20 %) в качестве эрадикационной терапии первой линии регламентируется тройная терапия, включающая ИПП, кларитромицин и амоксициллин. В регионах с высокой резистентностью H. pylori к кларитромицину (более 20 %) в качестве эрадикационной терапии первой линии рекомендуется квадротерапия с препаратами висмута (ИПП + метронидазол + тетрациклин + висмута трикалия дицитрат) или последовательная эрадикационная терапия (первые 5 дней – ИПП + амоксициллин, последующие 5 дней – ИПП + кларитромицин + тинидазол/метронидазол) [26, 27].
В рамках стратегии профилактирования рецидива кровотечения весьма важен контроль эрадикации H. pylori у каждого пациента; ведь далеко не от всех больных можно добиться 100 %ного успеха эрадикации, что определено ростом количества резистентных штаммов микроорганизма в популяции, а также вариативной генетической предиспозицией к успешности лечения [28–30]. В связис этим поддерживающая терапия ИПП должна продолжаться длительно, по крайней мере до получения положительных результатов по эрадикации.
Для купирования ЖКК при варикозном расширении вен пищевода применяют сосудосуживающие препараты. Препаратом выбора в этом случае остается синтетический аналог соматостатина (октреотид), вытеснивший в настоящее время вазопрессин [5]. При небольшом по объему кровотечении из варикозно расширенных вен пищевода основной формой лечения является эндоскопическая склерозирующая терапия или наложение лигатур. При массивных кровотечениях, в случаях когда склерозирующая терапия невозможна, целесообразно использование зонда Сенгстейкена–Блейкмора [3].
ЖКК из нижних отделов ЖКТ
В отличие от кровотечений из верхних отделов ЖКТ большинство кровотечений из нижних отделов ЖКТ скрытые или незначительные, непостоянные и не требуют госпитализации [1]. Средний возраст пациентов с кровотечениями из нижних отделов ЖКТ выше, чем у больных с кровотечениями из верхних отделов ЖКТ. За последние несколько десятилетий показатели смертности от острого кровотечения из нижних отделов ЖКТ несколько снизились, что связывают в первую очередь с совершенствованием диагностики кровотечений благодаря применению колоноскопии и ангиографии, которые позволяют подбирать оптимальный алгоритм хирургического или ангиографического лечения [5, 14].
Как правило, основными причинами кровотечений из нижних отделов ЖКТ являются [3]:
- ангиодисплазии тонкой и толстой кишки;
- дивертикулез кишечника;
- опухоли и полипы кишечника;
- воспалительные заболевания кишечника (язвенный колит, болезнь Крона);
- острые инфекционные колиты (в т.ч. псевдомембранозный);
- ишемические поражения кишечника, возникающие в результате тромбоза или эмболии ветвей мезентериальных артерий;
- геморрой и анальные трещины;
- травмы кишечника.
Из всех вышеперечисленных причин кровотечений из нижних отделов ЖКТ наиболее распространены (30 %) геморрагии из кавернозных гемангиом и ангиодисплазий слизистой оболочки тонкой и толстой кишки (артериовенозные мальформации I, II и III типов), а также дивертикулез кишечника (17 %) [5].
При дивертикулезе кровоточащий дивертикул чаще обнаруживается в левых отделах толстой кишки. Как правило, кровотечения возникают при сопутствующем дивертикулите и травматизации кровеносных сосудов. Дивертикулярное кровотечение часто манифестирует как острое, безболезненное и проявляется наличием ярко-красной неизмененной крови (гематохезии) в кале, хотя может наблюдаться и мелена, если источник кровотечения располагается в тонкой кишке. Причем чем светлее кровь, тем дистальнее очаг кровотечения. Подобная картина часто отмечается и при ангиодисплазиях [13].
Опухолевые процессы редко дают острое кровотечение, в основном они становятся причиной хронической, скрытой кровопотери и железодефицитной анемии. Кровотечения, источником которых является Меккелев дивертикул, чаще наблюдаются в детском возрасте. Это безболезненные кровотечения, которые могут быть представлены меленой или яркой алой кровью, классически описанной как стул в виде «смородинового желе» [14]. Воспалительные заболевания кишечника (язвенный колит и болезнь Крона) характеризует болевой синдром, как правило, предшествующий кровотечению. Кровь данных пациентов обычно смешивается со стулом, что изменяет его цвет, т.к. источник кровотечения чаще расположен выше ректосигмоидного отдела толстой кишки. Помимо этого характерны и другие признаки воспалительных заболеваний кишечника – такие, как диарея, тенезмы и пр.
При внутреннем геморрое болевой синдром чаще всего отсутствует, а кровотечение может быть в виде струйки алой крови либо проявляться наличием на туалетной бумаге или вокруг стула крови, но не смешанной с калом, который сохраняет свой обычный цвет. В целом, когда при наличии признаков кровотечения содержимое кишечника сохраняет свой обычный цвет, это свидетельствует о низком расположении источника кровотечения (в ректосигмоидном секторе). Кровотечение при геморрое часто отмечается при натуживании или при прохождении твердых каловых масс. Подобная картина характерна и для пациентов с кровотечением из анальных трещин, однако в этом случае оно часто сопровождается резким болевым синдромом. Кровотечение при геморрое чаще бывает необильным, однако в ряде случаев могут наблюдаться и массивные кровопотери, требующие неотложных оперативных мероприятий.
Большое значение в диагностике кровотечений из нижних отделов ЖКТ имеют сведения, полученные при сборе анамнеза и объективном обследовании больного. Существенную роль играет отягощенная наследственность, перенесенная и имеющаяся хроническая патология (онкологические заболевания у пациента и родственников, в т.ч. семейный поллипоз толстой кишки, гепатит, цирроз печени, урогенитальная патология), а также условия жизни и работы.
Осмотр больного часто позволяет сделать ряд выводов; например, наличие множественных телеангиэктазий на коже и слизистых предполагает, что они имеются и в кишечной стенке. Кроме того, важно учитывать симптомы имеющейся постгеморрагической железодефицитной анемии, абдоминальных болей, диареи, анорексии, потери веса или наличия пальпируемых образований в брюшной полости [5].
Неоценимое значение в диагностике кровотечений из нижних отделов ЖКТ имеет эндоскопическое исследование толстой кишки (ректоромано- или колоноскопия), позволяющее установить источник кровотечения более чем у 90 % больных [3, 5, 13].
В 80 % случаев острые кровотечения из нижних отделов ЖКТ останавливаются самостоятельно или в ходе лечебных мероприятий, направленных на терапию основного заболевания. Наиболее эффективной терапией дивертикулярного и ангиодиспластического кровотечений являются селективная катетеризация с внутриартериальным введением вазопрессина; чрескатетерная эмболизация кишечных артерий; эндоскопическая электро- и лазерокоагуляция; склеротерапия.
Место препаратов железа в лечении ЖКК
Поскольку кровотечения из нижних отделов ЖКТ значительно чаще имеют скрытый характер и сопровождаются хронической железодефицитной анемией, следует в каждом случае проводить диагностику оккультных кровопотерь и их своевременную терапевтическую коррекцию [5]. Помимо этого восстановление естественного гемопоэза оказывает положительное влияние на течение послеоперационного периода у больных постгеморрагической анемией [32].
В вышеописанных ситуациях терапией выбора может быть мультикомпонентный препарат Ферро-Фольгамма, в состав которого входит 100 мг железа сульфата безводного или 37 мг железа, фолиевая кислота (5 мг), цианокобаламин (10 мкг) и аскорбиновая кислота (100 мг). Удачное сочетание указанных компонентов в одной лекарственной форме создает условия для наиболее эффективного всасывания железа и коррекции патологических процессов. Кроме того, присутствие в препарате рапсового масла в качестве носителя защищает слизистую желудка от раздражающего действия железа, что имеет большое значение при его сопутствующем поражении. Препарат Ферро-Фольгамма обеспечивает прирост гемоглобина в среднем на 2,5 г/л/сут, что является наибольшей скоростью прироста гемоглобина среди препаратов сульфата железа [33]. При использовании Ферро-Фольгаммы ослабление клинической симптоматики постгеморрагической анемии отмечается в течение первых 10 дней приема, что выгодно отличает данный препарат от других мультикомпонентных комплексов железа.
Как правило, дозы и продолжительность лечения подбираются индивидуально по лабораторным и клиническим показателям. В случае железодефицитной анемии легкой степени препарат назначают по 1 капсуле 3 раза в сутки в течение 3–4 недель. При среднетяжелом течении анемии дозировка остается прежней, но длительность лечения увеличивается до 8–12 недель. При тяжелом течении анемии возможно увеличение дозы до 4 капсул с пролонгацией курса лечения до 16 недель и более.
Заключение
Таким образом, проблема ЖКК остается до настоящего времени в списке наиболее актуальных в практической гастроэнтерологии в аспекте как острых, так и хронических осложнений ряда патологических состояний, создающих серьезную угрозу здоровью, а подчас и жизни. В связи с этим ранняя диагностика и своевременно назначенное адекватное лечение служат существенными составляющими современного лечения, профилактики ЖКК, постгеморрагической анемии. Немаловажное значение имеет ведение больных и в период реабилитации. Препаратами выбора здесь остаются современные железосодержащие средства, в т.ч. препарат Ферро-Фольгамма, позволяющий в комплексной терапии состояний, вызванных сочетанным дефицитом железа, фолиевой кислоты и витамина B12, быстро добиваться положительного эффекта.


