Согласно данным ВОЗ, анемиями страдают около 2 млрд людей во всем мире [1]. Анемией называется такое состояние, при котором количество циркулирующих эритроцитов, концентрация гемоглобина (Hb) или гематокрит (Hct) опускаются ниже нормальных значений [2]. Критериями анемии, согласно рекомендациям ВОЗ, считается снижение уровня Hb у мужчин ниже 130 г/л, у небеременных женщин ниже 120 г/л, у беременных ниже 110 г/л [1]. Анемии являются частым заболеванием среди пожилых пациентов. По данным американских авторов, в США среди лиц в возра-сте старше 50 лет отмечается быстрый рост частоты выявления анемий, определяемых как снижение уровня Hb менее 110 г/л. К возрасту старше 85 лет эта частота достигает более 20 %, а в возрасте 65 лет она составляет 11 % среди мужчин и 10,2 % среди женщин. Треть из выявленных анемий была связана с недостатками питательных веществ (железодефицит, дефицит витамина В12, фолиевой кислоты) и треть пришлась на анемии хронического заболевания (АХЗ), в т. ч. связанные с хронической почечной недостаточностью (ХПН) [3].
Среди поступающих в наш стационар пациентов подавляющее большинство – лица в возрасте старше 50 лет. Большая часть из них страдают различными хроническими заболеваниями, что увеличивает частоту выявления анемий, поскольку, согласно современным данным, значительная часть больных хроническими воспалительными заболеваниями, хроническими инфекциями, онкологическими заболеваниями, ХПН страдают анемией легкой или средней степени тяжести [4]. По существующим эпидемиологическим данным, второй по распространенности после железодефицитной анемии (ЖДА) считается АХЗ [5]
В связи с тем что снижение уровня сывороточного железа в крови является характерным признаком ЖДА, АХЗ и анемии при ХПН, для понимания возможных направлений терапевтического воздействия остановимся на основных причинах и ключевых моментах патогенеза перечисленных заболеваний.
Обмен железа
Поступление железа в кровь осуществляется следующими путями: всасывания из двенадцатиперстной кишки (1–2 мг/сут), рециркуляции из стареющих эритроцитов (20 мг/сут), высвобождения из депо в гепатоцитах и макрофагах (несколько миллиграммов в день в зависимости от потребности в железе). Связанное с трансферрином (ТСФ) железо в плазме крови главным образом предназначено для развития предшественников эритроцитов в костном мозге, где железо включается в гем и гемоглобин [6]. Концентрация железа в крови в основном контролируется взаимодействием 2 белков – гепцидина и ферропортина. Соотношение этих белков регулирует депонирование и высвобождение железа из клеток [7]. Единственная известная молекулярная мишень воздействия гепцидина – белок ферропортин, служащий трансмембранным каналом, посредством которого осуществляется транспорт железа из клетки в плазму. Отмечено, что при повышении уровня железа в плазме крови увеличивается и концентрация гепцидина, который снижает всасывание железа из двенадцатиперстной кишки и высвобождение железа из депо [6]. Нарушение баланса гепцидина и ферропортина описано для следующих заболеваний:
- Все известные типы гемохроматоза.
- Серповидно-клеточная анемия.
- ЖДА:
- вызванная особенностями диеты или вследствие кровопотери, хорошо отвечающая на терапию препаратами железа (ПЖ);
- наследственная анемия, плохо поддающаяся лечению ПЖ (рефрактерная ЖДА).
- Вирусные гепатиты.
- Метаболический синдром, возможно, атеросклероз.
- Рак [7].
Патогенез анемий
Анемия хронического заболевания
Инфекции и воспаление значительно увеличивают синтез и высвобождение гепцидина, что приводит к гипоферремии, ограничению доступного для эритропоэза железа [6].
В результате воздействия цитокинов клетками ретикулоэндотелиальной системы (РЭС) осуществляется захват и депонирование железа [5]. Первоначально происходит активация Т-лимфоцитов (CD3+) и моноцитов в результате проникновения микроорганизмов, появления атипичных клеток или вследствие нарушения регуляции цитокинов [4, 5]. Активированные CD3+ и моноциты вырабатывают интерферон-γ; фактор некроза опухоли-α (ФНО-α), интерлейкин-1 (ИЛ-1), ИЛ-6, -10. -6 и липополисахарид (ЛПС) индуцируют выработку гепатоцитами острофазового белка гепцидина [4, 5]. В свою очередь гепцидин подавляет всасывание железа в двенадцатиперстной кишке. Интерферон-γ и ЛПС стимулируют захват макрофагами двувалентного железа (Fe2+). Противовоспалительный ИЛ-10 стимулирует захват моноцитами связанного с ТСФ железа. ФНО-α индуцирует фагоцитоз и лизис эритроцитов макрофагами путем повреждения мембран эритроцитов и стимуляции фагоцитоза. Интерферон-γ и ЛПС ингибируют выход железа из макрофагов, также подавленных гепцидином. ФНО-α, ИЛ-1, ИЛ-6 и ИЛ-10 индуцируют экспрессию ферритина и таким образом стимулируют депонирование железа внутри макрофагов. ФНО-α, интерферон-γ подавляют продукцию эритропоэтина (ЭП) почками. ФНО-α, интерферон-γ, ИЛ-1 напрямую угнетают дифференциацию и пролиферацию клеток эритроидного ростка [5].
Таким образом, можно выделить несколько звеньев патогенеза АХЗ:
- сокращение продолжительности жизни эритроцитов вследствие более раннего фагоцитоза макрофагами;
- ингибирующее действие цитокинов (ФНО-α, ИЛ-1, интерфероны) на эритроидный росток;
- уменьшение секреции ЭП почками;
- нарушение эритропоэза вследствие недоступности железа для костного мозга, что связано с повышением концентрации гепцидина в крови и развитием гипоферремии;
- нарушения синтеза гема – замещение молекулы Fe в протопорфирине молекулой Zn вследствие недоступности железа [8];
- нарушение высвобождения железа из макрофагов и гепатоцитов из-за повышения концентрации в крови гепцидина;
- угнетение всасывания железа в двенадцатиперстной кишке [4].
Анемия при ХПН
Наиболее значимыми при развитии анемии при ХПН являются:
- нарушение метаболизма эритроцитов – существуют доказательства связи между азотом мочевины крови и длительностью жизни эритроцитов [9];
- механическое разрушение эритроцитов [10];
- гемолитический уремический синдром [4];
- угнетение костного мозга – токсины при уремии могут повреждать эритроидный росток [11];
- нарушение синтеза ЭП [4];
- кровотечения – желудочно-кишечные и гинекологические – встречаются у трети пациентов с ХПН [12], что часто обусловливает наличие у них железодефицита [4].
Железодефицитная анемия
ЖДА у мужчин и женщин после менопаузы чаще всего обусловлена потерей крови из желудочно-кишечного тракта или нарушением всасывания железа [13]. У женщин детородного возраста частой причиной железодефицита являются кровотечения при менструациях [6]. Кроме того, причинами развития ЖДА могут быть перераспределение запасов железа при формировании эритропоэза плода и ребенка во время беременности и лактации, диета с низким содержанием железа, внутрисосудистый гемолиз с гемоглобинурией, перераспределение железа в ткани, не отвечающие за гемопоэз, например легкие, генетические факторы или комбинация указанных причин [4]
Основные критерии диагностики АХЗ и ЖДА
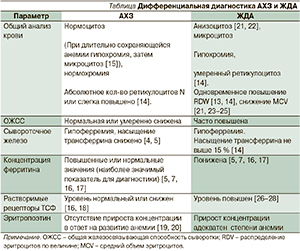 Принципы дифференциальной диагностики АХЗ и ЖДА представлены в таблице.
Принципы дифференциальной диагностики АХЗ и ЖДА представлены в таблице.
Общей особенностью указанных заболеваний является снижение уровня сывороточного железа (гипоферремия) и насыщения ТСФ [7, 28]. Следует, однако, отметить, что насыщение ТСФ при ЖДА может быть ниже, чем при АХЗ, в связи с тем, что концентрация ТСФ в крови повышается при ЖДА и остается нормальной или снижается при АХЗ. Низкое насыщение ТСФ при АХЗ – прямое следствие снижения уровня железа в крови. Следует подчеркнуть, что с учетом часто встречающихся исключений диагностическая ценность определения ОЖСС и насыщения ТСФ имеет серьезные ограничения [4, 5].
В настоящее время существенное значение для дифференциальной диагностики имеет определение концентрации ферритина в крови, являющейся отражением состояния депо железа в организме и наличия воспаления [4]. Стоит заметить, что этот показатель может стать неинформативным при проведении лечения: прием ПЖ внутрь более 3 недель или парентеральное введение декстрана железа в течение последних суток вызывает повышение уровня ферритина до нормального или высокого [31].
Что касается числовых значений показателей ферритина, то уровень < 15 мкг/л свидетельствует о железодефиците, уровень > 100 мкг/л практически исключает железодефицит; промежуточные значения требуют дальнейшего исследования [32].
Другим существенным показателем в дифференциальной диагностике анемий является уровень растворимых рецепторов ТСФ [15].
Уровень ЭП при наличии анемии у пациентов с ревматоидным артритом, другими воспалительными и онкологическими (солидные опухоли и опухоли системы крови) заболеваниями ниже, чем при ЖДА [33].
Лечение анемий
Принципы терапии ЖДА и АХЗ
У большинства пациентов с неполным обследованием терапия ЖДА остается недостаточно эффективной, т. к. успех лечения во многом зависит от выявления причины анемии. Целью терапии является нормализация уровня гемоглобина и MCV, восстановление запасов железа в организме [13].
В первую очередь необходимо подчеркнуть, что лечение АХЗ предполагает терапию основного заболевания в тех случаях, когда это возможно [4, 5, 29, 30].
Необходимость специфического лечения АХЗ, не сопровождающейся истинным железодефицитом, в настоящее время остается спорной из-за недостаточной доказательной базы.
В пользу необходимости лечения приводятся такие аргументы, как компенсаторное увеличение сердечного выброса для поддержания адекватной оксигенации тканей и связь анемии с неблагоприятным прогнозом [5].
В ходе клинических исследований лиц старше 65 лет с анемией отмечен прогноз, хуже, чем в ее отсутствие, за счет уменьшения подвижности, снижения со временем объективных показателей физической работоспособности, увеличения смертности [3].
По данным ретроспективного исследования, включившего около 100 тыс. пациентов, находившихся на гемодиализе, вероятность смертельного исхода при уровне Hb 80 г/л была двое выше по сравнению с группой больных с уровнем Hb 100–110 г/л [5]. Кроме того, у пациентов, длительно находящихся на гемодиализе, относительный риск смерти при уровне Ht 33–36 % был меньше, чем при Ht ≤ 30 % [5].
По данным мета-анализов, у пациентов с хронической болезнью почек, раком, застойной сердечной недостаточностью [34–36] анемия ассоциировалась с неблагоприятным прогнозом [5], в т. ч. с повышением смертности.
Однако существует мнение, будто типичная АХЗ с уровнем Нb > 80 г/л является адаптивным состоянием и не требует специфического лечения.
В пользу этой гипотезы приводятся следующие аргументы: 1) утверждение, будто анемия при многих заболеваниях имеет причинную связь с неблагоприятным прогнозом, недостаточно обосновано; 2) АХЗ имеет черты адаптивного физиологического ответа; 3) лечение анемии легкой и средней степеней тяжести, возможно, увеличивает смертность [37].
Таким образом, можно выделить следующие клинические ситуации, при которых показана коррекция АХЗ:
- наличие симптомов, относящихся к анемии, при невозможности/неэффективности лечения основного заболевания и уровне Нb < 100 г/л;
- сопутствующий истинный железодефицит.
В зависимости от клинической ситуации могут быть рассмотрены следующие направления лечения:
- гемотрансфузия;
- стимуляторы эритропоэза;
- ПЖ (внутрь или парентерально).
Необходимо подчеркнуть, что применение ПЖ при АХЗ имеет доказательную базу только при наличии сопутствующего железодефицита.
Лечение ПЖ
Обычная длительность лечения ПЖ – 3 месяца после коррекции уровня Hb и MCV [13]. Лечение считается эффективным при индукции ретикулоцитоза в течение нескольких дней и повышении уровня Hb примерно на 10–20 г/л каждые 2 недели [22] или на 20 г/л в течение 3–4 недель [13]. Повышение уровня ретикулоцитов и RDW вплоть до 30 % в первые недели от начала терапии ПЖ также является диагностическим критерием ЖДА [22, 25].
Лечение пероральными ПЖ – это самый простой, дешевый и предпочтительный способ коррекции анемии и восполнения депо железа в организме [13, 14]. Наиболее распространены препараты трех солей железа: железа сульфат, железа глюконат, железа фумарат [38]. Дозу препаратов солей железа следует рассчитывать исходя из содержания элементарного железа. Необходимо помнить, что препарат сульфата железа содержит в 2 раза больше элементарного железа, чем препараты глюконата или фумарата железа, поэтому лечение этими солями может быть более длительным [38]. Разовые дозы препаратов солей железа в пересчете на элементарное железо колеблются от 30 до 100 мг [14]: так, таблетка сульфата железа содержит 60 мг элементарного железа, а таблетка глюконата железа – 36 мг [22], средняя суточная доза составляет 150–200 мг элементарного железа [38].
Наиболее типичными нежелательными явлениями со стороны желудочно-кишечного тракта (ЖКТ) при приеме ПЖ являются тошнота, дискомфорт в эпигастрии и запоры, что встречается в среднем у 20 % пациентов и снижает приверженность лечению [22]. Для преодоления указанных нежелательных явлений и увеличения комплаентности существуют ПЖ в таблетках, покрытых кишечнорастворимой оболочкой, и в таблетках с замедленным высвобождением. Однако, по имеющимся данным, лечение этими препаратами при лучшей переносимости менее эффективно в силу ряда причин: 1) меньшее содержание элементарного железа; 2) железо не полностью высвобождается в двенадцатиперстной кишке [22]. При неэффективности лечения ПЖ в таблетках, покрытых кишечнорастворимой оболочкой, или с замедленным высвобождением могут быть с успехом назначены препараты сульфата железа в таблетках с обычным механизмом высвобождения [38] В качестве мер борьбы с нежелательными явлениями со стороны ЖКТ может быть рассмотрено уменьшение дозировки, смены соли железа или лекарственной формы препарата [38].
Оптимальное всасывание препаратов солей железа происходит в кислой среде. Аскорбиновая кислота увеличивает абсорбцию железа [13].
Парентеральное введение ПЖ по сравнению с пероральным не ускоряет существенно темпы прироста Hb [13, 14], кроме случаев мальабсорбции. Решение о назначении парентеральных ПЖ должно быть принято при непереносимости минимум двух препаратов для приема внутрь или низкой приверженности пациента лечению [13].
Кроме того, показаниями к назначению парентеральных ПЖ являются:
- неэффективность лечения пероральными препаратами;
- повышенная потребность в железе при хронической некорректируемой кровопотере или хроническом гемодиализе;
- нарушение всасывания железа вследствие заболеваний ЖКТ, например целиакии, атрофического гастрита;
- воспалительные заболевания кишечника, сопровождающиеся неэффективным эритропоэзом, нарушением абсорбции железа и плохой переносимостью ПЖ;
- тяжелая анемия с неготовностью/противопоказаниями к проведению гемотрансфузии;
- необходимость быстрого восстановления запасов железа в организме [22];
- необходимость применения стимуляторов эритропоэза [29];
- тяжелая послеродовая анемия [29];
- профилактика анемии после операций (совместно с ЭП) [29].
В настоящее время существуют ПЖ для внутримышечного и внутривенного введения. Предпочтение отдается внутривенному пути введения в связи с распространенностью таких нежелательных явлений, как боль и изменение цвета кожи в месте введения, а также возможность образования гематомы при наличии патологии свертывающей системы [29]. Для внутривенного ведения используется три группы ПЖ: железа сахарозный комплекс, железа декстран, железа глюконат (не зарегистрирован в РФ для внутривенного введения), в настоящее время также доступен новый препарат – железа карбоксимальтозат.
Все ПЖ для внутривенного ведения представляют собой коллоидные растворы железоуглеводных частиц [29]. Каждая частица состоит из ядра, которое представлено гидроксидом трехвалентного железа, и углеводной оболочки. Такой комплекс имитирует структуру ферритина, что предотвращает токсическое воздействие неорганического железа. Различия ПЖ для внутривенного введения заключаются в размере ядра, углеводной оболочки, размере частицы в целом [29]. Первыми ПЖ для внутривенного введения стали препараты сахарозного комплекса железа, впервые они были применены в 1947 г. [14]. Затем они были вытеснены декстранами железа, но в настоящее время обновленные сахарозные комплексы железа вновь приобрели актуальность ввиду улучшенного профиля безопасности [14].
При сравнении представителей трех обозначенных групп ПЖ стоит в первую очередь остановиться на особенностях их фармакокинетики. Препараты сахарозного комплекса железа и глюконата железа назначаются только внутривенно, для декстрана железа возможно внутримышечное введение, хотя этот путь нежелателен по указанным выше причинам.
Общим для всех комплексов железа является следующее: из плазмы они захватываются макрофагами РЭС печени, селезенки и костного мозга, где происходит высвобождение железа из углеводных комплексов и депонирование в виде низкомолекулярных соединений. Затем железо депонируется в виде ферритина или из клеточного депо связывается с ТСФ и в таком виде становится доступным для клеток эритроидного ростка. Следует отметить, что одним из ключевых факторов, влияющих на высвобождение железа из клеток РЭС, является степень активности эритропоэза в костном мозге [30].
Период полувыведения для декстранов железа колеблется от 5 до 20 часов, сахарозного комплекса железа составляет 6 часов, глюконата железа – 1 час. Это напрямую влияет на частоту введения; так, декстраны железа назначаются с интервалами от 2 до 7 дней, а препараты сахарозного комплекса железа и глюконата железа могут назначаться каждые 24 часа. Ключевая особенность препаратов декстрана железа – это возможность введения в виде однократной дозы, включающей всю необходимую курсовую дозу железа. Этот способ применения многими исследователями считается более удобным, безопасным и экономически эффективным [14].
Особенности химической и пространственной структуры ПЖ для внутривенного введения не позволяют оценить уровень сывороточного железа в период проведения терапии, в связи с чем лабораторный контроль сывороточного железа и насыщения ТСФ может быть осуществлен только после того, как большая часть препарата была выведена из плазмы крови. С учетом фармакокинетики ПЖ для внутривенного введения лабораторный контроль уровня сывороточного железа может быть выполнен не ранее 7-го дня от введения 100 мг декстрана железа и не ранее чем через 2 недели после введения 500 мг этого препарата, тогда как после введения 125 мг глюконата железа или 100 мг сахарозного комплекса железа кровь на сывороточное железо может быть взята через 24–48 часов [29].
Для препаратов сахарозного комплекса железа (в РФ – железа [III] гидроксид сахарозный комплекс): 100–200 мг железа не чаще 3 раз в неделю, максимально допустимая разовая доза должна быть не более 7 мг/кг 1 раз в неделю, но не выше 500 мг железа. Перед введением первой терапевтической дозы необходимо ввести тест-дозу 20 мг железа.
Однако существуют клинические данные об эффективности и безопасности применения сахарозного комплекса железа пациентами с ХПН в дозе 500 мг/сут в течение двух последующих дней [14].
Декстран железа (в РФ – железа [III] гидроксид декстран) вводится в дозе 100–200 мг железа 2–3 раза в неделю. Также широко распространено применение всей курсовой дозы однократно. Возможно, но не желательно внутримышечное введение препарата. Перед введением первой терапевтической дозы необходимо ввести тест-дозу 25 мг железа. Анафилактическая реакция может развиваться после нескольких капель препарата [14].
Глюконат железа вводится в дозе 125 мг железа. Следует еще раз подчеркнуть, что препарат не зарегистрирован в РФ.
Карбоксимальтозат железа применяется в следующих дозах: внутривенно струйно в максимальной суточной дозе до 4 мл (200 мг), но не чаще 3 раз в неделю; внутривенно капельно в течение 15 минут в максимальной суточной дозе до 20 мл (1000 мг), не более 1 раза в неделю.
Безопасность ПЖ
ПЖ для внутривенного введения по сравнению с другими часто назначаемыми препаратами имеют гораздо более высокую частоту нежелательных эффектов.
Нежелательные явления, вызываемые ПЖ для внутривенного введения, отчасти связывают с выделением т. н. лабильного железа, которое определяется как часть введенной дозы железа с биологической активностью, отличной от основной части препарата. Нежелательные явления, относящиеся к выделению лабильного железа, – это артериальная гипотония, судороги, диарея, боли в груди. Выделение такого железа находится в зависимости от размера ядра частицы препарата, т. е. чем меньше ядро, тем больше выделение железа. Соли железа по возрастанию размера ядер располагаются в следующей последовательности: глюконат железа, сахарозный комплекс железа, декстран железа. В связи с этим нужно заметить, что дозировка и скорость введения ПЖ должны быть ниже у пациентов с низкой ОЖСС [29].
Препараты сахарозного комплекса железа обладают улучшенным профилем безопасности: при применении около 20 млн доз препарата, назначенных примерно 1 млн пациентов по всему миру, было отмечено всего 52 анафилактоидные реакции, только 22 из которых были расценены как серьезные, без летальных исходов [14]. Нежелательные эффекты этой группы препаратов встречаются примерно в 5 % случаев и наиболее характерные из них – артериальная гипотония, судороги, тошнота, рвота, головная боль, диарея [14].
При применении препаратов декстрана железа наиболее грозным, хотя и редким побочным эффектом (0,6–2,3 % случаев), является анафилактическая реакция, проявляющаяся сосудистым коллапсом и острой дыхательной недостаточностью [29], за которыми могут последовать инсульт или инфаркт миокарда [14]. В США с 1976 по 1996 г. зарегистрировано 196 таких аллергических/анафилактических реакций, в т. ч. 31 случай с летальным исходом [14]. В настоящее время причина развития анафилактических реакций при назначении декстрана железа не уточнена: предполагается, что все дело в самом полимере декстрана, способствующем высвобождению медиаторов из тучных клеток [29].
Частота нежелательных явлений, вызванных препаратами декстрана железа, по разным данным, колеблется от 2 до 25 % [14]. Наиболее характерные из них – артралгия и лихорадка, на долю которых приходится приблизительно треть всех системных реакций. Реже могут развиваться артериальная гипотония, миалгия, головная боль, боли в животе, тошнота и рвота, головокружение, лимфоаденопатия, выпот в плевральной полости, зуд, крапивница, судороги, приливы, озноб, флебит [14].
Согласно данным, полученным в ходе клинических исследований, наиболее частыми (≥ 10 %) нежелательными явлениями для глюконата железа у взрослых пациентов являются тошнота, рвота и/или диарея, реакция в месте введения, артериальная гипотония, судороги, артериальная гипертензия, головокружение, одышка, боли в груди, судороги в икроножных мышцах и боли [30].
Заключение
Разные анемии, сопровождающиеся гипоферремией, в силу патогенетических особенностей требуют различных подходов к медикаментозной коррекции. Не вызывает сомнений ведущая роль ПЖ в лечении ЖДА с достаточно проработанными показаниями к применению препаратов для внутривенного введения. Существуют алгоритмы коррекции анемии при ХПН с применением ЭП и ПЖ для внутривенного введения. Имеющаяся доказательная база по лечению АХЗ достаточно противоречива; для решения вопроса о целесообразности назначения ПЖ требуется тщательная оценка как клинической симптоматики, так и лабораторных данных, отражающих обмен железа.



