Распространенность анемий у женщин детородного возраста в некоторых регионах России достигает 30–60 % [1], что связывают с обильными месячными кровотечениями, которые, как правило, обусловлены наличием гинекологических заболеваний [2]. Приблизительно 70–80 % всех анемий являются железодефицитными (ЖДА) и связаны с хронической кровопотерей, поэтому у женщин они развиваются чаще, чем у мужчин [3]. Степень снижения уровня гемоглобина (Hb) определяет не только тактику лечения основного заболевания, но и течение беременности, трудоспособность и качество жизни гинекологических больных [2]. Разработаны рекомендации по лечению анемий с применением различных железосодержащих препаратов, методам их применения [4]. Помимо связи с кровопотерей нет достоверных данных о влиянии патологического процесса на развитие анемии у больных гинекологическими заболеваниями. В последнее время актуальны исследования, направленные на изучение факторов, определяющих прогноз терапии анемии у гинекологических больных, показаний к использованию дополнительных методов коррекции анемии в случае недостаточной эффективности препаратов железа [5].
Анализ современных данных литературы показывает рост заболеваемости опухолями женской репродуктивной системы [6]. Рак шейки матки (ШМ) занимает второе место среди онкологических заболеваний у российских женщин после рака молочной железы. В Европе по распространенности он уступает раку тела матки, который у 70–90 % больных сопровождается хронической кровопотерей, как и рак ШМ [6, 7]. Анемии при онкологическом процессе в дебюте заболевания возникают у 20–40 % больных, а на фоне лечения их частота достигает 80 % [8, 9]. Снижение уровня Hb при злокачественных опухолях связано с кровопотерей, влиянием медиаторов воспаления, нарушением выработки эндогенного эритопоэтина (ЭПО) [10], воспалительным перераспределением железа. Для онкологического процесса помимо снижения срока жизни эритроцитов в связи с ускоренным гемолизом характерно снижение их продукции в костном мозге вследствие фиброза, вторичной недостаточности фолатов и витамина В12 [11]. В массе научных работ и клинических исследований доказана зависимость эффективности лучевой и полихимиотерапии от уровня Hb, установлены частые осложнения в послеоперационном периоде при выраженных анемиях, показана связь стоимости лечения, снижения качества и продолжительности жизни у онкологических больных с тяжестью анемического синдрома [12]. Анемии у онкогинекологических больных во всех исследованиях объединяются с анемиями при злокачественных новообразованиях и не изучены в качестве отдельной группы анемий, как и анемии у гинекологических больных в целом. До настоящего времени не определены параметры, характеризующие анемии и рекомендации по коррекции анемического синдрома в данной группе с учетом возможных особенностей влияния онкологического процесса и лечебных мероприятий на развитие анемии.
Цель работы – разработка с учетом выявленных особенностей дифференциальных диагностических критериев и рекомендаций по лечению анемий, связанных с заболеваниями женской репродуктивной системы.
Материал и методы
Были проанализированы данные, полученные при обследовании 584 пациентов, в т. ч. 170 женщин с гинекологическими заболеваниями, 332 – с онкогинекологическими процессами. В число обследованных входили также 31 пациентка с онкологическими заболеваниями, 23 больных с заболеваниями желудочно-кишечного тракта (ЖКТ), 5 пациенток с гематологическими заболеваниями, 9 беременных женщин и 14 практически здоровых людей.
Общее распределение гинекологических больных, вошедших в исследование, было следующим: с фоновыми и предраковыми заболеваниями ШМ – 53 пациентки, с гиперпластическими заболеваниями эндометрия – 37, с доброкачественными и пограничными опухолями яичников – 32, с миомой матки (ММ) – 40, с менометроррагиями без наличия определенного гинекологического заболевания – 8. В группу онкогинекологических больных входили женщины с диагностированным раком ШМ (n = 91), раком тела матки (n = 123), саркомой матки (n =13), раком яичников (n = 88), с раком вульвы (n = 17). Онкологические больные были отнесены к двум группам. Первая включила женщин с первично-множественными злокачественными опухолями (n = 20), одна из которых была гинекологического происхождения. Во вторую группу входили больные со злокачественными образованиями негинекологического профиля (n = 11).
Стандартный объем специализированного обследования и хирургического лечения гинекологических, онкогинекологических и онкологических больных осуществлялся в онкогинекологических отделениях 40-й ГКБ Москвы (зав. отделением – к.м.н. Саранцев А.Н.) и 57-й ГКБ Москвы (больных, наблюдающихся в онкологическом диспансере № 3 Москвы) (зав. отделением – к.м.н. Вознесенский В.И.). Больным, направленным в МОНИКИ, по рекомендации гинеколога специализированное обследование и лечение проводились по месту жительства.
Определялись количество эритроцитов (RBC), уровни Hb, гематокрита, средний объем эритроцитов, среднее содержание гемоглобина в эритроцитах (МСН), СОЭ, уровни ретикулоцитов, ЭПО, сывороточного железа и ферритина; проводилось исследование миелограммы с подсчетом количества эритрокариоцитов.
Статистическая обработка полученных результатов проведена методом описательной статистики с использованием программного обеспечения Excel 2003, Statistica. Для статистического анализа показателей использовано среднее значение признака (М) ± стандартное отклонение (SD). Сравнение параметров в группах проведено по данным среднего значения признака ± стандартная ошибка (m). Корреляция показателей определена методом корреляционного анализа с использованием коэффициента корреляции (r), а статистическая значимость различий – по t-критерию Стьюдента. Различия между сравниваемыми параметрами считали статистически значимыми при p ≤ 0,05.
Результаты и обсуждение
Настоящее исследование посвящено актуальной проблеме исследования анемий у женщин с заболеваниями репродуктивной системы. Данная работа связана с необходимостью оценить различные патологические процессы, оказывающие определенное влияние на развитие анемии у женщин. Включенные в исследование больные были разделены на две основные группы: с наличием и отсутствием онкологического процесса. Пациентки без онкологического процесса названы в работе гинекологическими больными. Данная категория, как правило, нуждается в медицинском обслуживании у специалистов в области акушерства и гинекологии. При гинекологических заболеваниях лечение анемий должно включать устранение источника кровопотери и восполнение железодефицита.
Вторую группу пациенток обозначали как онкогинекологических больных. Для лечения анемий у указанной категории больных должны использоваться специальные методы лечения.
В работе установлена верхняя граница уровня Hb для определения анемии, соответствующая 110 г/л. Такое значение Hb выбрано исходя из международных стандартов показателей Hb у женщин и для исключения попадания в группу анемий больных с незначительным снижением уровня Hb (ниже 120 г/л) в результате гиподинамии, связанной с основным заболеванием и лечебно-диагностическими мероприятиями на этапе обследования.
Частота встречаемости анемии при гинекологических заболеваниях составила 25,7 %. Наиболее частыми причинами ее развития явились ММ и заболевания яичников. При ММ выявлена максимальная частота анемии – 71,5 % (р < 0,001), хотя клинически выраженные менометроррагии встречались у 17,5 % больных. При заболеваниях яичников анемия выявлена у 29 % пациенток (р < 0,05). Ее причиной были дисфункциональные маточные кровотечения. При фоновых и предраковых заболеваниях ШМ больных с патологической кровопотерей не выявлено, однако значительное (15,9 %) число пациенток с анемией свидетельствует о существенной роли заболеваний шейки матки в ее развитии. При заболеваниях эндометрия анемия выявлена у 20,5 % больных, причем основной ее причиной являлась гиперполименорея, отмеченная у 67–70 % больных. Итак, анемия при гинекологических заболеваниях развивается у пациенток с хронической кровопотерей, которая является закономерным следствием заболеваний яичников и гиперпластических процессов в эндометрии, и у женщин с ММ и заболеваниями ШМ без выраженных признаков нарушения менструального цикла. В целом анемии при гинекологических заболеваниях определены как ЖДА – гипохромные гиперрегенераторные анемии с низким содержанием сывороточного железа и ферритина.
Это доказано следующими результатами исследования:
• корреляция концентрации гемоглобина и МСН (r = 0,35, t = 2,04, р < 0,05) в группе гинекологических больных с анемиями;
• статистически значимое снижение средних значений концентрации Hb (р < 0,001) и МСН (р < 0,001) у пациенток с анемией по сравнению с гинекологическими больными без анемии;
• повышение числа ретикулоцитов в группе больных анемией на 24,5 ± 0,35 ‰ по сравнению с контрольной группой практически здоровых людей (р < 0,001);
• уменьшение размеров ретикулоцитов (p < 0,01) и появление более молодых их форм (p < 0,05);
• снижение уровня сывороточного железа до 4,3 ± 0,72 мкмоль/л, ферритина – до 7,4 ± 3,6 мкг/л.
У ряда женщин с предраковыми заболеваниями ШМ (тяжелая дисплазия) и гиперпластическими заболеваниями миометрия (ММ больших размеров и/или с быстрым ростом) на фоне сохранной и неизмененной менструальной функции выявлено статистически значимое снижение RBC (4,16 ± 0,39 × 1012/л и 3,79 ± 0,42 × 1012/л соответственно; p < 0,05) по сравнению с начальными стадиями этих заболеваний (4,51 ± 0,10 × 1012/л и 4,29 ± 0,54 × 1012/л соответственно), а у пациенток с опухолями яичников – повышенное СОЭ (в среднем 30,02 ± 3,62 мм/ч), что является признаком анемии хронических заболеваний [11]. Наиболее характерна анемия больных ММ [13], причем в группе с ММ больших размеров и/или быстрым ростом средние показатели концентрации Hb находятся в пределах значений анемии легкой степени тяжести (107,89 ± 20,1 г/л). Поэтому данная патология отнесена к заболеваниям с высоким риском развития ЖДА. С учетом полученных данных определены показания к проведению терапии препаратами железа у всех гинекологических больных при снижении концентрации Hb ниже 110 г/л, а у больных ММ больших размеров и/или с быстрым ростом – вне зависимости от концентрации Hb.
Поскольку ЖДА у гинекологических больных представляет собой сложную патологию, имеющую несколько важнейших причин (физиологическая кровопотеря, которая при ряде гинекологических заболеваний приобретает патологический характер, снижение продукции эритроцитов при ряде заболеваний и др.), в рамках проведенного исследования оценивалось содержание эндогенного ЭПО. Полученные данные подтверждают снижение содержания ЭПО у гинекологических больных с ЖДА [5]. Сравнение проведено с гематологическими больными с миелодиспластическим синдромом и парциальной красно-клеточной аплазией, у которых, по данным литературы [11, 14, 15], имеет место адекватная выработка ЭПО в ответ на гипоксию (см. таблицу). Снижение содержания ЭПО (р < 0,05) у гинекологических больных с ЖДА по сравнению с гематологическими больными доказывает влияние хронического заболевания на развитие анемии при патологии женской репродуктивной системы как одной из основных причин ее развития. В сравниваемых выборках отличий по возрасту, длительности заболевания и тяжести анемии не выявлено.
Всем больным после установления диагноза ЖДА проведена терапия препаратами железа. В основном применялись пероральные препараты железа, при наличии противопоказаний, неэффективности их в анамнезе использованы парентеральные средства. Лечение проводилось длительно и в максимальных дозах. В качестве таблетированного препарата использован Сорбифер Дурулес по 1 таблетке (100 мг железа) 2 раза в день в течение 2–6 месяцев, для внутримышечных инъекций использован Феррум Лек (100 мг железа) через день в течение 2 недель с последующей пероральной терапией. У всех больных получен эффект от лечения, однако он был разным и по изменению жалоб, и по данным лабораторных показателей. Сроки их восстановления у наблюдавшихся больных различались в зависимости от течения основного заболевания. Нормализация показателей Нb, RBC, МСН, СОЭ отмечена через 2–6 месяцев после начала лечения. Сроки были короче у больных язвенной болезнью и пациентов с геморроидальными кровотечениями (1,7 ± 0,8 месяца), но более длительными при продолжительных обильных месячных кровотечениях (2,5 ± 1,8 месяца; р < 0,05). Анализ эффективности проведенного лечения ЖДА выявил прогностические признаки быстрого ответа на терапию. Первичные показатели МСН были статистически значимо снижены (19,1 ± 4,3 пг; р < 0,05) у больных с приростом концентрации Hb менее 30 г/л за первый месяц лечения по сравнению с другими пациентками (25,0 ± 4,5 пг), а увеличение концентрации Hb меньше, чем на 15 г/л, отмечено только у больных с сочетанной патологией женской репродуктивной системы и ЖКТ. Исследование миелограмм больных ЖДА выявило, что одной из причин низкой скорости прироста Hb (< 30 г/л в месяц) является статистически значимое снижение содержания эритрокариоцитов в костном мозге до 18,4 ± 7,6 % (р < 0,05) по сравнению с группой пациенток с приростом концентрации Hb выше 30 г/л в месяц (45,8 ± 8,4 %). Таким образом, доказано, что лечение ЖДА не приводит к быстрому подъему концентрации Hb при сочетанной патологии, выраженной гипохромии эритроцитов и сниженном процентном содержании эритрокариоцитов в костном мозге. Это особенно важно для больных с ММ и дисплазией шейки матки, т. к. основным методом лечения данной группы больных является хирургическое удаление опухоли, требующее предоперационной подготовки больных, т. е. быстрой коррекции концентрации Hb.
При наличии тяжелой анемии у больных с дисплазией ШМ и ММ следует провести исследование эндогенного ЭПО, и в отсутствие хорошего ответа на лечение препаратами железа можно рекомендовать терапию анемии с использованием рекомбинантного ЭПО (рЭПО) как патогенетический метод коррекции анемии хронических заболеваний. В работе получены данные, что при тяжелой ЖДА (концентрация Hb ниже 70 г/л) у всех гинекологических больных статистически значимо увеличивается частота встречаемости “анемических жалоб” на слабость и головокружение (до 100 %; р < 0,05), а терапия препаратами железа в адекватных дозах улучшает качество их жизни уже через месяц лечения, когда отмечается снижение числа больных с жалобами на слабость и головокружение (с 48 до 9 %; р < 0,01).
При обследовании онкогинекологических больных у 30,5 % из них выявлена анемия, не зависящая от возраста и клинически выраженной кровопотери и связанная со стадией заболевания. Данная анемия связана со снижением продукции эритроцитов в костном мозге, является гипохромной и развивающейся на фоне опухолевой интоксикации.
Снижение продукции эритроцитов в костном мозге доказано корреляцией показателей МСН и RBC (r = 0,50, t = 3,39; р < 0,001) в группе онкогинекологических больных с анемией и снижением количества ретикулоцитов (4,7 ± 3,1 ‰) по сравнению с контрольной группой практически здоровых людей (р < 0,001).
Гипохромный характер анемии подтвержден значимой корреляцией показателей Hb и МСН (r = 0,42, t = 2,99; р < 0,01) в группе онкогинекологических больных с анемией, что больше, чем у онкологических больных с анемией (r = 0,50; р < 0,05), и наличием статистической разницы между уровнем МСН у онкогинекологических больных с анемией (27,38 ± 3,65 пг) и без нее (29,71 ± 2,94 пг; р < 0,001).
Влияние опухолевой интоксикации при анемиях на фоне злокачественного заболевания женской репродуктивной системы подтверждается:
• самой высокой встречаемостью ускоренной СОЭ (67,8 %) у онкогинекологических больных (р < 0,001) по сравнению с другими анемическими показателями;
• наличием отрицательной корреляции показателей Нb и СОЭ (r = -0,28, t = 1,99; р около 0,05) у онкогинекологических больных с анемией, меньшей, чем у онкологических больных (r = - 0,51; р < 0,05);
• более высоким СОЭ у онкогинекологических больных с анемиями (38,59 ± 17,59 мм/ч), чем в той же группе без доказанного снижения концентрации Нb (29,25 ± 13,79 мм/ч; р < 0,01), в отличие от гинекологических больных, у которых не выявлена корреляция Нb и СОЭ.
При сравнении показателей Нb, RBC и СОЭ не выявлено статистически значимых различий между ними в зависимости от наличия кровотечений в дебюте заболевания. Наибольшее влияние на эритропоэз доказано при раке ШМ, при котором выявлено снижение средних показателей Нb и RBC (Нb – 110,29 ± 17,82 г/л, RBC – 3,84 ± 0,59 × 1012/л; р < 0,05) по сравнению с больными гиперпластическими заболеваниями ШМ (Нb – 123,50 ± 18,35 г/л, RBC – 4,23 ± 0,53 × 1012/л). У больных саркомой матки выявлены самые низкие значения Hb и RBC в группе (106,71 ± 9,36 г/л и 3,64 ± 0,23 × 1012/л соответственно), самое высокое среднее значение СОЭ (30,72 ± 3,19 мм/ч). Неблагоприятными признаками, присутствие которых может косвенно свидетельствовать о наличии злокачественного процесса при гинекологическом заболевании, могут быть высокая СОЭ (по полученным данным достоверно отличается от определяемой у гинекологических больных в 60 % случаев), низкая концентрация Hb (у 40 % больных), низкий показатель RBC (у 40 % больных).
Доказана роль стадии онкологического процесса и противоопухолевой терапии в развитии анемии при злокачественных заболеваниях женской половой системы. Выявлено статистически значимое снижение показателей Hb (115,2 ± 20,8 г/л; р < 0,001) и RBC (3,7 ± 0,6 × 1012/л; р < 0,05) после противоопухолевого лечения у больных, в дальнейшем умерших от прогрессирования заболевания, по сравнению с больными в ремиссии (Hb – 131,9 ± 11 г/л, RBC – 4,2 ± 0,4 × 1012/л). Так, при восстановлении концентрации Hb и RBC у онкогинекологических больных после противоопухолевого лечения существует достоверная вероятность долгосрочной ремиссии заболевания. При динамическом снижении уровня Hb и RBC, а также увеличении СОЭ доказан высокий риск неполной ремиссии или быстрого рецидива онкологического заболевания. Установлено, что противоопухолевое лечение само по себе является важнейшим методом борьбы с анемией, т. к. среди больных в ремиссии после комплексной терапии ни одного с Hb менее 90 г/л, жалобами на слабость и головокружение не выявлено.
Наличие зависимости снижения концентрации Hb от RBC (р < 0,001), гипохромный характер анемии, данные литературы о неадекватной выработке ЭПО при онкологическом процессе [11] позволили рекомендовать использование рЭПО в сочетании с препаратами железа в качестве патогенетической терапии анемии у онкогинекологических больных. Применялись стандартные дозы рЭПО (Эпрекс): 10000 МЕ подкожно 3 раза в неделю на фоне полихимиотерапии и 40000 МЕ подкожно раз в неделю после противоопухолевой терапии. С учетом гипохромного характера анемии при онкогинекологическом заболевании всем больным назначено рЭПО на фоне препаратов железа (Сорбифер Дурулес по 1 таблетке 2 раза в день), хотя прямых показаний к их применению не было. В начале лечения рЭПО с препаратами железа среднее значение концентрации Hb составляло 83,6 ± 8,66 г/л, а у больных, не получавших противоанемическую терапию, – 115 ± 4,65 г/л (р < 0,05). В период наблюдения после противоопухолевого лечения рост концентрации Hb на фоне терапии рЭПО (90 ± 10,64 г/л) доказан отсутствием значимой разницы по сравнению с группой больных без рЭПО (102 ± 5,01 г/л; см. рисунок). Данная терапия с использованием стандартных доз показала свою эффективность и поэтому может быть рекомендована на фоне противоопухолевого лечения всем больным с концентрацией Hb ниже 110 г/л, начиная с послеоперационного периода, когда выявлено статистически значимое снижение уровня Hb (р < 0,05).
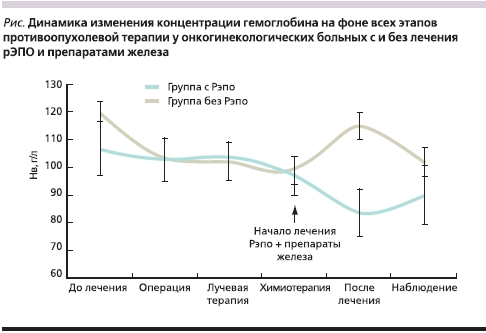
Наличие “анемических жалоб” на слабость и головокружение при Hb ниже 90 г/л (встречаются у 60 % больных; р < 0,05) служит статистически значимым критерием назначения рЭПО в качестве средства, направленного на улучшение качества жизни онкогинекологических больных.
Выводы
1. Анемии, возникающие вследствие гинекологических заболеваний женской репродуктивной системы, независимо от наличия клинически выраженной кровопотери являются ЖДА. Риск и тяжесть возникновения анемии обусловлены патологическим процессом и стадией заболевания. Снижение уровня Hb ниже 110 г/л выявлено у 25,7 % гинекологических больных, наиболее часто – при ММ. Биологической особенностью анемии является снижение продукции эритроцитов при ряде заболеваний на фоне неадекватной выработки эндогенного ЭПО.
2. У онкогинекологических больных анемии связаны со снижением продукции эритроцитов в костном мозге, являются гипохромными, определяются опухолевой интоксикацией и не зависят от наличия хронической кровопотери. Наиболее значимыми дифференциально-диагностическими и прогностическими показателями являются высокая СОЭ, низкие показатели Hb и RBC, которые зависят от стадии заболевания и являются маркерами эффективности терапии. Снижение концентрации Hb ниже 110 г/л выявляется у 30,5 % онкогинекологических больных.
3. Лечение ЖДА гинекологических больных препаратами железа необходимо проводить длительно – до нормализации концентрации Hb и других эритроцитарных показателей. Эффективность лечения ниже при сочетанной патологии женской репродуктивной системы и ЖКТ, выраженной гипохромии и снижении количества эритрокариоцитов в костном мозге. Через месяц после лечения статистически значимо улучшается качество жизни больных.
4. Отсутствие нормализации Hb и эритроцитарных показателей после лечения онкогинекологических больных в сочетании с высокой СОЭ является плохим прогностическим признаком, часто свидетельствующим о неполной ремиссии или риске развития рецидива основного заболевания.
5. Доказана эффективность использования препаратов рЭПО с препаратами железа в стандартных дозах в лечении анемий при злокачественных заболеваниях женской репродуктивной системы. Данная схема антианемической терапии на фоне противоопухолевого лечения должна рекомендоваться начиная с послеоперационного периода всем больным с концентрацией гемоглобина ниже 110 г/л. Концентрация гемоглобина ниже 90 г/л служит достоверным критерием назначения рЭПО в качестве средства, направленного на улучшение качества жизни онкогинекологических больных на любом этапе наблюдения.


